经阴道子宫下段切开取胚联合瘢痕缺陷修补术7例体会
丁 锦,倪观太
(皖南医学院附属弋矶山医院 妇产科,安徽 芜湖 241001)
剖宫产切口瘢痕妊娠(caesarean scar pregnancy,CSP)是指有前次剖宫产史孕妇,胚胎着床于子宫下段剖宫产切口瘢痕处,是一种特殊部位的异位妊娠,也是剖宫产远期并发症之一[1]。近些年随着剖宫产率的上升,CSP的发生率也不断升高,发病率在1/2 216~1/1 800左右[2]。CSP患者继续妊娠风险极高,处理不及时易导致难治性的子宫出血或子宫破裂而需切除子宫甚至危及患者生命,临床处理极为棘手,但目前治疗方案尚无统一标准。传统的治疗方法有单纯MTX药物治疗、介入治疗、清宫术、经腹或宫腹腔镜瘢痕病灶切除,但都存在疗程长、效果不确切或创伤大等不足[3]。2012年以来我们通过经阴道子宫下段切开取胚联合瘢痕缺陷修补术治疗剖宫产切口瘢痕妊娠7例患者,均获得满意效果,治愈的同时有效保护了患者的生育能力,现报道如下。
1 资料与方法
1.1 一般资料 收集2012年12月~2013年11月我院收治的剖宫产术后子宫切口瘢痕妊娠患者共7例,均经血β-人绒毛膜促性腺激素(β-HCG)测定、经彩色B型超声确诊、部分经MRI等检查补充确诊。患者年龄26~42岁;剖宫产次数1~2次,剖宫产方式均为子宫下段横切口,距前次剖宫产的时间最短2年,最长10年,均有人工流产史,最多有9次(见表1)。
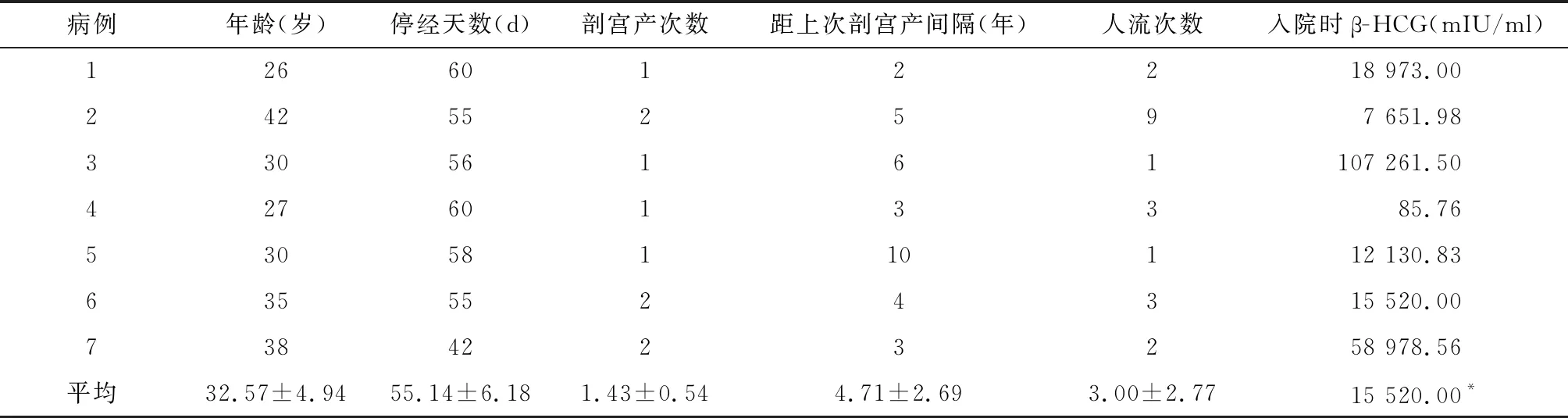
表1 7例剖宫产术后子宫切口瘢痕妊娠患者一般资料
1.2 临床表现 所有患者均有典型停经史,但均未超过60 d。4例无阴道流血及腹痛等任何症状,均于体检时B超检出;3例伴不规则阴道流血,其中1例合并有轻微的下腹隐痛,阴道流血持续时间长(8~30 d),量一般不多,仅文中4号患者因大量阴道流血急诊入院。
1.3 辅助检查 ①血β-HCG为85.76~107 261.50 mIU/ml,中位数为15 520.00 mIU/ml。②B超图像:7例患者均经B超确诊,均发现子宫下段剖宫产切口处妊娠囊样包块或无回声区,包块大小17 mm×12 mm~30 mm×19 mm,包块附着处子宫前壁肌层变薄,最薄处2~8 mm,4号患者B超提示包块周围无回声区似与一小静脉相同,不排除小静脉破裂可能。③MRI作为补充检查,MRI提示:子宫瘢痕处肌层最薄处厚度为1~8 mm,宫颈大小、形态及信号均正常,剖宫产瘢痕呈稍长T1、稍短T2信号影,瘢痕处可见孕囊为圆形、类圆形或条状。
1.4 方法
1.4.1 术前准备 均完善血常规、血凝常规、肝肾功能、心电图等术前常规检查,明确无合并症,无麻醉及手术禁忌症。1号和7号患者经药物MTX化疗后血β-HCG继续上升选择手术,4号患者因阴道大量流血急诊入院,行急诊介入止血后因B超提示子宫下段前壁过薄,患者有再生育要求,为避免再次发生瘢痕妊娠致子宫破裂,与家属沟通后亦行手术修补。7号患者要求行腹腔镜结扎手术,术中见子宫下段前壁与腹壁粘连紧密,无法分离,遂在腹腔镜监视下行阴式手术修补。
1.4.2 手术方法 手术均于全麻下进行,患者取膀胱截石位,常规消毒铺巾,金属导管导尿排空膀胱。阴道拉钩暴露阴道、宫颈,宫颈钳钳夹宫颈上唇并向下拉暴露阴道前穹窿,于宫颈阴道间隙予肾上腺素(1滴∶100 ml NS)局部注射膀胱宫颈间隙行水分离。在宫颈钳钳夹处上方的2 cm处横行切开,两边达宫颈10点、2点处,进入膀胱宫颈间隙,用手指向上方及两侧推开膀胱,至膀胱腹膜反折,不穿通反折腹膜,继续向上钝性分离。一般子宫峡部水平局部稍隆起,置入阴道拉钩,多数可见局部子宫浆膜层表面呈紫蓝色,考虑为瘢痕妊娠病灶处。可于子宫峡部水平切开子宫的剖宫产瘢痕组织,常可见暗红色血块伴妊娠组织突出,有时可见典型绒毛组织,修剪切除剖宫产瘢痕,清除组织物,以Alice钳钳夹边缘,弯钳或小卵圆钳伸入切口处清除妊娠组织,再以吸管清理宫腔,刮匙稍搔刮宫腔感毛糙后停止操作。2-0可吸收线连续锁边缝合切口,检查推开膀胱创面无活动性出血点。最后以另外一根2-0可吸收线连续锁边缝合阴道壁,阴道一般放置碘仿包裹的纱条压迫止血,留置尿管保留导尿。
1.4.3 术后处理 ①术后48 h取出阴道内纱布;②保留导尿48 h;③预防感染、适当活动;④每3 d复查血β-HCG;⑤出院后门诊随诊血β-HCG,电话随访术后首次月经来潮情况。
2 结果
2.1 手术情况 7例均顺利完成手术,其中1号患者不慎穿透膀胱反折腹膜进入腹腔,7号患者术中行腹腔镜输卵管结扎术,其余手术均未进入腹腔。术中均见子宫下段前壁瘢痕处有紫蓝色改变,甚至明显突起,切开后见暗红色的血块与组织包裹一起,部分有典型绒毛组织,组织均送检病理,术后病理均提示系子宫平滑肌组织瘢痕组织及镜检绒毛组织,手术时间、术中出血量、住院天数等情况见表2。
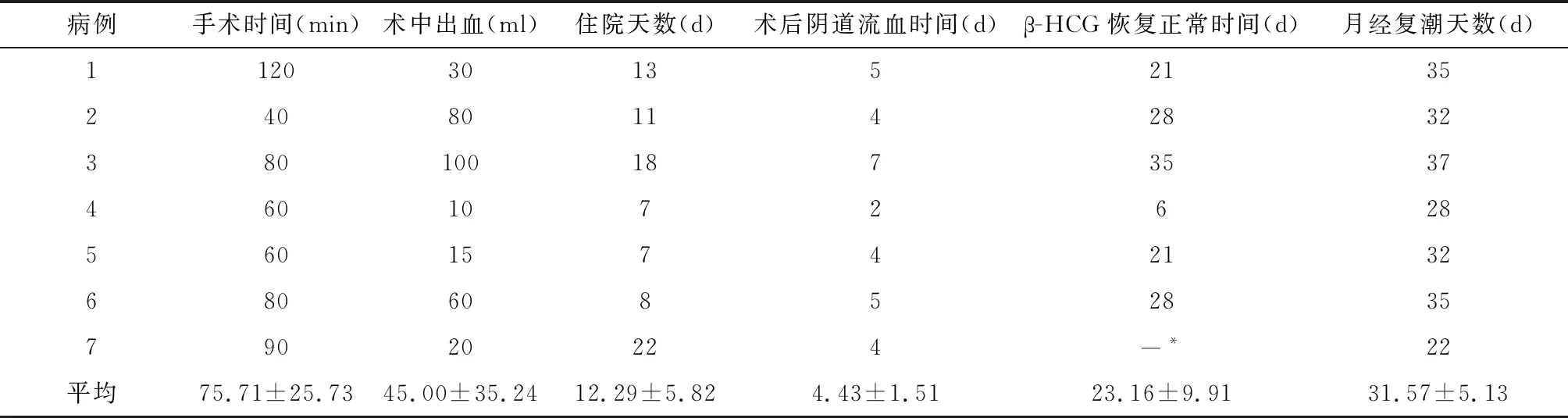
表2 7例患者的术中、术后情况
2.2 术后随访 术后阴道流血时间、β-HCG恢复正常时间、月经复潮天数如表2。其中7号患者首次月经量较少、持续时间较短,其余均与既往月经无明显差异,无阴道淋漓不尽出血,7例患者术后均无发生阴道伤口愈合不良、感染、膀胱损伤、膀胱阴道瘘等手术并发症。
3 讨论
3.1 发病机制 目前CSP发病机制尚不明确,可能是由于剖宫产术后子宫切口愈合不良,瘢痕宽大或者炎症导致瘢痕部位有微小裂隙,当受精卵运行过快或者发育迟缓,在通过宫腔时未具种植能力,当抵达瘢痕处时通过微小裂孔进入子宫肌层而着床[1]。这样的通道也可来自于子宫其他常规性的有创手术如刮宫术、子宫肌瘤剔除术、宫腔镜手术甚至是手取胎盘术,这些有创性的手术均可致内膜基底层损伤而促使内膜与肌层间的微通道形成或者是局部微小楔形缺损[4]。本研究中患者均有多次人流史,最多达9次人流,提示该病可能与宫内膜损伤有关。
3.2 诊断 患者均有1~2次剖宫产史,虽有典型停经史,但大都无明显阴道流血、腹痛等症状,血β-HCG水平离散程度大,这对早期诊断造成困难,临床上有一定的误诊率。经腹超声联合经阴道超声检查是早期诊断CSP的首选方法,具有不可替代的重要作用[5],超声诊断CSP的标准[6-7]:①宫腔及宫颈内未探及妊娠囊。②妊娠囊或包块位于子宫峡部前壁或既往剖宫产瘢痕处。③妊娠囊或包块与膀胱之间的子宫前壁下段肌层缺少正常肌层。④彩色多普勒血流成像在妊娠囊或包块周边探及明显的环状血流信号,脉冲多普勒显示高速(峰值流速>20 cm/s)低阻(搏动指数<1)血流图,与正常早期妊娠血流图相似。⑤附件区未探及包块,子宫直肠陷凹无游离液波(CSP破裂除外)。上述各项指标同时存在方可诊断。Vial Y[8]根据B超声像图将CSP分为两型,Ⅰ型指孕卵种植在瘢痕处,不断向宫腔内发展,胚胎可持续生长甚至可能至胎儿出生,但这大大增加了植入部位大出血的风险;Ⅱ型为孕卵种植在瘢痕处后不断向膀胱、腹腔方向生长,易在妊娠早期就发生流产、出血甚至子宫穿孔破裂。超声检查是临床比较常用的辅助检查手段,诊断符合率高、检查时间短、操作简单、费用低,是剖宫产瘢痕妊娠确诊的主要检查手段,并为治疗方案的选择提供重要参考价值,近些年经阴道彩超的应用进一步提高了CSP的诊断符合率,本研究7例患者均经超声确诊并选择治疗方案。另外盆腔核磁共振(MRI)可作为补充诊断,以提高诊断的准确性。
3.3 处理 CSP诊断或治疗的延迟会导致难治性的子宫出血或子宫破裂而需切除子宫甚至危及患者生命,尤其是Ⅱ型,如本研究中的4号患者,间断点滴出血3日后以阴道大量鲜红色流血急诊入院。所以一经确诊需及时处理,但目前对CSP的处理尚缺乏统一标准[9],目前常用的治疗方法有单纯MTX药物治疗,介入治疗,清宫术,经腹或经宫腹腔镜子宫瘢痕局部病灶清除等治疗。有研究证明[10]:单纯MTX药物化疗治愈率83.3%,药物副作用发生率41.7%,其中33.3%出现月经恢复后淋漓不尽的情况。子宫动脉栓塞联合化疗可减少急性大出血的风险,但可能出现栓塞并发症,治疗及随诊中有可能再次发生大出血及子宫破裂需急诊子宫切除之风险。即使保守治疗成功,也因瘢痕处绒毛植入而使得子宫瘢痕缺损,未修复的瘢痕有破裂的危险,可能影响以后的妊娠及再次发生CSP的可能。即使是在B超引导下的清宫术,刮匙不仅常发生瘢痕处组织残留,还极易诱发瘢痕部位穿孔、致命性大出血及其他严重并发症[11]。手术治疗效果确切,但经腹创伤大,宫腹腔镜下手术风险率较高,鉴于瘢痕妊娠部位低,位置隐蔽,包块向膀胱方向突出,腔镜手术可能会引起难治性出血且止血困难[12]。往往剖宫产术后患者盆腔粘连严重,子宫下段前壁与膀胱腹壁紧密粘连,使腹腔镜手术无法实现,如本组中的7号患者,最终不得不经阴式手术,另外宫腹腔镜对医院设备及手术者经验水平等要求较高,限制了其在基层医院的广泛开展。
CSP治疗的主要目标应该是避免大量失血,保护子宫的生育功能,提高女性生活质量[13]。而经阴道子宫下段切开取胚合并瘢痕缺陷修补术则很好地实现了之一目标,其具有手术成功率高(100.00%)、手术时间短[平均(75.71±25.73)min]、术中出血量少[平均(45.00±35.24)ml]、住院时间短(12.29±5.82) d、手术并发症发生率低(0.00%)及血清β-HCG恢复快[平均(23.17±9.91) d],术后阴道流血时间短[平均(4.43±1.51)d]等优点,且对月经复来超及及月经量影响很小,月经复潮天数平均(31.57±5.13)d,仅7号患者首次月经量较少、持续时间较短(可能系人流时内膜有所损伤),其余均与既往月经无明显差异,无阴道淋漓不尽出血。经阴道子宫下段切开取胚合并瘢痕缺陷修补术尤其适合包块向宫腔外突出的Ⅱ型CSP治疗[14-15]。其更重要的是在处理瘢痕妊娠的同时修补了子宫缺陷,保护了患者的生育功能,可能对再次瘢痕妊娠的发生有一定预防的作用,因手术在腹膜外完成,较开腹手术对盆腔脏器的干扰少,减少术后粘连,故阴式修补子宫缺陷在保护生育功能方面优于经腹修补子宫缺陷。该术式经腹膜外对肠道功能影响小,术后即可进流质饮食,也避免盆腹腔粘连对手术的影响,7例手术中除初次手术经验不足误穿透腹膜外,其余均在腹膜外完成,患者术后进食早、恢复快。需要重视的是孕期患者宫颈软,宫颈膀胱间隙分离困难,应尤其注意避免损伤膀胱。
综上所述,经阴道子宫下段切开取胚合并瘢痕缺陷修补术是一种治疗CSP的新的手术方式,具有效果确切、创伤小、恢复快、安全性高等优点,另外对设备要求不高,操作相对简单,适合在基层医院推广。但因病例少、随访时间不够,仍需加大样本量,继续随访观察了解患者再生育情况,能否预防再发瘢痕妊娠有待进一步随诊,长期疗效需进一步研究。
【参考文献】
[1] 谢幸,苟文丽.妇产科学[M].8版.北京:人民卫生出版社,2013:58.
[2] XIAO AN,XU MING,KE LI,etal.The analysis of efficacy and failure factors of uterine artery methotrexate infusion and embolization in treatment of cesarean scar pregnancy[J].Scientific World Journal,published online oct 24,2013.doi:10.1155/213603.
[3] 单莉莉,乐爱文,肖天慧,等.经阴道子宫下段切开取胚与子宫动脉栓塞术治疗剖宫产瘢痕妊娠的比较性研究[J].中国微创外科杂志,2013,13(7):611-613.
[4] 洪澜,朱根海,杨舒盈.阴式妊娠组织清除术治疗剖宫产术后子宫疤痕妊娠五例临床分析[J].海南医学,2012,23(16):85-87.
[5] 董海伟,杨晓惠,顾向应.超声诊断技术在剖宫产瘢痕妊娠中的应用[J].中国计划生育和妇产科,2013,5(4):20-23.
[6] ASH A,SMITH A,MAXWELL D,etal.Caesarean scar pregnancy[J].BJOG,2007,114(3):253-263.
[7] 文姝,刘永红,江敏.子宫瘢疤痕妊娠33例临床分析[J].中国实用医刊,2013,40(5):85-86.
[8] Vial Y,Petignant P,Hohlfeld P.Pregnancy in a cesarean scar[J].Ultrasound Obstet Gynecol,2000,16(6):592-593.
[9] SINGH K,SONI A,RANA S.Ruptured ectopic pregnancy in caesarean section scar:a case report[J].Case Rep Obstet Gynecol,published online Oct 30,2012.doi:10.1155/2013/106892.
[10] 陈玉清,常亚杰,冯丽萍.子宫切口疤痕妊娠治疗策略分析[J].实用医学杂志,2010,26(18):3383-3385.
[11] 张祖威,常亚杰,陈玉清.阴式子宫切口瘢疤痕妊娠病灶清除术治疗剖宫产切口瘢痕妊娠[J].中山大学学报:医学科学版,2011,32(5):689-693.
[12] HE M,CHEN MH,XIE HZ,etal.Transvaginal removal of ectopic pregnancy tissue and repair of uterine defect for caesarean scar pregnancy[J].BJOG,2011,118(9):1136-1139.
[13] LITWICKA K,GRECO E.Caesarean scar pregnancy:a review of management options[J].Current opinion in obstetrics & gynecology,2013,25(6):456-461.
[14] 王中海,乐爱文,章蓉,等.经阴道子宫下段取胚术合并子宫缺陷修补术治疗剖宫产术后疤痕妊娠[J].中华妇幼临床医学杂志:电子版,2013,9(1):90-93.
[15] WANG DB,CHEN YH,ZHANG ZF,etal.Evaluation of the transvaginal resection of low-segment cesarean scar ectopic pregnancies[J].Fertil Sterl,2014,101(2):602-606.

