发热伴血小板减少综合征病毒细胞表面受体的初步研究
张硕,李建东,曲靖,张福顺,李川,梁米芳,李德新
中国疾病预防控制中心病毒病预防控制所,国家卫生和计划生育委员会医学病毒学重点实验室,北京102206
发热伴血小板减少综合征病毒(severe fever with thrombocytopenia syndrome virus,SFTSV)属布尼亚病毒科白蛉病毒属。其基因组由大(L)、中(M)、小(S)3个单股负链RNA片段组成,引起人严重发热伴白细胞和血小板减少综合征,住院患者病死率高达10%~30%。作为我国首次发现并主要在我国流行的新病原,人群普遍易感,严重威胁公共卫生安全[1]。目前SFTSV的致病机制尚不明确。病毒与宿主细胞表面分子结合是其感染细胞的首要环节,布尼亚病毒科病毒进入细胞主要通过受体介导的内吞作用和pH依赖的膜融合过程实现[2,3]。近期研究结果显示,树突细胞特异性细胞间黏附分子3结合非整合素因子(dendritic cell-specific intercellular adhesion molecule-3-grabbing non-integrin,DC-SIGN)为多种白蛉病毒的受体[4]。在生物遗传学上,SFTSV与其他白蛉病毒差异巨大,属白蛉病毒属的独立分支。因此,DC-SIGN在SFTSV进入细胞中的作用有待研究。本研究对DC-SIGN作为SFTSV的细胞表面受体进行了初步探讨。
1 材料与方法
1.1 材料
SFTSV HB29株由中国疾病预防控制中心病毒病预防控制所病毒性出血热室分离并传代保存;Vero及CHO-K1细胞购自美国国家标准菌种保藏中心(American Type Culture Collection, ATCC),由本室传代保存;病毒核酸提取试剂盒QIAamp Viral RNA Mini Kit 购自Qiagen公司;细胞核酸提取试剂盒RNeasy Mini Kit及SuperScriptTMⅢ Platinum One-Step qRT-PCR System为Invitrogen公司产品;PCR Nucleotide Mix、FuGENE®HD Transfection Reagent为瑞士Roche公司产品;限制性内切酶购自英国Biolab公司;Anti-DC-SIGN mAb 1621 为美国R&D公司产品;引物及探针合成由生工生物工程(上海)股份有限公司完成。
1.2 方法
1.2.1实时反转录-聚合酶链反应检测不同细胞系DC-SIGNmRNA水平
选取Vero及CHO-K1细胞,计数后稀释为5×105个/ml。各取1 ml细胞800 r/min离心5 min,用RNeasy Mini Kit 提取细胞总RNA,用实时反转录-聚合酶链反应(reverse transcriptase-polymerase chain reaction,RT-PCR)检测细胞内DC-SIGN mRNA水平。引物及探针序列如下:DC-SIGN-F:TTCCAAGGAAACTGTTACTTCATG;DC-SIGN-R:GGAAGTTCTGCTCCTCAGCAC;DC-SIGN-Probe:FAM-ACTCCCAGCGGAACTGGCAC-BHQ-2。实时RT-PCR反应体系及条件按说明书进行。
1.2.2实时RT-PCR检测不同细胞系SFTSV感染水平
对上述2种细胞系进行计数,稀释为5×105个/ml。取2 ml传至6孔板,待细胞融合至70%~80%时,加入感染复数(multiplicity of infection,MOI)为1的SFTSV HB29毒株;37 ℃吸附1 h后吸出病毒液,用含2%胎牛血清(fetal bovine serum,FBS)及1%青霉素-链霉素的DMEM培养基清洗细胞表面3次,补入3 ml相同培养基,37 ℃培养72 h。取140 μl 细胞培养上清液,用QIAamp Viral RNA Mini Kit提取病毒RNA,实时RT-PCR检测L、M、S 3个基因片段的RNA水平。引物及探针由本室设计合成并保存[5],实时RT-PCR反应体系及条件按说明书进行。
1.2.3DC-SIGN特异性单克隆抗体抑制SFTSV感染实验
将Vero细胞传至96孔板,待细胞融合至70%~80%时加入不同浓度的DC-SIGN单克隆抗体。将anti-DC-SIGN mAb 1621 用含1%牛血清白蛋白(bovine serum albumin,BSA)的磷酸盐缓冲液(phosphate buffered saline,PBS)稀释成5个浓度,分别为20、40、80、120和160 μg/ml。取50 μl加至细胞表面,每个浓度3个复孔。37 ℃吸附1 h后吸出抗体,用PBS清洗细胞表面3次。加入MOI=1的SFTSV HB29毒株,37 ℃吸附1 h后吸出病毒液,用含2% FBS及1%青霉素-链霉素的DMEM培养基清洗细胞表面3次,补入200 μl相同培养基,37 ℃培养72 h。取140 μl 细胞培养上清液,提取病毒RNA,实时RT-PCR检测SFTSV RNA水平。
1.2.4DC-SIGN重组表达载体的构建
利用RNeasy Mini Kit提取Vero细胞总RNA,反转录为cDNA后扩增DC-SIGN基因片段。所用引物序列如下:DC-SIGN-PC-F:gggcGCTAGCATGAGTGACTCCAAGGAACC;DC-SIGN-PC-R:tgtgGCGGCCGCCTACGCAGGAGGGGGGTTTG。上述基因片段经NheⅠ及NotⅠ双酶切后克隆入哺乳动物细胞表达载体pcDNA5/FRT中,命名为pDC-SIGN。
1.2.5DC-SIGN表达载体转染细胞后SFTSV感染实验
利用FuGENE®HD Transfection Reagent将pDC-SIGN转染至上述2种细胞系。转染前1 d将细胞传至6孔板,待细胞融合至80%~90%时进行转染。用含2% FBS和1%谷氨酰胺的培养基清洗细胞表面2次,补入2 ml相同培养基。制备转染复合物:将2 μg质粒加至100 μl Opti-MEM 中,每种质粒加入5 μl FuGENE®HD Transfection Reagent。轻轻混匀后室温静置20 min,将转染复合物逐滴加至培养基中混匀,37 ℃培养24 h。取转染后及未转染细胞,用MOI=1的SFTSV HB29毒株感染,37 ℃培养。分别于感染后6、12、24、48、72 h 收集病毒上清液,用实时RT-PCR检测SFTSV RNA水平。
2 结果
2.1 不同细胞系DC-SIGN mRNA 及SFTSV感染水平
用实时RT-PCR检测Vero及CHO-K1这2种细胞系中DC-SIGN mRNA水平及其经SFTSV HB29毒株感染72 h后L、M、S 3个基因片段的RNA水平。结果如表1所示,Vero细胞中DC-SIGN mRNA水平较高,CHO-K1细胞中DC-SIGN mRNA水平较低。RNA检测结果显示,Vero细胞对SFTSV较敏感,而SFTSV在CHO-K1细胞中的感染复制水平比Vero细胞低。
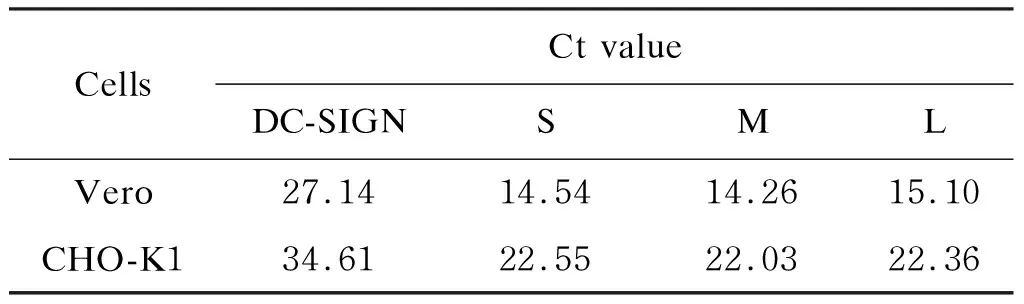
表1 不同细胞系中DC-SIGN mRNA水平及感染SFTSV 72 h后病毒RNA水平Tab.1 DC-SIGN mRNA level and SFTSV RNA level after 72-hour infection in different cell lines
2.2 DC-SIGN单克隆抗体降低Vero细胞中SFTSV的感染水平
用anti-DC-SIGN mAb 1621封闭SFTSV敏感Vero细胞表面的DC-SIGN分子,通过实时RT-PCR初步评价DC-SIGN对病毒感染的影响。结果如图1所示,随着抗体效价逐渐增高,Vero细胞中SFTSV感染水平呈逐渐下降趋势,表明DC-SIGN单克隆抗体在一定程度上能抑制病毒进入宿主细胞,并呈现剂量-效应关系。
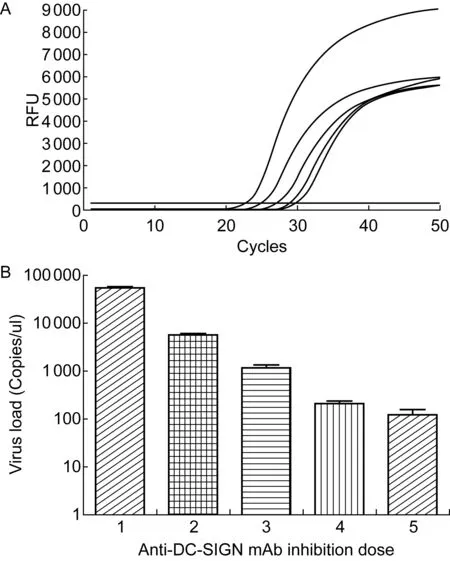
1, 20 μg/ml anti-DC-SIGN mAb; 2, 40 μg/ml anti-DC-SIGN mAb; 3, 80 μg/ml anti-DC-SIGN mAb; 4, 120 μg/ml anti-DC-SIGN mAb; 5, 160 μg/ml anti-DC-SIGN mAb.
2.3 DC-SIGN提高Vero和CHO-K1细胞中SFTSV的感染水平
将表达DC-SIGN的质粒分别转染至Vero和CHO-K1细胞系,并于感染后6、12、24、48、72 h 收集病毒上清液,比较转染前后SFTSV的感染水平。结果如图2所示,2种细胞系在转染DC-SIGN后,SFTSV感染水平在不同时间点均较转染前有一定程度增高,且病毒复制水平随时间有逐渐增高的趋势。结果表明,DC-SIGN可提高Vero和CHO-K1细胞中SFTSV的感染水平。
3 讨论
病毒与宿主细胞表面分子结合是感染的第1步,开启病毒进入细胞的一系列动态过程。许多受体是病毒组织嗜性和致病的决定性因素[6],影响病毒的宿主范围和种间屏障。明确病毒受体和病毒基因组中编码受体结合结构域或基序核苷酸序列,对有针对性地监测环境中病毒动态进化过程、预测疫情的可能趋势具有重要意义;同时病毒与受体相互作用也是抗病毒治疗的潜在靶标。因此,受体一直是病毒学研究的关注点,尤其在引起新发传染病的病毒研究中始终是重点关注之一。病毒受体主要是细胞本来具有的受体,既可以是高度特化的蛋白,仅分布于特定的组织细胞,也可以是高度泛化的细胞膜成分,如整合素及其他细胞间黏附分子等。长期以来一直对布尼亚病毒科病毒的细胞受体知之甚少[3,7],近期研究结果显示DC-SIGN分子为多种白蛉病毒的受体。
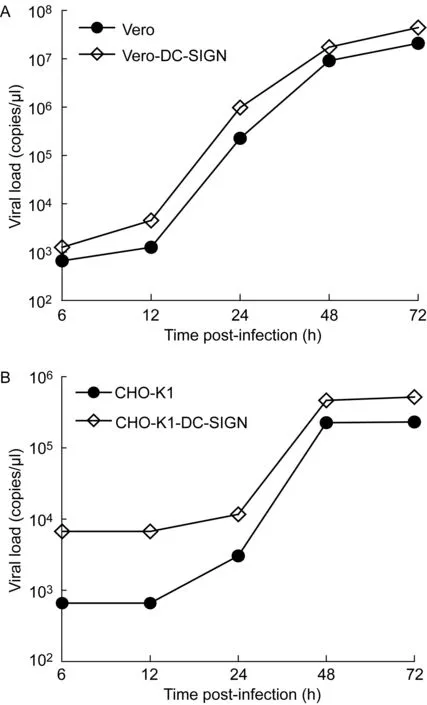
A: Vero cells. B: CHO-K1 cells.
本研究对DC-SIGN作为SFTSV的细胞表面受体进行了初步研究,结果显示DC-SIGN mRNA水平在SFTSV敏感Vero细胞中相对较高,而在CHO-K1细胞中相对较低。此外,DC-SIGN单克隆抗体在一定程度上能抑制病毒进入宿主细胞,并呈现剂量-效应关系,且DC-SIGN可提高细胞中SFTSV感染水平。以上结果表明,DC-SIGN为SFTSV的可能受体,其作用机制还需进一步研究。
病毒与细胞相互作用时,既可通过细胞特异性受体方式相互作用,也可先后与多个受体相互作用,有的还需辅助受体参与。有研究结果显示,不表达DC-SIGN的细胞也能被白蛉病毒属相应病毒感染[4],而SFTSV除经媒介生物传播外,还可发生人与人之间的接触传播[8],提示除DC-SIGN以外还有其他细胞受体存在。
[1] Yu XJ, Liang MF, Zhang SY, Liu Y, Li JD, Sun YL, Zhang L, Zhang QF, Popov VL, Li C, Qu J, Li Q, Zhang YP, Hai R, Wu W, Wang Q, Zhan FX, Wang XJ, Kan B, Wang SW, Wan KL, Jing HQ, Lu JX, Yin WW, Zhou H, Guan XH, Liu JF, Bi ZQ, Liu GH, Ren J, Wang H, Zhao Z, Song JD, He JR, Wan T, Zhang JS, Fu XP, Sun LN, Dong XP, Feng ZJ, Yang WZ, Hong T, Zhang Y, Walker DH, Wang Y, Li DX. Fever with thrombocytopenia associated with a novel bunyavirus in China [J] . N Engl J Med, 2011, 364(16): 1523-1532.
[2] Ellis DS, Shirodaria PV, Fleming E, Simpson DI. Morphology and development of Rift Valley fever virus in Vero cell cultures [J]. J Med Virol, 1988, 24 (2): 161-174.
[3] Schmaljohn C, Nichol S. Bunyaviridae [M]. In: Knipe DM, Howley P. eds. Fields Virology. Volume 2. Philadelphia: Lippincott Williams & Wilkins, 2007: 1741-1789.
[4] Lozach PY, Kühbacher A, Meier R, Mancini R, Bitto D, Bouloy M, Helenius A. DC-SIGN as a receptor for phleboviruses [J]. Cell Host Microbe, 2011, 10(1): 75-88.
[5] Sun Y, Liang M, Qu J, Jin C, Zhang Q, Li J, Jiang X, Wang Q, Lu J, Gu W, Zhang S, Li C, Wang X, Zhan F, Yao W, Bi Z, Wang S, Li D. Early diagnosis of novel SFTS bunyavirus infection by quantitative real-time RT-PCR assay [J]. J Clin Virol, 2012, 53(1): 48-53.
[6] Schneider-Schaulies J. Cellular receptors for viruses: links to tropism and pathogenesis [J]. J Gen Virol, 2000, 81(Pt 6): 1413-1429.
[7] Walter CT, Barr JN. Recent advances in the molecular and cellular biology of bunyaviruses [J]. J Gen Virol, 2011, 92(Pt 11): 2467-2484.
[8] Gai Z, Liang M, Zhang Y, Zhang S, Jin C, Wang SW, Sun L, Zhou N, Zhang Q, Sun Y, Ding SJ, Li C, Gu W, Zhang F, Wang Y, Bian P, Li X, Wang Z, Song X, Wang X, Xu A, Bi Z, Chen S, Li D.Person-to-person transmission of severe fever with thrombocytopenia syndrome bunyavirus through blood contact [J]. Clin Infect Dis, 2012, 54(2): 249-252.

