NT4p53(N15)Ant重组腺病毒对肝癌细胞 腹腔种植瘤的治疗作用
吴学元,白 斌,张党锋,马 巍
(西安交通大学医学院第一附属医院骨科,陕西西安 710061)
研究证实,抑癌基因p53的突变、缺失或功能异常与许多肿瘤的发生、发展存在密切的关系。但是,相当一部分肿瘤细胞内存在野生型p53,因其活性受到抑制而不能发挥作用。因此,激活p53的功能是癌症基因治疗的理想策略。鼠双微体基因2(murine double minute 2, MDM2)作为p53主要的负性调控因子,其N-末端疏水区与p53氨基末端的转录区域结合后,抑制了p53的转录活性[1]。p53-MDM2复合体成为研究抗肿瘤制剂的新靶点[1-2]。KANOVSKY等[3]和DO等[4]发现来源于p53氨基端15肽与穿膜肽(antennapedia, Ant)的融合肽-p53(N15)Ant-具有比野生型p53更强的抗肿瘤作用,可直接诱导癌细胞坏死,但对正常细胞没有毒性;这在传统的基因治疗中极为少见。为解决该活性肽应用到肿瘤治疗中产生的生物半衰期短、易被降解、难以达到有效剂量浓度的缺点,由神经生长因子4(NT4)信号肽引导的可分泌p53(N15)Ant的重组腺病毒表达载体已被成功构建,并证实了该重组病毒对体外肿瘤细胞增殖的抑制及杀伤作用[5-8]。本研究旨在观察Ad-NT4p53(N15)Ant对H22肝癌细胞的腹腔泛发转移和癌性腹水形成的治疗作用。
1 材料与方法
1.1材料Ad-NT4p53(N15)Ant由西安华广生物工程有限公司提供,其合成、分离参考相关文献[8]。小鼠H22肝癌细胞株购自中国科学院上海细胞库。RPMI 1640培养基购自美国Gibco公司;胎牛血清系杭州四季青提供;DAPI染液购自美国Sigma公司。ICR小鼠16只,雌性,体质量20~22 g,8~12周龄,购自西安交通大学医学院实验动物中心。
1.2方法
1.2.1小鼠分组及预先感染腺病毒 把16只ICR小鼠随机平均分成2组,治疗组每只小鼠腹腔内注射0.5 mL Ad-NT4p53(N15)Ant(1×1012pfu/mL),该基因重组腺病毒的鉴定参考文献[6];对照组注射每只小鼠腹腔内等量空病毒0.5 mL(1×1010pfu/mL)。
1.2.2细胞培养 从液氮容器中取出H22细胞冻存管,迅速放入盛有37 ℃水浴中,不断摇动,使之在1 min内融化。当细胞完全解冻后,用含700 mL/L乙醇的纱布擦拭冷冻管消毒。将复苏的H22肝癌细胞加入含有100 mL/L胎牛血清的RPMI 1640培养基的培养瓶中。置37 ℃、50 mL/L CO2温箱内培养,每48 h换液1次,根据生长情况传代培养至一定数量。
1.2.3建立小鼠腹腔种植瘤模型 取ICR小鼠2只,用1 mL注射器把细胞浓度为5×107/mL的0.2 mL H22细胞悬液接种于右后肢皮下。当肿瘤直径长至1 cm时脱臼法处死小鼠,在无菌条件下切去瘤块,将其剪成1 mm3大小的瘤块,加入2 mL PBS溶液,在研钵中研磨,研至匀浆,加入10 mL PBS溶液,冲洗研磨器,收集细胞悬液。在预先腹腔感染病毒48 h后的小鼠右下腹腔内,注射0.2 mL密度为108/mL的细胞悬液,按摩全腹使细胞均匀种植于腹腔内。
1.2.4观察指标
①动物大体情况的观察。每天观察荷瘤小鼠的生长情况,包括是否有竖毛、腹围增加、活动减少及对外界反应迟钝等表现。进行腹部触诊并用注射器试抽腹水,以明确小鼠腹水是否形成。记录小鼠生存天数,若观察至40 d仍有小鼠存活,以脊椎脱臼法处死小鼠并计为存活天数。计算小鼠平均生存期、体重增长率、腹围增长率及腹水量。体重增长率=(死亡时平均体重-初始平均体重)/初始平均体重×100%;腹围增长率=(死亡时平均腹围-初始平均腹围)/初始平均腹围×100%,体重、腹围值为测量3次的平均值。
②腹水肝癌细胞学的检测。当小鼠腹水形成后,抽出腹水,观察其颜色,并在细胞计数板上计数每毫升腹水肝癌细胞数。腹水癌细胞姬姆萨染色:小鼠腹腔内抽取腹水1 mL,推片、干燥后,将姬姆萨染液滴至玻片上,于酒精火焰上方约10 cm处徐徐摆动玻片,温染色30 s后,再自然染色3 min,蒸馏水冲洗。干燥后,置于高倍镜下观察细胞形态。细胞凋亡检测:观察到腹水刚形成后,抽取腹水原液1 mL,1 500 r/min离心5 min,弃去上清。加入500 μL的1×Binding Buffer,加入5 μL Annexin-V-FITC,避光冰浴15 min。样品上机前加入10 μL PI,进行流式细胞仪分析。
③腹腔肿瘤的观察。死亡小鼠行尸体解剖,观察腹腔内瘤体大小及瘤体结节数量,并切取肿瘤组织称湿重。抑瘤率=(对照组平均瘤重-治疗组平均瘤重)/对照组平均瘤重×100%。
1.3统计学分析应用SPSS 18.0统计软件进行数据分析。各组间计量资料采用均值±标准差表示,两组样本的均数的比较采用单因素方差分析,比较用t检验,以P<0.05表示差异有统计学意义。
2 结 果
2.1荷瘤小鼠各项指标的比较当小鼠腹围增加、触诊扪及腹腔内瘤块或试抽腹水在光镜下检测到瘤细胞则可确定腹腔种植瘤形成。对照组在注射第12天后出现不同程度的腹围增加、活动逐渐减少,移植后第15天,全部成瘤。在移植后第22天开始出现死亡,死亡时小鼠表现为呆滞少动、步态不稳、反应性差、腹部极度膨胀。第30天全部死亡。治疗组于第14天开始成瘤,第28天开始出现死亡,观察至40 d,小鼠全部成瘤,有6只死亡。结果显示治疗组平均生存期明显长于对照组;小鼠体重增长率、腹围增长率、腹水量和细胞计数均明显小于对照组,两组差异有统计学意义(P<0.05);治疗组肿瘤湿重明显小于对照组,抑瘤率为48.8%(表1)。
表1两组各项指标的比较
Tab.1 Comparison of measurements between the two groups

组 别例数平均生存时间(d)肿瘤湿重(g)体重增长率(%)腹围增长率(%)腹水量(mL)细胞计数(×108/mL)对照组826.38±4.311.27±0.3190.62±17.1863.26±8.3719.71±6.4018.70±4.32治疗组834.14±1.85*0.65±0.43*44.93±12.87*30.98±9.04*7.39±4.32*9.78±2.38*
与对照组相比,*P<0.05。
2.2腹水颜色及瘤细胞形态观察对照组为血性腹水,内含大量的红细胞。治疗组为乳白色腹水,内无或含有少量的红细胞(图1A、1B)。高倍镜下对照组腹水瘤细胞大小形态不一,含较多的多核瘤巨细胞。胞核体积增大明显,出现较多的病理性核分裂相。而治疗组中细胞大小形态较均一,含较少的多核瘤巨细胞。细胞核体积增大不明显,胞核/胞浆比例增大不明显,较少出现的病理性核分裂相(图1C、1D)。

图1腹水的颜色及高倍镜下腹水肿瘤细胞的形态
Fig.1 The color of ascites and morphology of ascites tumor cells
A、C:治疗组;B、D:对照组。C、D放大倍数×400。
2.3细胞凋亡检测结果Annexin V-FITC、PI双标记法流式细胞仪测细胞凋亡率,结果示治疗组的凋亡率、坏死率明显增多,与对照组比较差异有统计学意义(P<0.05)(图2、表2)。
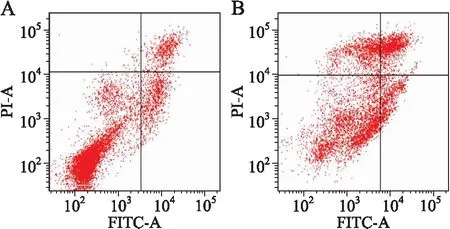
图2两组腹水细胞Annexin-V/PI双染色法凋亡图
Fig.2 Double staining apoptosis diagram of ascites cells with Annexin-V/PI
A:对照组;B:治疗组。
表2流式细胞仪测两组腹水细胞的凋亡、坏死的情况
Tab.2 Flow cytometry detection of apoptosis and necrosis in the two groups

组 别例数凋亡率(%)坏死率(%)对照组89.63±4.233.80±3.18治疗组823.88±5.60*13.84±3.57*
与对照组相比,*P<0.05。
2.4腹部大体及腹腔解剖对照组小鼠腹部膨隆,腹腔内肿瘤结节较大,壁层腹膜、肠系膜、大网膜包膜上可见广泛种植的肿瘤结节,与周围粘连,外观呈灰白色,活动度差,癌组织质脆,剖面呈实性结构移植瘤。治疗组小鼠腹腔内腹水不多,壁层腹膜、肠系膜上的瘤结节数量少、体积小,腹膜增厚不明显(图3)。
3 讨 论
在一些细胞中,由于基因扩增或其他原因引起的MDM2水平的升高,可抑制p53正常的生物学功能,导致肿瘤的发生。因此,阻断MDM2与p53相互作用,将p53从被MDM2抑制中释放出来,可抑制肿瘤的发生、发展[1-2]。根据p53与MDM2的结合部位及相互作用的特点,可通过降低肿瘤细胞中MDM2表达[9]、抑制MDM2 E3泛素酶功能[10]、或选择性抑制MDM2 N-末端与p53结合[11-12],干预p53-MDM2的相互作用,来增加p53的表达水平及活性。阻断p53-MDM2相互作用的抑制剂包括以Nutlin 3a[13]为代表的非肽小分子和多肽及其类似物。多肽中来自p53氨基端12~26位氨基酸的15肽与MDM2 N-末端结合最有效,p53(N15)Ant对于表达突变型、野生型以及缺失型p53细胞都有明显的抗增殖作用,这个多肽可以直接、快速引起肿瘤细胞坏死[3-4]。在体外实验中,已证实Ad-NT4p53(N15)Ant对HepG2细胞有强烈的杀伤效应[7-8]。为了进一步观察携带Ad-NT4p53(N15)Ant的体内抑瘤作用,我们首先建立H22细胞腹腔泛发性种植瘤的动物模型。与皮下移植相比,本文建立的腹腔移植瘤模型尤其符合腹腔脏器恶性肿瘤如卵巢癌、肝癌等腹腔播散或手术后医源性种植转移的生物学特征[14],也可模拟恶性肿瘤的泛发性转移、复发。而且该模型具有操作简单,动物成瘤率高、易于观察等优点。
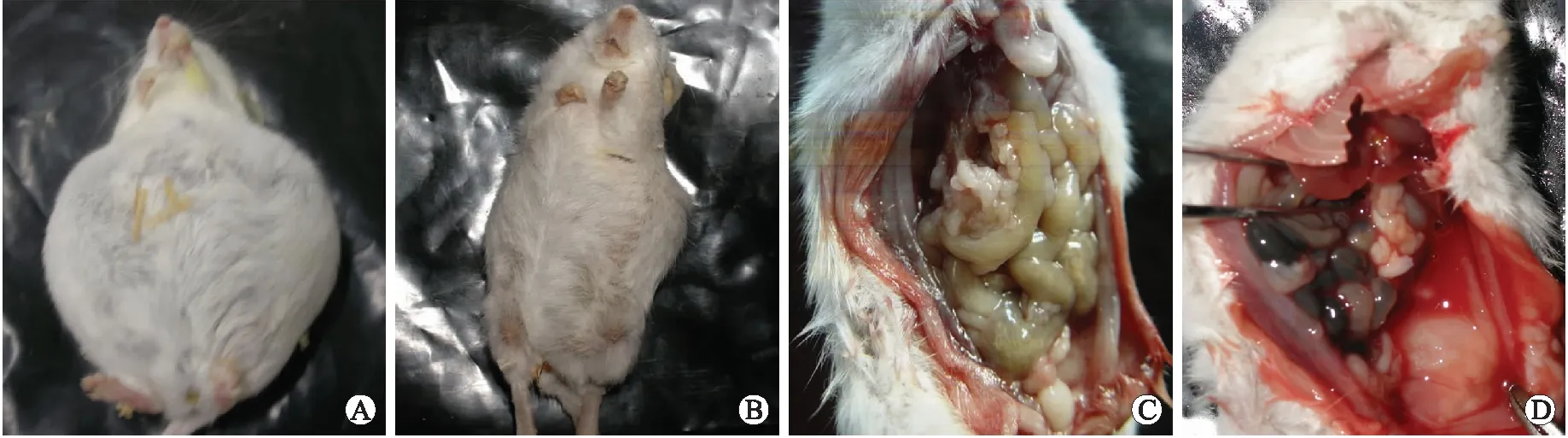
图3小鼠腹部情况及腹腔内移植瘤的成瘤情况
Fig.3 The abdominal appearance and intra-abdominal tumor xenografts
A、C:对照组;B、D:治疗组。
目前的研究大多是在瘤体长至一定体积后,直接在肿瘤体内注射治疗药物来观察抑瘤效果。有实验表明,尽管这种给药方式使肿瘤局部达到较高的药物浓度,但间断高浓度远较持续低浓度药物抑瘤效果差[15]。而且对已存在但尚不能发现的肿瘤转移病灶的疗效可能十分有限。为了预防和治疗肿瘤自发的远处转移、腹腔转移或手术造成的医源性种植转移,在肿瘤发生转移前或手术前应用抑瘤制剂,使之持续达到一定的治疗浓度,这对减少肿瘤转移、复发有重要意义。由于活性治疗肽或大分子蛋白质具有作用时间短、成本高的缺陷,携带治疗基因的病毒能持续分泌治疗蛋白,保证给药的连续性、长期性和稳定性。基于上述理论,本实验采取腹腔内感染携带治疗基因腺病毒使治疗蛋白预先在体内持续、稳定分泌表达,特异针对微小肿瘤或尚不能检测出的肿瘤发挥抑制作用,以期达到对恶性肿瘤转移或医源性移植的预防和治疗的目的。
腹水形成的速度、性质及腹水瘤细胞的数量、形态及死亡率反映了腹腔种植瘤恶性程度的高低。本实验结果显示:Ad-NT4p53(N15)Ant治疗组小鼠体重增长率、腹围增长率、腹水量和腹水瘤细胞计数均明显小于空白对照组,差异有统计学意义;治疗组腹水颜色为乳白色,而对照组则为血性腹水;腹水瘤细胞姬姆萨染色结果示:治疗组细胞与对照组相比,大小形态较均一,含较少的多核瘤巨细胞。说明 Ad-NT4p53(N15)Ant能延迟小鼠腹腔移植瘤引起的腹水(尤其是血性腹水)的形成,并抑制细胞的扩增、分裂。腹水瘤细胞流式细胞仪结果显示,治疗组的细胞凋亡以及细胞坏死数量,较对照组明显增多(P<0.05)。说明p53(N15)Ant不但可直接杀伤体内的腹水瘤细胞,而且还具有促进细胞凋亡的作用,与SONG等[16]报道的体外实验的治疗结果一致。p53((N15)Ant对瘤细胞杀伤的机制可能有两方面:①p53((N15)Ant与MDM2 N-末端结合,阻止了p53-MDM2的相互作用,从而引起p53对肿瘤细胞的间接杀伤。②p53(N15)Ant肽的二级结构在细胞膜的相互作用中起重要作用,其S状螺旋-环-螺旋结构能够在细胞膜中打入环形孔,使细胞膜通透性发生改变从而直接诱导细胞的坏死[17]。这两种机制同时存在。
大体解剖发现,治疗组腹腔内的种植瘤结节数量少、湿重明显减少,小鼠生存期明显延长。说明重组腺病毒所分泌表达的NT4p53(N15)Ant蛋白在小鼠体内具有良好的生物学功能,能够延缓腹腔泛发性移植瘤的发生,抑制肿瘤的生长和扩散。
总之,Ad-NT4p53(15)Ant有效的抑制了H22肝癌细胞腹腔移植瘤生长,延迟腹水形成,诱导体内肿瘤细胞凋亡及坏死,延长小鼠生存期。Ad-NT4p53(N15)Ant治疗肝癌腹腔移植瘤的小鼠模型实验取得了初步成效,为以后临床治疗腹腔脏器泛发性转移瘤提供了一定实验依据。随着对p53(N15)Ant作用机制以及临床实验研究的深入,Ad-NT4p53(N15)Ant有可能成为预防或治疗恶性肿瘤转移、复发治疗的新手段。
参考文献:
[1] WADE M, LI YC, WAHL GM. MDM2, MDMX and p53 in oncogenesis and cancer therapy[J]. Nat Rev Cancer, 2013, 13(2):83-96.
[2] 吴学元,马巍. 针对p53-鼠双微体基因负反馈环的肿瘤治疗[J]. 肿瘤研究与临床,2009,21(9):646-648.
[3] KANOVSKY M, RAFFO A, DREW L, et al. Peptides from the amino terminal mdm-2-binding domain of p53, designed from conformational analysis, are selectively cytotoxic to transformed cells[J]. Proc Natl Acad Sci USA, 2001, 98(22):12438-12443.
[4] DO TN, ROSAL RV, DREW L, et al. Preferential induction of necrosis in human breast cancer cells by a p53 peptide derived from the MDM2 binding site[J]. Oncogene, 2003, 22(10):1431-1444.
[5] 宋丽萍,李跃萍,邱曙东,等. NT4-p53(N15)-Ant融合基因的克隆和鉴定[J]. 西安交通大学学报:医学版,2006,27(4):333-336.
[6] 宋丽萍,李跃萍,邱曙东,等. NT4-p53(N15)-Ant融合基因重组腺病毒的构建与鉴定[J]. 中国肿瘤生物治疗杂志,2006,13(3):214-218.
[7] 李跃萍,邱曙东,宋丽萍,等. 腺病毒介导的NT4p53(N15)Ant异源融合基因对肝癌细胞的杀伤作用[J]. 南方医科大学学报,2007,27(7):936-940.
[8] 宋丽萍,李跃萍,邱曙东,等. NT4p53(N15)Ant融合基因重组腺病毒的构建及其体外抑瘤作用[J]. 癌症,2008,27(2):144-148.
[9] WANG H, MA X, REN S, et al. A small-molecule inhibitor of MDMX activates p53 and induces apoptosis[J]. Mol Cancer Ther, 2011, 10(1):69-79.
[10] ROXBURGH P, HOCK AK, DICKENS MP, et al. Small molecules that bind the Mdm2 RING stabilize and activate p53[J]. Carcinogenesis, 2012, 33(4):791-798.
[11] HU B, GILKES DM, CHEN J. Efficient p53 activation and apoptosis by simultaneous disruption of binding to MDM2 and MDMX[J]. Cancer Res, 2007, 67(18):8810-8817.
[12] PAZGIER M, LIU M, ZOU G, et al. Structural basis for high-affinity peptide inhibition of p53 interactions with MDM2 and MDMX[J]. Proc Natl Acad Sci USA, 2009, 106(12):4665-4670.
[13] VASSILEV LT, VU BT, GRAVES B, et al.Invivoactivation of the p53 pathway by small-molecule antagonists of MDM2[J]. Science, 2004, 303(5659):844-848.
[14] SCHUMACHER U, ADAM E, HORNY HP, et al. Transplantation of a human ovarian cystadenocarcinoma into severe combined immunodeficient (SCID) mice--formation of metastases without significant alteration of the tumour cell phenotype[J]. Int J Exp Pathol, 1996, 77(5):219-227.
[15] 蔡梄伯,张伟. 血管内皮细胞生长因子抑制剂对成骨肉瘤生长的影响[J]. 首都医科大学学报,2002,23(2):153-155.
[16] SONG LP, LI YP, WANG N, et al. NT4(Si)-p53(N15)-antennapedia induces cell death in a human hepatocellular carcinoma cell line[J]. World J Gastroenterol, 2009, 15(46):5813-5820.
[17] ROSAL R, BRANDT-RAUF P, PINCUS MR, et al. The role of alpha-helical structure in p53 peptides as a determinant for their mechanism of cell death: necrosis versus apoptosis[J]. Adv Drug Deliv Rev, 2005, 57(4):653-660.

