盐离子对次壶腹腺丝蛋白重组模块的影响
王佳,陈格飞,孟清
东华大学生物科学与技术研究所,上海 201620
盐离子对次壶腹腺丝蛋白重组模块的影响
王佳,陈格飞,孟清
东华大学生物科学与技术研究所,上海 201620
为研究不同生理环境对蛛丝蛋白组装及成丝的影响,首次以MiSp序列为对象,研究其NTR1SR2CT重组模块在不同种类 (浓度) 盐离子条件下的聚集和成纤维特性及其在成纤维过程中二级结构的变化。基于大腹园蛛MiSp全长序列构建NTR1SR2CT模块,并在大肠杆菌Escherichia coli BL21中成功表达。借助8 mol/L尿素裂解包涵体进行变性纯化得到NTR1SR2CT重组蛋白。NTR1SR2CT重组蛋白二级结构主要为无规则卷曲(Random coil) 或α螺旋 (Helix),在自然成丝及冻干过程中部分random coil或helix转变为β折叠 (β-sheet),甲醇能促进该转变过程。另外,钾离子和磷酸根离子有利于NTR1SR2CT重组蛋白聚集从而促进丝纤维的形成。研究结果为成丝机理研究奠定了基础,同时也为工业化生产高品质的蛛丝纤维提供了条件。
次壶腹腺丝蛋白,组装,盐离子,二级结构,丝纤维
蜘蛛丝是一种天然高分子量蛋白质纤维,具有良好的机械学性能和生物学品质,如强度高、弹性好、质地轻、耐高低温及生物相容性好等,在生物医学、材料、建筑和军事等领域具有很大的潜在应用价值[1-4]。近期蛛丝蛋白已成功应用于人造皮肤和肿瘤细胞治疗药物传送等生物医学领域,但是由于蛛丝蛋白的组装及成丝机制尚不明确等,限制了蛛丝蛋白的后续应用[5-7]。
主壶腹腺丝由主壶腹腺分泌,具有高强度和良好的延展性,主要用于逃逸和编织网框[8]。由于主壶腹腺丝的优良品质及其分泌腺体易于分离,长期以来一直是蛛丝蛋白研究的焦点[9]。2007年美国研究组克隆了第一条黑寡妇Latrodectus hesperus主壶腹腺丝蛋白 (Major ampullate spidroin, MaSp) 1和2亚基全长编码基因,证实了MaSp主要由poly-alanine、glycineglycine-X、glycine-X以及glycine-prolineglycine-X-X模块组成 (X为其他氨基酸),并可细分为N端非重复区 (N terminal,NT)、C端非重复区 (C terminal, CT) 以及重复区(Repetitive region, Rep)[10]。主壶腹腺由腺体尾(Tail)、壶状体 (Ampulla) 以及逐渐细化的导管(Duct) 组成,丝素蛋白由腺体尾分泌,存储于壶状体,受导管逐渐细化及生理化学等多种变化而纤维化,如导管逐渐细化带来的流速及剪切力变化、pH以及离子种类及浓度的变化等[9,11-12]。次壶腹腺与主壶腹腺结构和组成相似,分泌的次壶腹腺丝 (Minor ampullate silk)生物学品质和材料学性能与主壶腹腺丝相当,用于捕捉和缠绕猎物等[13-14]。本课题组近期克隆鉴定了首条大腹园蛛Araneus ventrcosus次壶腹腺丝蛋白 (Minor ampullate spidroin, MiSp)全长编码基因序列,由该基因翻译的蛋白质甘氨酸 (Glycine) 和丙氨酸 (Alanine) 含量达到64%,且主要以glycine-X、glycine-X-X、glycine-X-X-X 和 poly-alanine 等重复模块形式存在[15]。与MaSp结构不同,MiSp全长氨基酸序列除可划分为NT、CT以及Rep外,还包含两个氨基酸序列完全相同的间隔区(Spacer),在蛛丝蛋白组装成丝以及丝性能等方面分别行使不同的生物学功能[15-16]。
为研究不同生理环境对蛛丝蛋白的组装及成丝的影响,本研究以A. ventrcosus MiSp全长编码基因为基础,克隆并表达NTR1SR2CT (其含有MiSp完整的NT和CT,R1和R2分别为不同的部分重复区,S为Spacer) 重组蛋白,结合多种分析方法研究不同 (浓度) 盐离子对NTR1SR2CT重组蛋白聚集、成纤维的影响及其在成纤维过程中二级结构的变化。
1 材料与方法
1.1 材料
质粒抽提试剂盒、DNA胶回收试剂盒购自上海生工生物工程有限公司。用于Western blotting 二抗HRP-Goat anti-mouse IgG (H+L)、底物、PVDF (0.45 μm) 膜购自Invitrogen公司。EcoRⅠ和Hind Ⅲ限制性内切酶及T4 DNA连接酶购自Fermentas公司。BsaⅠ限制性内切酶和Phusion High-Fidelity PCR Master Mix购自NEB公司。6×His-tag (anti-mouse) 抗体购自Merck公司。Ni-NTA树脂购自Qiagen公司。实验中所用到的宿主菌E. coli BL21 (DE3) 购自天跟生化科技 (北京) 有限公司。
1.2 克隆构建
以A. ventrcosus MiSp全长基因为模板,引物R1SR2-RS和R1SR2-RR PCR扩增R1SR2,引物 CS和CR扩增CT,分别由BsaⅠ酶切,酶切片段回收后由T4 DNA连接酶体外连接。以连接产物为模板,引物R1SR2C-RS和R1SR2C-RR扩增R1SR2CT,引物NS和NR扩增NT,分别由BsaⅠ酶切,酶切片段回收后由T4 DNA连接酶体外连接。以连接产物为模板,引物NR1SR2C-NS和NR1SR2C-NR扩增NTR1SR2CT,产物经EcoRⅠ和Hind Ⅲ酶切后与载体连接,引物序列见表1。

表1 PCR引物列表Table 1 Primer sequence
1.3 蛋白表达、鉴定和纯化
转接BL21 (DE3) 重组子于3 mL LB培养基 (含30 µg/mL卡那霉素),37 ℃、180 r/min培养至OD600约为0.6,培养温度降至25 ℃,加入终浓度为0.8 mmol/L IPTG诱导表达6 h。诱导蛋白表达前后分别取1 mL菌液收集菌体,加入40 μL 5×SDS-PAGE上样缓冲液,制备诱导前后蛋白样。蛋白样于100 ℃水浴10 min,冰浴5 min,取适量电泳。样品经12% SDS-PAGE凝胶电泳检测,并进行Western blotting Anti-his特异性检测,具体方法参照Invitrogen操作手册。
Western blotting鉴定重组蛋白成功表达后,进行扩大培养。转接BL21(DE3)重组子于3 mL LB培养基 (含30 µg/mL卡那霉素),37 ℃、180 r/min过夜培养。按1∶100转接于250 mL 新鲜LB培养基 (含30 µg/mL卡那霉素),37 ℃、180 r/min培养至OD600约为0.6。培养温度降至25 ℃ 加入终浓度为0.8 mm/L IPTG诱导表达 6 h。高速低温离心8 min (8 000 r/min,4 ℃),收集菌体。加入10 mL裂解缓冲液 (500 mmol/L NaCl,20 mmol/L Tris-Cl,pH 8.0) 重悬菌体,200 W超声波破碎(超声5 s,间隔8 s) 70次。破碎菌液高速低温离心40 min (10 000 r/min,4 ℃),收集上清和沉淀。若NTR1SR2CT重组蛋白在上清中,则进行非变性纯化;若重组蛋白形成了包涵体,则进行变性纯化。
1.4 蛋白聚集
1.4.1 NanoDrop 2000/2000c Spectrophotometer测定蛋白上清浓度
NTR1SR2CT重组蛋白透析于20 mmol/L Tris-Cl (pH 8.0) (4 ℃,12 h),高速冷冻离心30 min (4 ℃,10 000 r/min) 除去透析中产生的沉淀。取400 μL蛋白溶液分别加入100 μL含有不同 (浓度) 盐离子的缓冲液中 (20 mmol/L Tris-Cl,pH 8.0),浓度如表2所示,重组蛋白终浓度约为2 mg/mL。重组蛋白质在不同 (浓度)盐离子缓冲液中出现不同程度的聚集,将所得蛋白样离心 (8 000 r/min,20 min),分别取4 μL上清液上样,测定其在280 nm处的吸光度(A280),即上清中蛋白浓度 (mg/mL)。
1.4.2聚集蛋白表面形态观察
不同 (浓度) 盐离子缓冲液中NTR1SR2CT重组蛋白的制样如NanoDrop 2000/2000c Spectrophotometer测定蛋白上清浓度制样。取60 μL样品于半径1 cm的铝箔片上,37 ℃ 过夜干燥,于扫描电子显微镜 (Scanning electron micrographs, SEM) 下观察蛋白质聚集物的表面形态。
1.4.3蛋白二级结构测定
将透析到20 mmol/L Tris-Cl (pH 8.0) 的NTR1SR2CT重组蛋白上清溶液倒入培养皿内,先放入−80 ℃ 冰箱冷冻至固体后再放入冷冻干燥机至液体完全升华。取5 μL冷冻干燥前的蛋白溶液测定其红外光谱 (ATR-FTIR),并在其自然蒸发干燥后再次测定。将冷冻干燥后的不规则重组蛋白纤维浸入70%甲醇中2 h,分别测定甲醇浸泡前后的红外光谱。
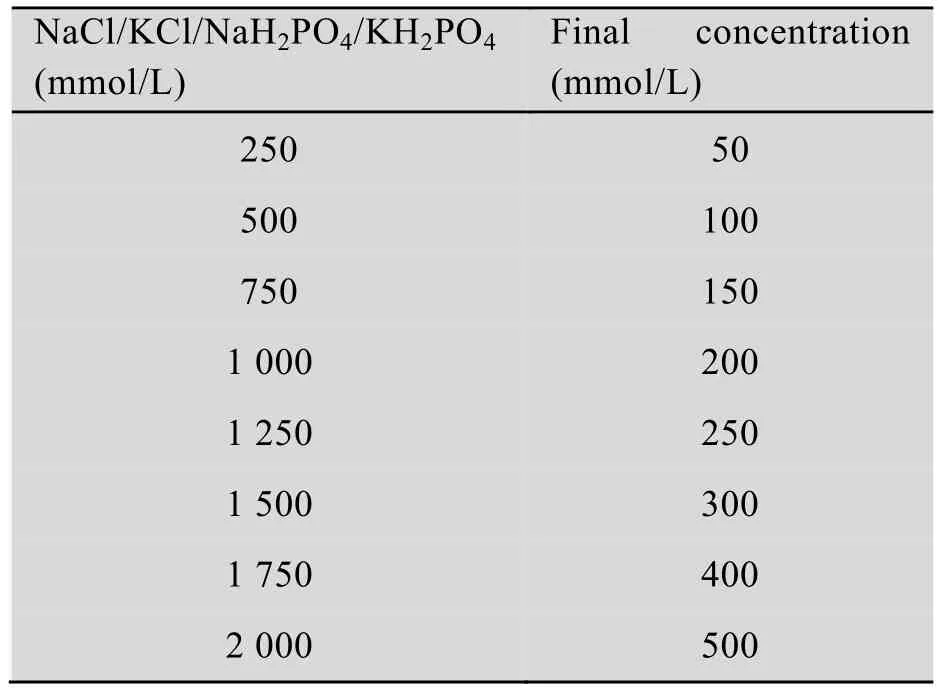
表2 不同浓度盐溶液样品的制备Table 2 Prparation of different kinds of salt solution
2 结果与分析
2.1 重组蛋白的表达、纯化和鉴定
NTR1SR2CT与经改造的pET载体pHTH连接,重组子质粒送上海生工生物工程有限公司正反向测序,测序结果经比对分析无突变,预测NTR1SR2CT重组蛋白相对分子质量为78 kDa。超声破碎诱导后的BL21 (DE3) 菌体发现,NTR1SR2CT重组蛋白可溶性较差,几乎全在沉淀组分中 (图1A)。表达产物经Western blotting鉴定为预期的重组蛋白NTR1SR2CT (图1B)。为了摸索裂解包涵体的最优尿素 (Urea)浓度,分别用含有2、4、6 mol/L 尿素的包涵体裂解缓冲液 (500 mmol/L NaCl,2、4、6 mol/L尿素,20 mmol/L Tris-Cl,pH 8.0) 裂解包涵体碎片,振荡裂解 (100 r/min,5 h)。如图2所示,上清中目的蛋白 (S4、S3、S2) 逐渐增多,沉淀中蛋白 (P4、P3、P2) 逐渐减少。当尿素浓度为8 mol/L时,沉淀组分中的重组蛋白基本全部可溶。
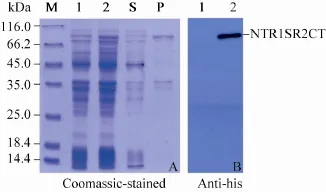
图1 NTR1SR2CT重组蛋白的 SDS-PAGE 和Western blotting 图谱Fig. 1 SDS-PAGE (A) and Western blotting (B) analysis of NTR1SR2CT recombinant proteins. M: protein marker; S and P: supernatant and pellets after centrifuge respectively; 1: non-induced cells; 2: cells induced with IPTG.
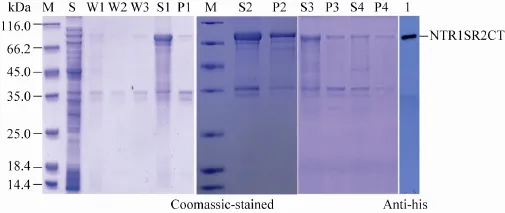
图2 不同浓度urea纯化NTR1SR2CT包涵体蛋白的SDS-PAGE图谱Fig. 2 SDS-PAGE and Western blotting analysis of urea of different concentrations for inclusion body purification of NTR1SR2CT. M: protein marker; S: supernatant; W1, W2 and W3: the first, second, third wash solution; S1, S2, S3, S4: supernatants of 8, 6, 4, 2 mol/L urea treatment respectively; P1, P2, P3, P4: pellets of 8, 6, 4, 2 mol/L urea treatment respectively.
将包涵体漂洗缓冲液 (500 mmol/L NaCl、20 mmol/L Tris-Cl (pH 8.0)、1 mol/L 尿素、1% (V/V) TritonX-100)加入超声破碎后获得的包涵体沉淀中,重悬,低温离心40 min (10 000 r/min,4 ℃),弃上清,重复3次。第3次洗涤时,漂洗缓冲液不含有1% (V/V) TritonX-100。三次漂洗后,加入适量8 mol/L尿素裂解缓冲液重悬碎片,超声破碎一次,振荡裂解 (100 r/min,5 h)。低温离心40 min (10 000 r/min,4 ℃),收集上清。如图2所示,包涵体漂洗缓冲液 (W1、W2、W3) 中不含有目的蛋白。目的蛋白在含8 mol/L尿素的裂解缓冲液中基本完全溶解 (图2中S1和P1)。将溶解的蛋白梯度透析到20 mmol/L Tris-HCL (pH 8.0) 保存备用。
2.2 重组蛋白聚集
2.2.1蛋白上清浓度
重组蛋白加入到不同 (浓度) 盐离子溶液中时出现不同程度聚集现象,当KCl、NaH2PO4、NaCl、KH2PO4终浓度分别为300、300、100、500 mmol/L时,上清中蛋白含量最少,即蛋白聚集程度最大 (图3),详细见讨论部分。高浓度的KH2PO4溶液促进蛋白的聚集,而高浓度的NaCl溶液可相对稳定蛋白。

图3 在不同浓度的4种盐溶液中可溶蛋白的浓度Fig. 3 Salt-induced aggregation of NTR1SR2CT proteins after incubation for 5 min at RT: induced by the presence of potassium chloride, potassium phosphate, sodium chloride and sodium phosphate.
2.2.2蛋白聚集产物的形态观察

图4 蛋白在4种不同浓度盐溶液下干燥成膜后的扫描电子显微镜图Fig. 4 SEM of fibrils formed from the NTR1SR2CT recombinant proteins in different concentrations of four kinds of salt. A1, A2, A3 and A4: 100, 200, 300 and 500 mmol/L potassium chloride; B1, B2, B3 and B4: 100, 200, 300 and 500 mmol/L potassium phosphate; C1, C2, C3 and C4: 100, 200, 300 and 500 mmol/L sodium chloride; D1, D2, D3 and D4: 100, 200, 300, 500 mmol/L sodium phosphate.
如图4所示,NTR1SR2CT重组蛋白在不同(浓度) 盐离子下聚集表现出不同的形态。在KCl溶液中的蛋白聚集后出现微晶,且随着浓度增大,微晶形状越趋向于方形,排列愈整齐。当浓度到300 mmol/L时,排列最为整齐 (A3)。处于KH2PO4溶液中的蛋白,当KH2PO4浓度低时 (100 mmol/L),呈现无序状(B1);浓度增大到200 mmol/L时,出现直径10 μm左右丝纤维,表面粗糙 (B2);浓度增加到300 mmol/L时,丝纤维表面变得光滑且直径比较均匀 (B3);浓度为500 mmol/L时,出现直径80 μm的超大纤维及直径2 μm左右直径均匀表面光滑的超细纤维(B4)。当盐离子为100 mmol/L NaCl时,形成不规则微晶 (C1);浓度增大后,微晶消失,形成不规则片状物 (C2、C3、C4)。NTR1SR2CT蛋白在100 mmol/L NaH2PO4溶液中可形成不规则泡沫状薄膜 (D1);当浓度为200 mmol//L时,出现纤维取向 (D2);浓度增至300 mmol/L时,纤维取向明显且光滑;浓度继续增大时(500 mmol/L),无纤维取向,形成不规则泡沫状薄膜 (D4)。
2.2.3蛋白质二级结构

图5 NTR1SR2CT蛋白衰减全反射-傅立叶变换红外光谱图Fig. 5 ATR-FTIR spectra of the NTR1SR2CT recombinant proteins. A and B: spectra of the protein solution of NTR1SR2CT recombinant proteins before and after drying; C and D: spectra of the protein film of NTR1SR2CT recombinant proteins before and after methanol treatment.
经过不同处理方式的NTR1SR2CT蛋白在1 650 cm–1(Random coil或α-helix)、1 630 cm–1(β-sheet) 附近表现出不同的吸收强度 (图5)[17]:冷冻干燥前蛋白溶液 (A) 及其自然干燥后 (B)、冷冻干燥后蛋白纤维 (C) 及其经甲醇浸泡30 min后 (D) 在1 650 cm–1处的峰值依次减弱,在1 630 cm–1处峰值依次增强。另外,在1 530 cm–1附近 (β-sheet) 只有B、C、D有吸收峰。这说明在水溶液中的蛛丝蛋白主要以random coil或α-helix 存在,在水分蒸发、冻干及甲醇处理的过程中,部分random coil或α-helix转化为β-sheet,且A、B、C、D各蛋白中β-sheet含量依次增多。
3 讨论
园网蜘蛛可分泌6种不同力学性能的丝纤维,虽然组成氨基酸各不相同,但均拥有相似的蛋白组成模式:NT、CT和Rep,其中Rep占90%以上[10,15,18-19]。NT模块在中性条件下主要为单体构象,随着pH降低,NT逐渐二聚化,最后形成稳定的二聚体;CT在蛛丝蛋白成丝过程中可扮演晶核的作用,另外也有CT促进蛛丝蛋白高度可溶的报道,但具体功能目前尚不明确[20-22];NT和CT模块在蛛丝蛋白进化过程中高度保守,参与蛛丝蛋白成丝的调节,而Rep则表现较大的生物学多样性,不同的丝纤维蛋白由不同的Rep构成,分别拥有不同的力学性能。因此,成丝机理的研究主要集中在NT和CT的功能以及Rep对丝性能的影响上。本课题组前期通过筛选基因组文库获得了A. ventrcosus MiSp全长编码基因,但是由于该基因大小为10 kb左右,很难完成全长基因的表达。且由于蛛丝蛋白主要由甘氨酸和丙氨酸组成的小模块重复组成,占到整个蛋白的70%左右。因此现有的表达系统无法完成全长蛛丝蛋白的表达,这也是现在蛛丝研究领域的难题[15]。由于蛛丝蛋白的模块性质,如重复区是由小的模块重复组成,因此我们以部分蛛丝蛋白模块为研究对象来研究成丝机理。根据A. ventrcosus全长MiSp序列,我们构建了重组子NTR1SR2CT (NTR1SR2CT含有A. ventrcosus MiSp完整的NT、CT和Spacer及部分Rep)。本文将S引入到成丝机理的研究,更能代表MiSp的成丝特性。
主壶腹腺由tail、ampulla和逐渐细化的duct组成,丝素蛋白由tail分泌,存储于ampulla,流经duct时受到物理及生理化学变化的作用发生聚集、组装及最后形成丝纤维[9,16]。丝素蛋白溶液向丝纤维转变的过程中,钠离子和钾离子浓度分别从3.1 mg/g和0.75 mg/g下降/上升为0.3 mg/g和2.9 mg/g,同时磷酸盐浓度升高至少5倍[23]。Nephila edulis蜘蛛主壶腹腺内腔内的MaSp纺丝原液含有150 mmol/L的氯化钠,在成丝过程中浓度降低,另外纺丝原液流经导管时,钠离子与钾离子交换,氯离子与磷酸根离子交换,从而导致钠离子与氯离子的降低及钾离子与磷酸根离子的升高[24]。对NT的研究发现,NaCl可稳定NT单体构象,延迟二聚化转变[25]。为研究盐离子种类及浓度对丝蛋白聚集及成丝的影响,重组蛋白NTR1SR2CT经多种方法进行测试,研究其受盐离子种类及浓度的影响。
陆游在夔州时曾作《风雨中望峡口诸山奇甚戏作短歌》,一度认为“白盐赤甲天下雄,拔地突兀摩苍穹”这样的景致过于雄健而直露,所谓“凛然猛士舞长剑,空有豪健无雍容”,并因此而发出“不令气象少渟滀,常恨天地无全功”的感叹,但在一个风雨大作的日子,他却忽然发现了云遮雨罩中白盐赤甲景象的奇妙:“今朝忽悟始叹息,妙处元在烟雨中”。平时不太美的景致,之所以会在通常令人悲伤的风雨中而变得完美可人,除了上天的帮助外,主要应该是陆游创作时的精神状态在起作用,是他的情绪由身在蛮乡的一贯低沉消极而偶然变得平和愉悦了。
NTR1SR2CT重组蛋白理论相对分子质量为78 kDa,经BL21 (DE3) 表达后主要分布在沉淀组分中。分析NT的氨基酸组成发现,NT中含有两个保守的半胱氨酸 (Cystein),可形成链内二硫键[15]。BL21 (DE3) 内环境不适合二硫键的形成,因此表达的重组蛋白形成包涵体,可溶性较差,需采用8 mol/L 尿素裂解缓冲液进行包涵体纯化 (图2)。NTR1SR2CT重组蛋白加入到不同浓度的NaCl、KCl、NaH2PO4和KH2PO4溶液中后出现不同程度的聚集现象,其中当KCl、NaH2PO4、NaCl、KH2PO4终浓度分别为300、300、100、500 mmol/L时,蛋白聚集程度最高 (图3)。重组蛋白在KH2PO4和NaH2PO4中的聚集动力学相似,均随着浓度的增加而不断聚集。对比KCl和KH2PO4以及NaCl和NaH2PO4,磷酸根离子更易促进重组蛋白的聚集。在KCl浓度为300 mmol/L时,该蛋白出现最大程度的聚集。到目前为止,蜘蛛主壶腹腺导管末端钾离子浓度还无法确定,我们推测可能会存在一个最优的钾离子浓度,在该浓度下,蛛丝蛋白更易聚集成丝。NaCl能稳定NT单体构象,增大蛛丝蛋白的溶解性,不利于蛛丝蛋白的聚集,这里我们发现随着钠离子浓度的升高,蛋白聚集程度减弱。
在不同种类及浓度的盐离子环境中,NTR1SR2CT重组蛋白聚集物分别拥有不同的表面形态。在300 mmol/L的KCl中,重组蛋白聚集粒径最大,排列最为整齐。在KH2PO4溶液中,随着浓度增大到500 mmol/L左右时,出现直径80 μm的超大纤维及均匀直径2 μm左右表面光滑的超细纤维。而在NaCl溶液中,只有在低浓度100 mm/L时,出现不规则微晶,随着浓度增大,呈现无序状。在NaH2PO4溶液中,当浓度增大至300 mm/L,薄膜表面出现有取向的纤维。4种盐离子溶液,只有在KH2PO4溶液中形成丝纤维,且浓度越高,所形成的纤维表面越光滑。因此,钾离子、磷酸根离子促进蛋白的聚集即自组装,从而促进丝纤维的形成;而钠离子、氯离子则不利于纤维的形成。
存储于蛛丝腺体中的丝素蛋白溶液二级结构主要为random coil和helix,但是丝纤维的结构研究发现,蛛丝纤维的主要二级结构组分为β-sheet[7]。因此丝素蛋白溶液在经过导管的过程以及蜘蛛纺丝的过程中,丝素蛋白会发生结构的转变。这里我们分别利用不同的处理方式处理NTR1SR2CT重组蛋白并分析ATR-FTIR光谱,MiSp蛋白原液二级结构主要是random coil和helix,当水分蒸发后,random coil或helix立即有一部分转化为β-sheet。因此,蛋白溶液在遇空气凝结成纤维的过程,是一个转变为β-sheet的过程。在研究丝素蛋白时,常常采用冻干的方法,然而研究发现冻干后,二级结构发生改变,random coil或helix大部分转变为β-sheet结构,因此在研究其相关结构时,过程中采用冻干的方法不够严谨,同时这也解释了为什么冻干后的蛋白是不易溶于水的。冻干后的蛋白纤维经过甲醇处理后,β-sheet变多,说明甲醇能够促进蛋白形成β-sheet,从而增强蛛丝的强度。
本次研究通过对NTR1SR2CT重组蛋白的表达、纯化、聚集倾向和二级结构的分析,证实了钾离子、磷酸根离子可促进丝素蛋白的组装,从而促进丝纤维的形成;而钠离子、氯离子则可抑制丝素蛋白纤维化。另外,我们证实NTR1SR2CT重组蛋白在水溶液中二级结构主要是random coil或helix,自然干燥和冷冻干燥可促使random coil或helix转变成β-sheet,甲醇可促进该转变的发生。本研究为蛛丝蛋白成丝机理提供了次壶腹腺丝的研究线索,为仿生高品质的蛛丝纤维提供了条件。
REFERENCES
[1] Hinman MB, Jones JA, Lewis RV. Synthetic spider silk: a modular fiber. Trends Biotechnol, 2000, 18(9): 374–379.
[2] Linke WA. Biomaterials: spider strength and stretchability. Nat Chem Biol, 2010, 6(10): 702–703.
[3] Widhe M, Johansson J, Hedhammar M, et al. Invited review current progress and limitations of spider silk for biomedical applications. Biopolymers, 2012, 97(6): 468–478.
[5] Wendt H, Hillmer A, Reimers K, et al. Artificial skin-culturing of different skin cell lines for generating an artificial skin substitute on cross-weaved spider silk fibres. PLoS ONE, 2011, 6(7): e21833.
[6] Numata K, Reagan MR, Goldstein RH, et al. Spider silk-based gene carriers for tumor cell-specific delivery. Bioconjug Chem, 2011, 22(8): 1605–1610.
[7] Rising A. Controlled assembly- a prerequisite for the use of recombinant spider silk in regenerative medicine? Acta Biomater, 2013.
[8] Heim M, Keerl D, Scheibel T. Spider silk: from soluble protein to extraordinary fiber. Angew Chem Int Ed Engl, 2009, 48(20): 3584–3596.
[9] Andersson M, Holm L, Ridderstrale Y, et al. Morphology and composition of the spider major ampullate gland and dragline silk. Biomacromolecules, 2013, 14(8): 2945–2952.
[10] Ayoub NA, Garb JE, Tinghitella RM, et al. Blueprint for a high-performance biomaterial: full-length spider dragline silk genes. PLoS ONE, 2007, 2(6): e514.
[11] Davies GJ, Knight DP, Vollrath F. Structure and function of the major ampullate spinning duct of the golden orb weaver, Nephila edulis. Tissue Cell, 2013, 45(5): 306–311.
[12] Knight DP, Knight MM, Vollrath F. Beta transition and stress-induced phase separation in thespinning of spider dragline silk. Int J Biol Macromol, 2000, 27(3): 205–210.
[13] Guinea GV, Elices M, Plaza GR, et al. Minor ampullate silks from Nephila and Argiope spiders: tensile properties and microstructural characterization. Biomacromolecules, 2012, 13(7): 2087–2098.
[14] Lewis RV. Spider silk: ancient ideas for new biomaterials. Chem Rev, 2006, 106(9): 3762–3774.
[15] Chen G, Liu X, Zhang Y, et al. Full-length minor ampullate spidroin gene sequence. PLoS ONE, 2012, 7(12): e52293.
[16] Eisoldt L, Thamm C, Scheibel T. Review the role of terminal domains during storage and assembly of spider silk proteins. Biopolymers, 2012, 97(6): 355–361.
[17] Hu X, Kaplan D, Cebe P. Determining beta-sheet crystallinity in fibrous proteins by thermal analysis and infrared spectroscopy. Macromolecules, 2006, 39(18): 6161–6170.
[18] Hayashi CY, Lewis RV. Molecular architecture and evolution of a modular spider silk protein gene. Science, 2000, 287(5457): 1477–1479.
[19] Ayoub NA, Garb JE, Kuelbs A, et al. Ancient properties of spider silks revealed by the complete gene sequence of the prey-wrapping silk protein (AcSp1). Mol Biol Evol, 2013, 30(3): 589–601.
[20] Askarieh G, Hedhammar M, Nordling K, et al. Self-assembly of spider silk proteins is controlled by a pH-sensitive relay. Nature, 2010, 465(7295): 236–238.
[21] Gaines WA, Sehorn MG, Marcotte WR Jr. Spidroin N-terminal domain promotes a pH-dependent association of silk proteins during self-assembly. J Biol Chem, 2010, 285(52): 40745–40753.
[22] Hagn F, Eisoldt L, Hardy JG, et al. A conserved spider silk domain acts as a molecular switch that controls fibre assembly. Nature, 2010, 465(7295): 239–242.
[23] Chen X, Huang YF, Shao ZZ. Function of potassium in spinning process of spider Nephila. Chem J Chin Univ, 2004, 25(6): 1160–1163.
[24] Knight DP, Vollrath F. Changes in element composition along the spinning duct in a Nephila spider. Naturwissenschaften, 2001, 88(4): 179–182.
[25] Hagn F, Thamm C, Scheibel T, et al. pH-dependent dimerization and salt-dependent stabilization of the N-terminal domain of spider dragline silk--implications for fiber formation. Angew Chem Int Ed Engl, 2011, 50(1): 310–313.
(本文责编 陈宏宇)
Effect of salt on minor ampullate silk spidroin modules
Jia Wang, Gefei Chen, and Qing Meng
Institute of Biological Sciences and Biotechnology, Donghua University, Shanghai 201620, China
To study the effect of physiological conditions on spidroins, we analyzed NTR1SR2CT module secondary structure, aggregation and silk-formation influenced by different salts (in different concentration intervals). According to the full-length Araneus ventricosus MiSp sequence, NTR1SR2CT module was constructed and expressed in Escherichia coli BL21 (DE3), and the recombinant proteins were purified by denaturation method mediated by 8 mol/L urea. Random coil and helix are the main secondary structures of NTR1SR2CT and could be induced into beta-sheet by drying natively and lyophilization, where methanol can be used as a promoter. Furthermore, potassium and phosphate cations can cause significant NTR1SR2CT protein aggregationand silk-formation. The results could be a basis for the determination of silk-formation mechanism, and also useful for industrialized generation of high performance spider silk-like fibers.
minor ampullate spidroin, assembly, salt, secondary structure, fibers
November 18, 2013; Accepted: January 7, 2014
Qing Meng. Tel: +86-21-67792737; E-mail: mengqing@dhu.edu.cn
王佳, 陈格飞, 孟清. 盐离子对次壶腹腺丝蛋白重组模块的影响. 生物工程学报, 2014, 30(8): 1308−1317.
Wang J, Chen GF, Meng Q. Effect of salt on minor ampullate silk spidroin modules. Chin J Biotech, 2014, 30(8): 1308−1317.
Supported by: National Natural Science Foundation of China (No. 31070698), National High Technology Research and Development Program of China (863 Program) (No. 2006AA03Z451), Science and Technology Commission of Shanghai Key Project of Basic Research (No. 10JC1400300), Doctoral Science Fund Project of the Ministry of Education of China (No. 20120075110007).
国家自然科学基金 (No. 31070698),国家高技术研究发展计划 (863 计划) (No. 2006AA03Z451),上海市科委基础研究重点项目(No. 10JC1400300),教育部博士点基金项目 (No. 20120075110007) 资助。

