131I对甲状腺HTori 3细胞凋亡及周期的影响
张伟晓,高 蕊,于 燕,郭 坤,刘 岩,喻铭启,杨爱民
(西安交通大学医学院:1.第一附属医院核医学科;2.公共卫生系,陕西西安 710061)
131I对甲状腺HTori 3细胞凋亡及周期的影响
张伟晓1,高 蕊1,于 燕2,郭 坤1,刘 岩1,喻铭启1,杨爱民1
(西安交通大学医学院:1.第一附属医院核医学科;2.公共卫生系,陕西西安 710061)
目的研究131I诱导人甲状腺HTori 3细胞凋亡、周期阻滞及其与Bcl-2、Fas等基因表达的关系。方法HTori 3细胞经131I照射后,MTT方法检测细胞存活率;流式细胞仪检测细胞凋亡及周期分布;QRT-PCR及Western blot检测细胞凋亡相关基因Bcl-2、Fas的mRNA及蛋白表达水平的变化。结果MTT结果显示不同放射性活度(7.4、14.8、29.6 MBq/mL)的131I作用于HTori 3细胞不同时间(24、48、72、96 h)后,对HTori 3细胞增殖有明显的抑制作用(P<0.05)。14.8 MBq/m L131I作用于细胞24、48、72 h后,出现明显的细胞凋亡(P<0.05)。14.8 MBq/m L131I作用细胞12、24、48 h后,G2/M期细胞所占百分比增加(P<0.01)。实时定量PCR及Western blot结果均显示抗凋亡基因Bcl-2表达降低(P<0.05),促凋亡基因Fas表达增加(P<0.05)。结论131I能够通过诱导HTori 3细胞凋亡及G2/M期阻滞抑制细胞增殖,Bcl-2及Fas均参与了131I诱导HTori 3细胞凋亡的过程。
131I;HTori 3细胞;凋亡;G2/M阻滞;Bcl-2;Fas
辐射射线可导致严重的DNA损伤。细胞通过细胞修复、周期阻滞或凋亡等非常精密的调控机制对此作出反应,其中细胞凋亡是电离辐射所致细胞死亡的主要形式[1]。细胞周期阻滞可以为修复DNA损伤赢得足够的时间,研究较多的细胞周期检测点主要是G1/S期和G2/M期检测点[2]。若DNA损伤程度严重以致无法成功修复时,机体则启动凋亡通路诱导细胞凋亡[3]。目前,关于电离辐射诱导细胞凋亡及周期阻滞的研究主要集中于X射线和γ射线,而放射性核素β-射线的研究报道较少。131I半衰期为8.1 d,平均射程为910μm,是典型的释放β-射线的放射性核素,相对较长的半衰期为核素发挥辐射治疗作用提供了足够的时间。131I以其组织特异性广泛用于甲亢及分化型甲状腺癌术后清甲治疗[4-5],还可标记于特异性抗体用于非霍奇金淋巴瘤等其他肿瘤的治疗[6]。本研究的目的旨在研究131I发射的β-射线诱导甲状腺HTori 3细胞凋亡和细胞周期阻滞的作用,并初步探讨其生物学机制。
1 材料与方法
1.1 实验材料、仪器及主要试剂人甲状腺HTori 3细胞由西安交通大学医学院第一附属医院内分泌实验室侯鹏教授馈赠。放射性核素131I由广州希埃核医药中心提供。细胞凋亡试剂盒Annexin-VFLUOS为德国Roche公司产品。PCR引物由上海生工生物工程公司设计合成。Bcl-2及Fas抗体为美国Epitomics公司产品,内参基因GAPDH抗体为美国Abmart公司产品。ELX800型酶标仪为美国Biotek公司产品。FACS Calibur型流式细胞仪为美国BD公司产品。CFX96实时定量PCR仪为美国Bio-Rad公司产品。
1.2 MTT法检测131I对HTori 3细胞的生长抑制作用将HTori 3细胞制成单细胞悬液,以1.5×104/mL浓度接种于96孔板,每组设6个复孔。细胞培养24 h后,加入不同放射性活度的131I(7.4、14.8、29.6 MBq/m L),作用不同时间(24、48、72、96 h)。每孔加入20μL MTT,继续培养4 h。每孔加入150μL DMSO,在摇床上低速震荡10 min待结晶充分溶解后,在酶标仪570 nm处测量各孔的吸光值A570。同时设调零孔及对照孔。按下列公式计算细胞存活率:细胞存活率=(实验组A-空白对照A)/(对照组A -空白对照A)×100%
1.3 流式细胞仪检测细胞凋亡率细胞以合适的浓度(5×104~1×105/m L)接种于六孔板,培养24 h后加入14.8 MBq/m L131I,对照组加入相同体积的PBS。经131I处理不同时间(24、48、72 h)后,将培养基及细胞悬液回收至15 m L离心管,3 m L PBS清洗两遍,离心(1 000 r/min,5 min),加入100μL Annexin-V-FLUOS缓冲液后上机检测。
1.4 流式细胞仪检测细胞周期的再分布细胞以1 ×105/m L浓度接种于六孔板中,培养24 h后加入14.8 MBq/m L131I,对照组加入相同体积的PBS。经131I处理不同时间(12、24、48 h)后,弃掉培养基,将细胞悬液回收至15 m L离心管中,细胞经PBS清洗后加入3 m L 700 m L/L乙醇,在4℃冰箱中过夜保存。离心(1 000 r/min,5 min)后弃掉乙醇,继续用PBS清洗细胞,加入PI后上机检测。
1.5 实时定量PCR检测Bcl-2及Fas mRNA表达水平的变化用RNAiso Reagent提取细胞RNA,分光光度计测量RNA浓度并计算260/280比值。内参基因为人β-actin基因,上游引物序列为:5'-CTGGGACGACATGGAGAAAA-3';下游引物序列为:5'-AAGGAAGGCTGGAAGAGTGC-3';Bcl-2上游引物序列为:5'-ATGTGTGTGGAGAGGTCAACC-3',下游引物序列为:5'-AGAGACAGCCAGGAGAAATCAAAC-3';Fas上游引物序列为:5'-TGGCTTTGTCTTCTTCTTTTGC-3';下游引物序列为:5'-CTTGGTTTTCCTTTCTGTGCTT-3'。加入500 ng RNA、2μL 5×PrimeScript Buffer、0.5μL Oligo d T Primer、0.5μL Random 6mers及RNase free H2O配制成10μL反应体系,反转程序为37℃15 min,85℃5 s。实时定量PCR反应体系如下:10μL SYBR Premix Ex TaqTM,0.8μL PCR上游引物,0.8μL PCR下游引物,2μL模板(cDNA溶液),6.4μL d H2O。采用两步法PCR反应程序。
1.6 Western blot检测Bcl-2及Fas蛋白表达水平的变化收集阴性对照组、实验组细胞,用PBS清洗,加入细胞裂解液裂解细胞,提取总蛋白,测定蛋白含量。灌制100 g/L的分离胶,50 g/L的浓缩胶的SDSPAGE凝胶。每个样品槽内加入150μg总蛋白进行SDS-PAGE电泳,通过电转印法将蛋白从聚丙烯酰胺凝胶上转移PVDF膜上,PVDF膜用50 g/L牛血清白蛋白封闭液4℃封闭1 h后加入一抗(1∶1 000),4℃孵育过夜,TBST洗膜后加入二抗(羊抗兔或羊抗鼠) 37℃孵育2 h,TBST洗膜,增强化学发光(enhanced chemiluminescence,ECL)显影,扫描。用Quantity One图像分析系统扫描图像的吸光度,以各组目的蛋白条带吸光度值与内参蛋白GAPDH吸光度值计算相对比值。
1.7 统计学分析所有数据以均数±标准差()表示,采用SPSS 16.0软件对实验数据进行统计分析。实验组细胞存活率与对照组间比较采用两独立样本t检验,多组间细胞凋亡率、G2/M期百分比及相关基因mRNA和蛋白表达水平的比较采用单因素方差分析(One-way ANOVA),两两比较采用SN K-q(Student-Newman-Keuls)检验,P<0.05为差异有统计学意义。
2 结 果
2.1131I对HTori 3细胞的生长抑制作用7.4、14.8、29.6 MBq/m L131I分别作用于HTori 3细胞24、48、72、96 h后,对细胞有明显的增殖抑制作用(图1),而且随131I活度增加及作用时间延长,细胞存活率逐渐降低,具有时间及剂量依赖性。其中131I作用HTori 3细胞48 h的半数生长抑制活度为(27.75 ±2.22)MBq/m L。
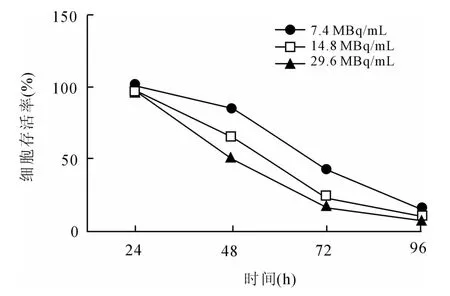
图1 不同放射性活度131I作用于HTori 3不同时间后对细胞生长的影响Fig.1 Effects of different radioactivity of131I on the growth of HTori 3 cell for different time points
2.2131I诱导HTori 3细胞凋亡14.8 MBq/m L131I作用细胞24、48、72 h后,细胞凋亡率分别为(8.6 ±1.06)%、(39.9±1.88)%及(50.6±1.01)%,与对照组(6.5±0.6)%比较,差异有统计学意义(P<0.01)。各组两两比较发现,72 h细胞凋亡率显著高于24 h及48 h(P<0.01),48 h细胞凋亡率显著高于24 h(P<0.01)。
2.3131I诱导HTori 3细胞G2/M期阻滞由表1可以看出,14.8 MBq/m L131I作用细胞12、24、48 h后,G2/M期细胞所占百分比逐渐增加,与对照组比较,差异有统计学意义(P<0.01)。组间比较结果显示24 h G2/M期细胞所占百分比高于12 h(P<0.01),而48 h G2/M期细胞所占百分比高于12 h及24 h(P<0.01)。
2.4 Bcl-2和Fas mRNA表达水平的变化实时定量PCR显示抗凋亡基因Bcl-2 mRNA水平降低,促凋亡基因Fas mRNA水平升高(图2)。经14.8 MBq/m L131I作用细胞12、24、48 h后Bcl-2 mRNA相对表达量降低,与对照组比较,差异有统计学意义(P<0.01),各实验组间比较,差异无统计学意义。经14.8 MBq/m L131I作用细胞12、24、48 h后Fas m RNA相对表达量增加,与对照组比较,差异有统计学意义(P<0.01),各实验组间比较,24 h和48 h Fas m RNA表达量均高于12 h,差异有统计学意义(P<0.01),24 h和48 h Fas m RNA表达量比较,差异无明显统计学意义。
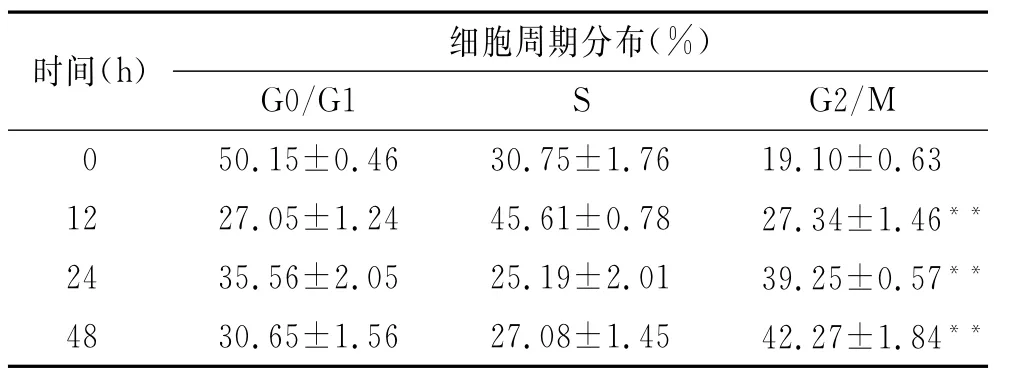
表1 14.8 MBq/mL131I作用于HTori 3不同时间后对细胞周期的影响Tab.1 Effects of 14.8 MBq/m L131I on cell cycle of HTori 3 cell for different time points

图2 14.8 MBq/m L131I作用于HTori 3细胞不同时间后Bcl-2和Fas mRNA表达水平的变化Fig.2 Bcl-2 and Fas mRNA expressions in HTori 3 cell after 14.8 MBq/m L131I treatment for different time points
2.5 Bcl-2和Fas蛋白表达水平的变化Western blot结果显示抗凋亡基因Bcl-2蛋白表达水平降低,促凋亡基因Fas蛋白表达水平升高(图3)。对照组和经14.8 MBq/m L131I作用不同时间(12、24、48 h)后细胞Bcl-2蛋白的相对吸光度值分别为0.77±0. 24、0.84±1.06、0.33±0.47和0.16±0.73,多组间比较,差异有统计学意义(P<0.01),两组间比较发现,24 h和48 h Bcl-2蛋白表达量均低于12 h,差异具有统计学意义(P<0.01),而12 h Bcl-2蛋白表达量与对照组比较无明显差异。对照组和经14.8 MBq/m L131I作用不同时间(12、24、48 h)后细胞Fas蛋白的相对吸光度值分别为0.40±0.71、0.26± 0.35、0.82±1.07和0.82±0.47,多组间比较,差异有显著性(P<0.01),两组间比较发现,24 h和48 h Fas蛋白表达量均高于12 h,差异具有统计学意义(P<0.01),而12 h Fas蛋白表达量与对照组相比无明显差异。说明经131I处理24 h后,凋亡相关基因表达发生变化,抗凋亡基因Bcl-2蛋白表达水平降低,促凋亡基因Fas蛋白表达水平升高,这与细胞凋亡的发生时间是一致的。
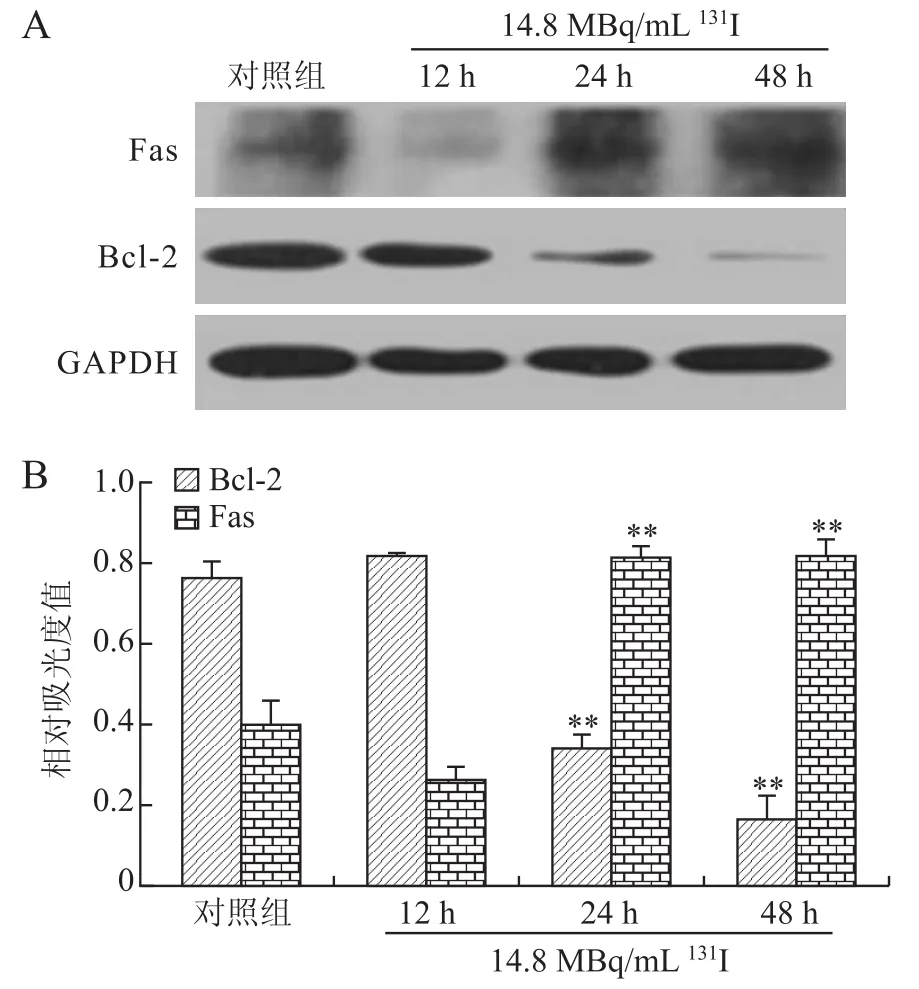
图3 14.8 MBq/mL131I处理HTori 3不同时间后Fas和Bcl-2蛋白表达水平的变化Fig.3 Fas and Bcl-2 protein expressions of HTori 3 cell after 14.8 MBq/m L131I treatment for different time points
3 讨 论
目前,关于电离辐射诱导细胞凋亡及细胞周期阻滞的研究主要集中于X射线和γ射线,而关于放射性核素β-射线的研究报道较少。与外照射不同,放射性核素内照射具有辐射作用时间的持续性和作用效应的累积性等特点。因此,研究放射性核素β-射线诱导细胞凋亡及细胞周期阻滞的作用及其细胞、分子生物学机制具有重要意义。
电离辐射是放射核素治疗的基础,是射线引起物理、化学和生物学效应的机制之一。电离辐射致DNA损伤的严重程度与射线类型及放射剂量等因素有关。传能线性密度越高,带电粒子的电离作用越强,致DNA损伤越严重。本结果显示131I对甲状腺细胞HTori 3细胞增殖有明显的抑制作用,而且随着131I放射剂量的增加及作用时间的延长,细胞增殖抑制率增加。说明131I抑制细胞增殖与其放射剂量及照射时间等因素有关,这就为临床上以合适的放射剂量、适当的时间及作用方式治疗疾病提供了理论依据。
放疗及化疗致DNA损伤均可导致细胞凋亡及细胞周期阻滞[7-8],这对于维持基因组的稳定性具有重要意义。研究表明γ射线能够诱导细胞G2/M期阻滞[8],89Sr Cl2发射的β-射线亦能够诱导人乳腺癌细胞G2/M期阻滞[9]。本研究结果表明131I对HTori 3细胞有明显的G2/M期阻滞作用,而且与131I的作用时间呈正相关。细胞凋亡途径分为线粒体途径及死亡受体途径。线粒体途径主要是由Bcl-2家族基因调节。Bcl-2家族分为抗凋亡基因如Bcl-2和促凋亡基因如Bax,Bcl-2/Bax比值决定细胞是否发生凋亡[10-11]。Fas是死亡受体途径中的重要分子,Fas受体与配体结合后可通过启动死亡受体途径诱导细胞凋亡[12]。本结果显示,经131I处理后,细胞凋亡率较对照组明显增加。本研究发现131I作用甲状腺HTori 3细胞24 h后,RT-PCR及Western blot结果均显示Bcl-2基因表达降低,Fas基因表达升高,与细胞凋亡发生的时间是一致的。说明Bcl-2及Fas均参与了131I诱导HTori 3细胞凋亡的过程,而且是通过线粒体途径及死亡受体途径共同实现的。这一结果与报道基本一致。张军宁等[13]在89Sr诱发K562癌细胞凋亡放射毒理效应的分子机制的研究中发现89Sr发射的β-射线照射K562细胞后,细胞凋亡与细胞坏死与对照组相比均有所增加,且89Sr诱导K562细胞的凋亡可能是通过Bcl-2 mRNA及其蛋白表达降低,Bcl-2/Bax比值下降而调控的。邹保民等[14]报道的188Reβ-射线也能诱导前列腺癌PC-3细胞凋亡,Bcl-2及Bax基因均参与了188Re诱导的细胞凋亡过程。
总之,131I能够诱导HTori 3细胞凋亡及G2/M期阻滞。Bcl-2及Fas均参与了131I诱导HTori 3细胞凋亡的过程。以上研究为临床应用放射性核素131I治疗疾病提供了理论依据。
[1]HOUTGRAAF JH,VERSMISSEN J,VAN DER GIESSEN WJ. A concise review of DNA damage checkpoints and repair in mammalian cells[J].Cardio Revasc Med,2006,7(3):165-172.
[2]KASTAN MB,BARTEK J.Cell-cycle checkpoints and cancer[J].Nature,2004,432(7015):316-323.
[3]ERIKSSON D,STIQBRAND T.Radiation-induced cell death mechanisms[J].Tumor Biol,2010,31(4):363-372.
[4]于鹏,宫凤玲,梁永坪,等.分化型甲状腺癌清甲治疗后131I全身显像与甲状腺球蛋白检测结果的相关性分析[J].吉林大学学报:医学版,2011,37(4):691-694.
[5]田竹芳,施秉银,赵新,等.Graves病患者甲亢性肝损害及其相关因素分析[J].西安交通大学学报:医学版,2010,31(2):205-207.
[6]ERIKSSON D,BLOMBERG J,LINDGREN T,et al.Iodine-131 induces mitotic catastrophes and activates apoptotic pathways in Hela Hep2 cells[J].Cancer Biother Radio,2008,23 (5):541-550.
[7]LAVRIK I,GOLKS A,KRAMMER PH.Death receptor signaling[J].J Cell Sci,2005,118(2):265-267.
[8]张岚,高冬玲,温洪涛,等.Bcl-XL反义寡核苷酸对食管癌EC9706细胞和裸鼠移植瘤组织的诱凋亡作用[J].郑州大学学报:医学版,2014(2):146-149.
[9]WANG C,WANG J,JIANG H,et al.In vitro study on apoptosis induced by strontium-89 in human breast carcinoma cell line[J].J Biomed Biotechnol,2011,2011:1-7.
[10]ELMORE S.Apoptosis:a review of programmed cell death[J].Toxicol Pathol,2007,35(4):495-516.
[11]OLA MS,NAWAZ M,AHSAN H.Role of Bcl-2 family proteins and caspases in the regulation of apoptosis[J].Mol Cell Biochem,2011,351(1-2):41-58.
[12]RHO JK,CHOI YJ,RYOO BY,et al.p53 enhances gefitinibinduced growth inhibition and apoptosis by regulation of Fas in non-small cell lung cancer[J].Cancer Res,2007,67(3):1163-1169.
[13]张军宁,洪承皎,朱寿彭.89Sr诱发K562癌细胞凋亡及其相关基因表达研究[J].中华放射医学与防护杂志,2002,22(6):416-418.
[14]邹保民,段小艺,胡国瑛.188Re诱导前列腺癌PC-3细胞凋亡的实验研究[J].西安交通大学学报:医学版,2002,23(4):366-368.
(编辑 韩维栋)
Effects of radioiodine-131 on apoptosis and cell cycle of human thyrocyte cell line HTori 3
ZHANG Wei-xiao1,GAO Rui1,YU Yan2,GUO Kun1,LIU Yan1,YU Ming-qi1,YANG Ai-min1
(1.Department of Nuclear Medicine,the First Affiliated Hospital,Medical School of Xi'an Jiaotong University;2.Department of Public Health,Medical School of Xi'an Jiaotong University,Xi'an 710061,China)
ObjectiveTo investigate the effects of radioiodine-131 on cell apoptosis and cell cycle of HTori 3 cell line and the related mechanisms.MethodsThe cell viability of HTori 3 cell line was quantitated by methylthiazolyl-tetrazolium assay(MTT);cell apoptosis and cell cycle arrest were determined by flow cytometry. Quantitative real-time PCR and Western blot assay were performed to determine the changes of Bcl-2 and Fas expressions after radioiodine-131 irradiation.ResultsIodine-131 of different radioactivity(7.4,14.8 and 29.6 MBq/m L)could significantly inhibit HTori 3 cell growth for different time points(24,48,72 and 96 h)(P<0.05).Iodine-131 of 14.8 MBq/m L could induce cell apoptosis after different time(24,48 and 72 h)(P<0.05). The percentage of G2/M cells was increased compared with that of the controls after 14.8 MBq/m L iodine-131 treatment for different time(24,48 and 72 h)(P<0.01).Up-regulation of Fas and down-regulation of Bcl-2 were observed after radioactive iodine-131 treatment(P<0.05).ConclusionIodine-131 can inhibit HTori 3 cell growth via cell apoptosis and G2/M arrest.Down-regulating of Bcl-2 and up-regulating Fas are involved in the apoptosis induced by iodine-131.
iodine-131;HTori 3;apoptosis;G2/M arrest;Bcl-2;Fas
R817.8
A
1671-8259(2014)05-0630-04
10.7652/jdyxb201405012
2014-03-10
2014-05-05
国家自然科学基金资助项目(No.81172598) Supported by the National Natural Science Foundation of China(No.81172598)
杨爱民,主任医师.E-mail:yangaimin@mail.xjtu.edu.cn
张伟晓(1987-),女(汉族),在读硕士研究生.研究方向:131I核素治疗.E-mail:elinasmile@126.com
时间:2014-07-22 18∶12 网络出版地址:http://www.cnki.net/kcms/detail/61.1399.R.20140722.1812.017.html

