新疆棉籽壳纤维素制备的初步研究
田维亮 葛振红 李继兴 薛东虎 赵超 沈俊杰 马志苍
中国是世界第一产棉大国[1],新疆是我国棉花生产基地。棉花加工过程中会产生大量副产品棉籽壳,由于棉籽壳密度小,不易运输、贮存,而且外壳坚硬,纤维含量少、纤维短,不适合作造纸原料,部分以焚烧的形式被处理掉还田。在美国,棉籽壳被用于奶牛[2]、犊牛、种公牛及肉用牛日粮;在我国,除用作动物饲料外,多用来栽培食用菌或做肥料。目前,对棉籽壳的利用上主要集中在易水解的半纤维素上,利用溶解液去制备乙醇、乙酰丙酸、草酸等,还可以制低聚木糖或木糖醇和还原糖。
纤维素是重要的纺织、造纸原料,此外,也广泛用于塑料、炸药、电工、科研器材及膳食纤维等方面。纤维素制备可分为物理处理法和化学处理法[3]:1)物理处理法主要包括机械粉碎[4]、蒸汽爆破[5]、膜分离、微波和超声波辅助提取法等,一般用于纤维素提取的预处理工艺或是辅助工艺,其目的是去除木质素等对纤维素具有保护作用的成分;2)化学处理法包括碱液分离法[6]、无机酸处理、有机溶剂法、离子液体法[7]、超临界萃取[8]等。化学试剂采用化学力法来打破木质素和纤维素的链接,同时使半纤维素溶解的过程。在实际应用中,大多是采用两种或两种以上方法的组合,以取长补短,发挥各自优势,改善纤维素分离提取的效果。
棉籽壳如图1所示,其外部附着有大量的棉纤维素,在棉花深加工过程中,现有的技术还不能完全把所有的棉花纤维素分离下来,如何使其与棉籽壳壳体分离,回收这部分纤维素,成为棉籽壳再开发的主要问题之一。本课题组已经实现棉籽壳壳体(如图2所示)与绒体(如图3所示)的分离,如何使得到的绒体进一步纯化,进而得到纯纤维素成为本课题进一步研究方向。本论文采用物理方法和化学方法相结合,先用机械粉碎,再用成本低廉的碱熔法,加入硫化钠,形成亚硫酸根离子,与木质素形成木质素磺酸盐,破坏纤维素与木质素链接,促进木质素的溶解,制备纤维素(如图4所示)。
1 实验材料和方法
1.1 仪器与试剂
原料:棉籽壳,新疆阿拉尔市本地原料(陆地棉)。
主要试剂:氢氧化钠(天津市致远化学试剂有限公词,分析纯);硫化钠(天津市风船化学试剂科技有限公词,分析纯);过氧化氢(天津市致远化学试剂有限公词,分析纯);次氯酸钠(天津市致远化学试剂有限公词,分析纯)。
主要仪器:电子分析天平(FA2004),上海民桥精密科学仪器有限公司;循环水式真空泵(SHZ-D(Ⅲ)),上海东玺制冷仪器设备有限公司;粉碎机(FE200),北京市永光明医疗仪器厂;干燥箱,上海博讯实业有限公司;电热套(HSM500),金坛市医疗仪器厂;数显恒温水浴锅(DK-8D),江苏省金坛市医疗器械厂;超声波清洗器(KQ-100VDE),昆山市超声仪器有限公司;傅立叶变换红外光谱仪(FTIR-8400S),日本津岛。
1.2 实验方法
1.2.1 原料预处理
棉籽壳洗净除杂,于60~90℃ 干燥,然后粉碎机粉碎,过40或60目筛,实现棉籽壳壳体和绒体的分离,如图2、3所示。
1.2.2 棉籽壳绒体各组分含量测定
纤维素含量采用重铬酸钾-碘量法;木质素含量采用Klason法;半纤维素含量采用盐酸水解法和DNS法;水分含量的测定:称取棉籽壳绒体约30 g,在恒温干燥箱中85℃干燥至恒重,计算水分含量,重复测定3次,取平均值;灰分含量的测定:称取棉籽壳绒体大约10 g,在马弗炉中560℃灼烧至恒重,计算灰分含量,重复测定3次,取平均值。
1.2.3 棉籽壳纤维素制备
1.2.3.1 前处理 棉籽壳绒体放入烧杯中加水侵泡,放入超声清洗器中,震荡20分钟左右,使绒体中包裹的棉籽壳壳体脱离沉降到烧杯底部,上层绒体水溶液倒入5 L不锈钢高压反应釜内,升温到140~180℃,保温120 min(实现高温液态水水解半纤维素),加冷凝水降温,倒出反应液,过滤、洗涤,干燥至恒重,备用。
1.2.3.2 制备 称取棉籽壳绒体(绝干)3 g,置于250 ml的烧杯中,加入氢氧化钠和硫化钠,煮沸,过滤洗涤,获得粗纤维加入过氧化氢或次氯酸钠漂白,除去残留的微量木质素,过滤洗涤,干燥,得到棉籽壳纤维素。
1.2.3.3 称重计算收率
收率=M1/M2×100%(M1为最后所得固体剩余物质量,M2为称取的前处理后的棉籽壳绒体的质量)。
2 结果与讨论
2.1 棉籽壳绒体各组分含量
棉籽壳原料、半成品、产品如图1、2、3、4所示。经含量测定,棉籽壳绒体各组分含量为半纤维素9.7%,纤维素70.62%,木质素12.85%,水分5.44%,灰分 1.4。

图1 棉籽壳

图2 棉籽壳壳体

图3 棉籽壳绒体

图4 棉籽壳纤维素
2.2 氢氧化钠与硫化钠比例对纤维素收率的影响
取处理后的棉籽壳绒体3 g,反应时间3 h,加热温度在150℃,计算硫化钠占总碱的0%、10%、20%、30%、40%、60%时,计算剩余物的质量百分数。
由图5可知,硫化钠的百分数从0~30%时,绒体的质量逐渐减少,说明硫化钠的加入有利于绒体中木质素的溶出;当硫化钠质量再增加时,剩余物的质量会增加,表明木质素的溶解逐渐减少,主要由于用碱量一定及其他条件相同时,硫化钠增加硫化度升高,能缩短蒸煮时间,降低木素含量及保证较高的得率,但过高时,则会因有效碱量的下降,导致木质素的脱离度降低。可见氢氧化钠的碱度在蒸煮过程中起到重要的作用,硫化钠起到辅助作用,促进木质素的解离。因此,硫化钠的质量分数控制在25% ~30%为宜。
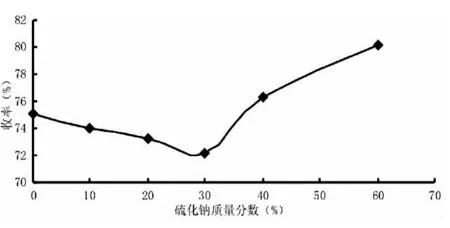
图5 氢氧化钠与硫化钠比例对纤维素收率的影响
2.3 温度对纤维素收率的影响
取处理后的棉籽壳绒体3 g,反应时间3 h,氢氧化钠与硫化钠质量比3:1,控制加热温度在60℃、80℃、100 ℃、120 ℃、140 ℃、160 ℃、180 ℃,计算剩余物的质量分数。

图6 温度与纤维素收率的影响
由图6可知,在低于120℃时,伴随温度的升高,绒体质量减少的比较快,说明温度对木质素的分离是主要影响因素。当温度在140℃以上时,绒体质量逐渐趋于稳定。因此,蒸煮的加热温度不能过低,在140~160℃较好。
2.4 反应时间对纤维素收率的影响
取处理后的棉籽壳绒体3 g,氢氧化钠与硫化钠质量比3:1,加热温度150℃,反应时间在1.5 h、2 h、2.5 h、3 h、3.5 h、4 h、4.5 h、5 h 时,计算剩余物的质量分数。
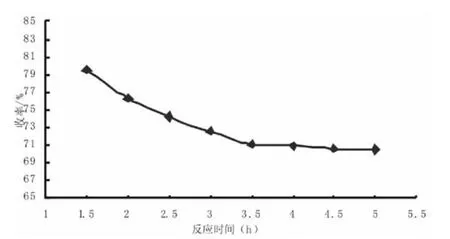
图7 反应时间与纤维素收率的影响
由图7可知,伴随反应时间的增加,棉籽壳绒体质量逐渐减少,当反应时间超过3.5 h时,其质量趋于稳定。因此,蒸煮的时间不能太短,应控制在3.5~4 h为佳。
2.5 棉籽壳纤维素的红外光谱分析
棉籽壳纤维素的红外光谱采用溴化钾压片法进行测定,其FT-IR如图8所示。

图8 棉籽壳纤维素的红外图谱
由图8 可以看出来,1 055 cm-1和3 340 cm-1为纤维素的最强的特征谱带吸收峰。其中,3 340 cm-1吸收峰为 O-H 的伸缩振动峰,2 902 cm-1为-CH2、C -H 的伸缩振动,1 642 cm-1为 C -O 单键的伸缩振动,1 425 cm-1为纤维素的CH2的弯曲振动,1 055 cm-1为C -O -C 的伸缩振动,667 cm-1为羟基-OH面外变形振动。因此,棉籽壳纤维素的吸收峰与纤维素的特征吸收峰比较吻合[9]。
3 结论
新疆是我国优质棉花重要的产区,棉籽壳作为其副产物。因棉籽壳上附有大量的棉花纤维素,这部分纤维素没有得到有效分离,造成了部分棉花纤维素的浪费。本论文对棉籽壳的纤维素的分离与提纯进行了研究,实验结果表明:棉籽壳绒体与壳体分离后,绒体各组分含量:半纤维素9.7%,纤维素70.62%,木质素 12.83%,水分 5.44%,灰分1.41%;其次是对绒体进行了碱煮实验,最佳工艺条件是:碱煮温度140~160℃,反应时间为3.5~4 h,氢氧化钠与硫化钠比例:硫化钠的质量分数为25~30。通过本实验的研究,可以为新疆棉籽壳的再利用提供新的思路。
感谢化工资源有效利用国家重点实验室基金和塔里木大学校长基金对本实验的资助。
[1] Roberson R.World 1994/1995 Cottonseed Production[J].World Agricultural Production,1995,(3):74-76.
[2] Robinson P H,Getachew G,Depers E J,et al.Influence of variety and storage for up to22 days on nutrient composition and gossypol level of Pima cottonseed(gossypium spp.)[J].Animal Feed Science and Technology,2001(91)149~156
[3] 高璇,陆书明.纤维素提取分离技术研究进展[J].德州学院学报,2012,28(2):69-72
[4] 陈洪章.纤维素生物技术厂[M].北京:化学工业出版社,2005.
[5] 林坦,彭红,余紫苹,等.半纤维素分离钝化研究进展[J].中国造纸,2011 ,30(1):60-64.
[6] 李春光,周伟铎,田魏,等.甘蔗渣纤维素提取及木质素与半纤维素脱除工艺探讨[J].中国农学通报,2011,27(4):316 -320
[7] 曹妍,李会泉,张军,等.玉米秸秆纤维素在离子液体中的溶解再生研究[J].现代化工,2008,10;184-187
[8] John Bludworth,F Carl Knopf.Reactive extraction of lignin from wood using supercritical ammonia-water mixtures[J].The Journal of Super critical Fluids,1993,6:249-254.
[9] Zheng Ming- xia,Li Lai- qing,Zheng Ming-yue,etal.Effect of alkali pretreatment on cellulosic structural changes of corn stover[J].Environmental Science &Technology,2012,35(6):27-31.

