甘草酸和甘草黄酮与人肝癌细胞(Hep G2)作用的电化学研究
姜项福 刘文杰,2 白红进,2*
甘草是豆科(Leguminosae)甘草属(Glyeyrrhiza),在许多国家都有分布,而甘草属植物总共有20种,仅在中国就分布达12种,其中新疆占了9种。甘草曾广泛分布西北部各地区,不过由于人为的原因,原主产甘草的山西、陕西、山东及东北三省,现已绝迹或分布甚少,现在能提供野生商品药材的省区仅内蒙古、新疆、宁夏、甘肃、青海和陕西的榆林地区等,而以新疆蕴藏量较多,种质资源也最丰富。根据2000年版《中华人民共和国药典》中记载,甘草的原植物有3种,即乌拉尔甘草、胀果甘草和光果甘草三种。在我国,甘草作为一种中药材,已有2 500多年治疗疾病的历史,现在随着对甘草研究的进一步发展,其已广泛应用于医药、食品、化工等领域。甘草中含有甘草酸、甘草甙、甘草类黄酮、生物碱等多种生物活性成分,其中,甘草酸和甘草类黄酮等是最重要的活性成分。研究表明,甘草酸具有如抗炎、解毒、保肝等功效,甘草酸以及甘草酸注射剂,可用于治疗慢性乙型、丙型肝炎,戊型肝炎等,效果不错[1-2];它可以应用于改善上呼吸道感染的症状[3];在SARS病毒广泛流行的时候,也有人把甘草酸应用到 SARS 临床治疗的报导[4];Chan 等[5]发现甘草酸能对黄曲霉素B1诱导的细胞毒有较好的保护作用;范明浩[6]在研究中发现甘草酸也能直接抑制与哮喘相关的炎症细胞,很好地控制哮喘的发病症状。甘草黄酮是一类成分复杂的混合物,目前已知成分达150多种,单体提取非常困难,所以通常的甘草黄酮实际为黄酮类化合物的混合物。对甘草黄酮的研究也表明,甘草黄酮具有明显的清除自由基以及抑制脑组织脂质发生过氧化反应的作用[7];甘草黄酮有较强的抑制酪氨酸酶活性和黑素生成的作用,同时对黑素细胞的细胞毒性较低,是较为安全有效的美白药物[8];蔡云清等[9]在研究中发现,甘草黄酮能诱导肝癌SMMC-7721细胞凋亡,可抑制SMMC-7721细胞增殖,并呈时间剂量效应。
细胞是生命体结构和功能的基本单位,细胞研究是揭示生命的奥秘和征服疾病的基础环节之一。考察细胞的形态变化、功能变化和周围生化环境的变化,可加深了解细胞的生理过程,这对生命科学自身的发展和生物医药、分析技术和材料科学等的进步都将有重要的促进作用。电化学方法是分析化学领域中一种经典的分析测试方法,具有效率高、耗费低(仪器和试剂均价格较低)、毒性小和重现性好等优点,在各种细胞研究中已经得到了广泛的应用。目前报导的应用较多的电化学方法,主要有细胞的伏安法检测[10-12]、阻抗法检测[13-14]、扫描电化学显微镜法检测[15-16]等。相比较于通常的细胞毒实验方法,如MTT染色法,荧光法以及透射电镜观察法等,虽然实验的结果比较令人满意,但是有的方法所用试剂毒性较大,对人具有很强的致癌性,而有的方法所用到的仪器价格昂贵,缺乏广泛的应用性。电化学方法的引入,无疑是对细胞研究领域的促进和发展,有着很重要的意义。
实验通过以肝肿瘤细胞HepG-2为体外研究模型,利用ITO导电玻璃具有良好的透光性能和导电性能,自制了一组工作电极,借助电化学方法和显微镜观测等手段,评估了甘草酸和甘草黄酮对肿瘤细胞的细胞毒性的影响。甘草酸作为一种比较常见的天然产物成分,已经在医疗和卫生保健领域展现出了很大的应用前景。通过各方面的研究,若是能充分利用新疆的这些特色的优质的甘草资源,积极开发出其最大的应用价值,使之广泛应用到新颖的保健、防癌抗癌药物的开发和研制中,对经济、社会发展都将产生非常重要的意义。
1 材料和方法
1.1 仪器和试剂
光透性氧化铟锡导电玻璃(ITO)购自深圳南玻技术有限公司,厚1.1 mm,涂层为78.5±1.5 m的氧化铟锡薄层,热阻为20.6±2.5Ω/cm2,手动切割成1.5 cm×1.5 cm的薄片。
电化学实验均是使用CHI 660D电化学工作站(上海辰华仪器有限公司,中国)进行,采用常见的三电极系统检测。其中自制的ITO导电玻璃电极作为工作电极,参比电极和对电极分别为饱和甘汞电极(SCE)和铂电极。所有电化学测试均在室温下进行。
使用倒置光学显微镜(奥林巴斯 CKX41,日本)观察了细胞的生长形态,并通过连接于显微镜上的数码相机(奥林巴斯CKX41,日本)对细胞进行拍照。
人肝癌细胞HepG2购自中科院上海细胞库,培养基为添加了10%新生牛血清的RPMI1640,实验中使用的缓冲溶液为pH=7.4的磷酸缓冲溶液(PBS,1.56 g/L Na2HPO4· H2O +0.20 g/L KH2PO4+8.00 g/L NaCl+0.20 g/L KCl)。
甘草酸和甘草黄酮的测试样品由塔里木大学塔里木盆地生物资源保护利用兵团重点实验室提供。
实验中所用的试剂均为分析纯,配制试剂的如无特殊说明均为蒸馏水。
1.2 ITO工作电极的制作
首先用洗涤剂仔细清洗氧化铟锡导电玻片(ITO),浸于丙酮中置于超声仪中超声两次,每次5分钟。然后用超纯水清洗,并在超纯水超声5分钟。用氮气流干燥后,将ITO导电玻片放入高压高温蒸汽中灭菌30分钟,最后于烘箱中60℃条件下干燥待用。
用702白硅胶将切割好的5 mL塑料离心管管身(高度3 cm,内径2 cm)与已灭菌的ITO导电玻片粘贴好制成细胞培养池,再将5个同规格的培养池以硅胶固定在挖有圆孔的硬质塑料板上,分别标记为1、2、3、4、5号。用导电胶将铜导线与ITO导电玻片连接,测试其导电性,然后用环氧树脂作为绝缘体覆盖其余部位,做成实验所用的细胞培养池及电化学工作电极。如图1所示。
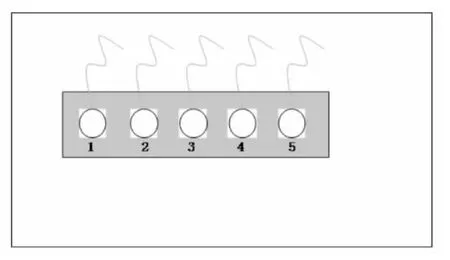
图1 自制ITO导电玻璃电极示意图
1.3 细胞培养与传代
培养基、PBS、胰蛋白酶先放置于37℃的恒温水浴锅中预热,打开紫外灯照射超净工作台30分钟。用75%酒精喷洒双手消毒,并擦拭经过紫外线照射的超净工作台。点燃酒精灯,准备好吸量管和预热好的培养基、PBS、胰蛋白酶(取出时均需以酒精消毒试剂瓶)待用。从培养箱(37℃,5%CO2,湿度95%)内取出细胞,在显微镜下观察细胞生长情况后置于超净工作台中。将原培养液倒入废液缸中,取适量PBS清洗三次。加入1.5 mL胰蛋白酶消化液,在倒置显微镜下观察消化细胞,若胞质回缩,细胞之间不再连接成片,表明此时细胞消化适度,立刻倒弃消化液并加入2~3 mL培养基停止消化。接着用吸量管轻柔地吹打成细胞悬液全部转移至离心试管,离心分离5分钟。弃去上清液,加入2~3 mL培养液,用吸管轻轻吹打细胞再次制成细胞悬液。取1/3体积的细胞悬液转移至一个新的培养瓶,添加8~10 mL培养基,摇匀后将培养瓶(瓶盖不能拧紧,以免细胞缺氧)置于CO2培养箱中让细胞贴壁生长。剩余细胞计数后加适量数目到自制电极中培养,作为电化学测试对象。
1.4 细胞测定
将五个培养池置于紫外线下消毒30分钟后用PBS清洗三次,在每个培养池加入20 000个刚消化的Hep G2细胞,补充培养基使溶液体积至1 000 μL。然后置于CO2恒温培养箱培养24小时,此时细胞已经粘附铺展在ITO导电玻片电极表面,并处于对数生长期。此时,更换2 mL含有各种不同浓度的药物(分别为1.0、1.5、2.0、3.0、4.0 g/L 的甘草酸和甘草黄酮)的培养基,将细胞继续培养24小时,取出电极,以PBS轻洗2~3次,进行细胞观察拍照和电化学测量实验。所有电化学实验是在浓度均为1 mmol/L铁氰化钾/亚铁氰化钾探针溶液(其中含0.1 mol/L的KCl作为支持电解质)中以及室温下进行。
2 结果和讨论
2.1 甘草酸和甘草黄酮的电化学表征
分别把1.500 0 g淡黄色甘草酸粉末和1.500 0 g褐色甘草黄酮溶于100 mL容量瓶中,加入自制的pH=7.4的PBS缓冲溶液在超声波作用下溶解并定容。然后分别吸取0.5 mL配制好的甘草酸溶液和甘草黄酮溶液至ITO电极,设置电化学工作站参数中的扫描速率为100 mV/s,对该两种物质进行电化学测试。

图2 甘草酸(A)和甘草黄酮(B)在PBS中的电化学循环伏安图。(扫描速率:100 mV/s)
从图2(A)中可以看出,在中性条件下,甘草酸的循环伏安图中,电势范围从-0.5 V~1.0 V,均无明显的氧化还原峰的出现,而由图2(B)可以看出,甘草黄酮在-0.4 V~0.6 V范围内也并无明显的氧化还原峰电流出现。考虑到实验中用到的铁氰化钾/亚铁氰化钾氧化还原探针溶液在实验中通常所设定的电势范围为-0.1 V~0.5 V之间,而在这个范围内,甘草酸和甘草黄酮均没有明显的氧化还原峰,所以实验过程中有少量的药品残留也不会对测定的实验结果产生明显的干扰作用。
2.2 甘草酸和甘草黄酮对Hep G2细胞的生长抑制作用
细胞吞噬了一定量的药物或者纳米粒子,在这些外来物质的刺激作用下,会产生细胞的凋亡现象,即体现出这些刺激物的细胞毒性。试验中,分别加入了不同浓度的甘草酸和甘草黄酮,借助于电化学工作站和光学倒置显微镜,直观的比较了甘草酸以及甘草黄酮对Hep G2细胞的细胞毒性大小,所得结果可见图3和图4。

图3 (A)甘草酸,(B)甘草黄酮分别与细胞作用24小时后的循环伏安图(实线图1~4对应浓度均分别是1.0、1.5、2.0、2.5 g/L)。扫速为100 mV/s。探针溶液为含0.1 mol/L KCl支持电解质的铁氰化钾/亚铁氰化钾(0.1 mmol/L:0.1 mmol/L)。
在以铁氰化钾/亚铁氰化钾探针溶液为电子媒介体的电化学测试中,工作电极的导电性能主要可以氧化还原峰电位的差值以及氧化还原峰型来评判。图3(A)和图3(B)中虚线CV图是ITO电极在加了无药物培养基培养48小时后在探针溶液中测量所得,其中最里边虚线部分为加入了细胞的培养基所测得的CV图,发现氧化峰和还原峰的峰-峰电位差分别达到了0.155 V和0.153 V,氧化峰电流分别为49μA和52μA;而最外边的虚线部分则是加入了无细胞的培养基后所测得的CV图,氧化峰和还原峰的峰-峰电位差分别为0.093 V和0.090 V,氧化峰电流分别为197μA和198μA。当培养基加入到电极中48小时后,同时可以看到加入了细胞悬液的电极表面覆盖了一层细胞之后,电极的峰电流明显降低,峰-峰电位差显著增大,这说明细胞在电极表面贴壁生长以及一些培养基中的有机蛋白质分子吸附,大大阻碍了电极和探针溶液之间的电子传递,使得电极的导电性能显著降低。
图3(A)中实线CV图为含不同浓度甘草酸的培养基与细胞作用24小时后测试所得,可以看到,随着甘草酸浓度的增大,电极的峰-峰电位差减小,而峰电流逐渐增大。在浓度为1.0 g/L和1.5 g/L时,对应于图3(A)中的实线1和2,电极的氧化峰电流相比于无甘草酸时要有所增大,分别为55μA和63μA,但幅度较小,说明该浓度对细胞的生长抑制作用但并不明显;而当浓度增加到2.0 g/L和2.5 g/L时,氧化峰电流显著增大,达到了101μA和150μA,说明细胞在该浓度的甘草酸作用下,凋亡数目大大增加,吸附在电极表面的细胞大大减少,使得电极和探针溶液之间的电子传递变得更为顺畅。图3(B)中实线CV图为含不同浓度甘草黄酮的培养基与细胞作用24小时后测试所得,可以看到,在测试的浓度范围内,随着加入的药物浓度的增大,电极的峰-峰电位差也在逐渐减小,而峰电流也依次增大,但没有明显的突越变化,与图3(A)比较即可以看出。这说明在该浓度范围内,细胞对甘草酸的刺激反应比对甘草黄酮的反应更加敏感,甘草酸对细胞的生长抑制效果也要优于甘草黄酮。
通过数码相机对细胞的数量变化进行了实时拍照,如图4中所示。图4(A1-A5)为细胞与不同浓度甘草酸的作用24小时后的照片。A1为未加甘草酸的对照图,与A2~A5比较可以看到,随着甘草酸的浓度增大,ITO电极表面的细胞数量逐渐减少,尤其从A3和A4的比较中可明显看到电极表面细胞数量的变化,A5中细胞数量已经比较稀少。这也印证了电化学测试的结果。图4(B1~B5)为细胞与不同浓度甘草黄酮作用24小时后的照片。B1为对照图,从B2~B5中可以看到,随着甘草黄酮浓度增大,ITO电极表面的细胞数量逐渐减少,但并没有出现显著细胞数量的变化。这与电化学实验结果也是一致的。

图4 浓度均分别是0、1.0、1.5、2.0、2.5 g/L的甘草酸(A1~A5),甘草黄酮(B1~B5)与细胞作用24小时后的照片。
结果表明,甘草酸和甘草黄酮都会对肝癌细胞Hep G2产生抑制杀伤作用,但在较低浓度时,甘草酸的抑制杀伤作用要更为显著,并且有明显的突越变化。
2.3 甘草酸对Hep G2细胞的抑制效率研究
通常可把药物对细胞的杀伤抑制效率(Inhibition Efficiencies,IE)定义为:

公式中I0是ITO电极中加入无细胞的培养基24小时后所测得的阳极峰电流值,I1和I2分别是培基中不含和含有药物时,细胞培养48小时后所测得的阳极峰电流。公式中分母(I0-I1)表示细胞引起的电极电化学活性和导电性的降低;分子(I2-I1)则表示加入了药物后对细胞的抑制效果。
通过同浓度的甘草酸和甘草黄酮对Hep G2细胞作用的效果表现,把甘草酸的浓度梯度范围扩大,考察了其对肿瘤细胞的抑制效率,所得结果如图5所示。从图中可以看出在甘草酸浓度小于2.0 g/L时,其对Hep G2细胞的抑制作用较小,没有超过20%;而当浓度大于2.0 g/L时,抑制效率增幅明显变大,达到了38%,当浓度增大到4.0 g/L时,抑制效率增至76%,而通过显微镜观测,见图4(A),可看到此时ITO电极上细胞存活的数量已经很少。这也说明甘草酸在较大浓度时,对肿瘤细胞的杀伤效果已经很显著。但随着浓度的继续增大,其对细胞的抑制率变化幅度已经很小,说明此时影响电极与氧化还原探针溶液的电子传导已经不是由于细胞的阻碍,而是培养基中大量的有机营养物质吸附在电极表面造成了电子在探针溶液中的传导不利。
在相同条件下做了三次平行实验,由于细胞培养体系中成分的复杂性,相对偏差的范围在6.0%-13.0%(见图5),说明本实验采取的电化学检测手段是可行的,基本达到了预期的目的。
3 结论
通过电化学循环伏安法以及光学显微镜观测的方法,研究了甘草酸和甘草黄酮两种天然产物与人肝癌细胞Hep G2的相互作用,发现甘草酸和甘草黄酮都能抑制Hep G2细胞的生长繁殖,并且其效率和培养基中的浓度相关,浓度越大,抑制率越高,呈现出相应的浓度依赖性。其中甘草酸的细胞抑制效率较甘草黄酮要更强一些,当甘草酸的浓度达到2.0 g/L时,其对细胞的生长抑制出现显著提高,而甘草黄酮并没有出现明显变化。在接下来的工作中,应该考虑把这几种甘草的提取物与肿瘤细胞和正常细胞分别作用,考察其对不同细胞的作用是否会存在着特异性,以及对细胞体中小分子结构和含量的影响。

图5 不同浓度甘草酸对Hep G2细胞的抑制率
研究开发出一些低浓度、低毒高效的防癌抗癌药物,一直是各国科学家和医疗专家的目标,而已知的人工合成的化学抗癌药物是很难达到要求,所以在近几年,天然产物以及中草药已经成为药物开发包括癌症治疗领域的一个备受关注且极具潜力的研究对象。通过本研究,希望能够为新疆丰富的甘草资源的充分开发利用提供一些理论上的支撑。
4 致谢
实验过程中得到了湖南师范大学国家重点实验室谭亮副教授的很多帮助,同时也得到了基础实验楼无机实验室洪远新老师和分析实验室的蒋卉老师的帮助,在此深表感谢。
[1] Zhang L,Wang B.Randomized clinical trial with two doses(100 and 40 ml)of Stronger Neo-Minophagen C in Chinese patients with chronic hepatitis B[J].Hepatol Res.,2002,24:220 -227.
[2] Anurag T,Tandon B,Bhujwala R.Clinical spectrum of acute sporadic hepatitis E and possible benefit of glycyrrhizin therapy[J].Hepatol Res.,2002,23:55 -61.
[3] Youichi Y,Masatsune O,Eita F,et al.Effects and cost of glycyrrhizin in the treatment of upper respiratory tract infections in members of the Japanese maritime self-defense force:preliminary report of a prospective,randomized,double-blind,controlled,parallel-group,alternate - day treatment assignment clinical trial[J].Curr.Ther.Res.,2004,65(1):26 -33.
[4] Cinatl J,Morgenstern B,Bauer G,et al.Glycyrrhizin,an active component of liquorice roots,and replication of SARS - associated coronavirus[J].Lancet,2003,361:2045-46.
[5] Chan H,Chan C,John W,et al.Inhibition of glycyrrhizic acid on aflatoxin B1-induced cytotoxicity in hepatoma cells[J].Toxicology,2003,188:211 -217.
[6] 范鸣浩.甘草酸与β2肾上腺素受体激动剂联合抑制哮喘炎症研究[J].医学信息,2011,9:4753-4754.
[7] 傅乃武.甘草黄酮类与三萜类化合物抗氧化作用的研究[J].中药药理与临床,1994,5:26 -28.
[8] 马晶波,冯树芳,李锋,等.甘草黄酮对B1 6黑色素瘤细胞代谢的影响[J].复旦学报,2003,30:353-355.
[9] 张世蓣,周翌婧,刘艳,等.甘草黄酮诱导肝癌SMMC-7721细胞凋亡及其对相关蛋白survivin表达的影响[J].南京医科大学学报(自然科学版),2008,28:330-334.
[10] Feng J,Ci Y,Lou J,et al.Voltammetric behavior of mammalian tumor cells and bioanalytical applications in cell metabolism [J]. Bioelectrochem. Bioenerg.,1999,48:217-222.
[11] Ci Y,Zhai Q,Wang S,et al.Voltammetric studies of the effect of Cisplatin - liposome on HepG -2 cells[J].Talanta,2001,55:693-698.
[12] Feng J,Luo G,Jian H,et al.Voltametric behavior of tomor cells U937 and its usefulness in evaluating the effect of caffeic acid[J].Electroanalysis,2000,12:513-516.
[13] Qiu Y,Liao R,Zhang X.Real-Time Monitoring Primary Cardiomyocyte Adhesion Based on Electrochemical Impedance Spectroscopy and Electrical Cell-Substrate Impedance Sensing[J].Anal.Chem.,2008,80:990-996.
[14] 张红波,王力,马青.用阻抗法评价血液细胞介电性能对低氧的反应[J].浙江大学学报(理学版),2009,36:85-90.
[15] Liu B,Rotenberg S,Mirkin M,et al.Scanning electrochemical microscopy of living cells.4.Mechanistic study of charge transfer reactions in human breast cells[J].Anal.Chem.,2002,74:6340 -6348
[16] Shiku H,Shiraishi T,Ohya H,et al.Oxygen Consumption of Single Bovine Embryos Probed by Scanning Electrochemical Microscopy[J].Anal.Chem.,2001,73:3751-3758.

