利用转基因烟草确定AtELHYPRP2蛋白对赤霉菌的抗性及其亚细胞定位特征
柴秋霞,李本昌,徐子勤
西北大学生命科学学院 陕西省生物技术重点实验室 西部资源与现代生物技术省部共建教育部重点实验室,陕西 西安710069
细胞壁是植物抵御病原体侵染、极端温度、脱水等生物和非生物胁迫因素的第一道屏障。在胁迫条件下,细胞表面的脂类和蛋白质组分会发生改变和重排,以此来增强细胞壁的牢固性,减轻不利环境对细胞的损伤作用。脂转移蛋白 (Lipid transfer protein, LTP) 是细胞壁中的主要蛋白质,大小9–10 kDa,具有许多重要的生物学功能[1-3]。离体实验结果表明,LTP能够在膜之间转移脂质分子,它们与脂质分子的亲合作用没有选择性[4]。在植物中,角质的形成、花器官亲脂性物质的沉积以及胚胎的早期发生过程均与LTP有关[5-6]。
在植物抗真菌反应中,LTP能够与细胞膜上特定的脂蛋白和激发素 (Elicitin) 受体结合,直接或通过与富含半胱氨酸的硫素蛋白 (Thionin)协同作用来增加膜的通透性[7-8]。LTP蛋白的结构特点是含有 8个高度保守的半胱氨酸残基,可形成 4个二硫键,三级结构具有一个稳定的疏水性空腔,用于结合与转运脂类物质[7]。越来越多的证据显示LTP参与了植物的抗病反应,它们能够抑制病原体生长,并可能负责传递与系统性获得抗性 (Systemic acquired resistance,SAR) 有关的脂类信号分子[9-12]。
拟南芥AT4G12500基因编码一个大小为18.35 kDa的蛋白质,与EARLI1蛋白具有很高的同源性[13],均由N端的信号肽序列、中间位置的亲水性富含脯氨酸结构域 (Proline-Rich-Domain, PRD) 和 C端的疏水性八半胱氨酸基序 (Eight Cysteine Motif, 8CM) 构成,因此本工作将其命名为AtELHYPRP2(EARLI1-LIKE HYBRID PROLINE-RICH PROTEIN 2)。该基因编码蛋白的8CM结构域包含8个位置十分保守的半胱氨酸,其中第 3和第 4个半胱氨酸是连续的,第 5和第 6个半胱氨酸中间只隔一个氨基酸残基,这与 LTP十分相似,因此也被归类到 LTP家族中[14]。AtELHYPRP2蛋白的 PRD结构域与细胞壁中的富含脯氨酸蛋白 (Proline-Rich-Protein, PRP) 以及伸展蛋白具有较高的相似性,可能与细胞壁有功能上的联系[15]。
AtELHYPRP2、AZI1、EARLI1和AT4G12490四个 EARLI1亚家族基因串联排列在拟南芥的第 4号染色体上,基因芯片分析结果显示它们在生物和非生物胁迫条件下具有共表达特征,但目前尚未见有关AtELHYPRP2基因功能的专门报道。已有的研究表明,EARLI1重组蛋白能够抑制酿酒酵母和真菌细胞的生长[16],同一亚家族基因AZI1对蒜薹灰霉菌具有抗性[17]。另外,AZI1能够和DIR1相互作用,负责转移与SAR有关的长距离信号[18]。本研究通过农杆菌介导的遗传转化方法得到了表达AtELHYPRP2-GFP融合蛋白的转基因烟草植株,研究了AtELHYPRP2蛋白的亚细胞定位特征、对真菌病原体的抗性功能及其在烟草SAR中的作用。
1 材料与方法
1.1 材料
1.1.1 植物材料与真菌菌株
实验使用的植物材料为拟南芥Arabidopsis thalianaCol-0生态型 (Columbia-0) 植株和秦烟95Nicotiana tabacum无菌苗。基因克隆实验采用大肠杆菌Escherichia coliDH5α感受态细胞。烟草遗传转化实验使用农杆菌LBA4404菌株。
1.1.2 试剂
限制性内切酶PagⅠ、SpeⅠ、NcoⅠ和 T4 DNA连接酶购自 Fermentas公司;2×TaqPCR Mix购自西安润德生物技术有限公司;PfuDNA聚合酶、琼脂糖凝胶 DNA回收试剂盒、质粒DNA小量提取试剂盒购自生工生物工程有限公司;DL2000 DNA Ladder、反转录试剂盒购自TaKaRa公司;植物双元表达载体pCAMBIA1302为本实验室保存。
1.2 方法
1.2.1 pCAMBIA1302-AtELHYPRP2-GFP融合表达载体的构建
按照CTAB法从拟南芥Col-0生态型植株叶片提取基因组DNA,根据AtELHYPRP2基因的开放阅读框设计上下游引物 AT4G12500PagⅠ和 AT4G12500SpeⅠ (表 1),采用Pfu高保真DNA聚合酶进行PCR反应,用琼脂糖凝胶DNA回收试剂盒回收目的片段。用PagⅠ和SpeⅠ对纯化的AtELHYPRP2基因扩增产物进行分步酶切,得到具有粘性末端的目的片段。用质粒小提试剂盒提取pCAMBIA1302质粒,经NcoⅠ和SpeⅠ双酶切得到具有粘性末端的载体片段。用T4 DNA连接酶连接目的片段和载体片段,转化DH5α感受态细胞后再附加50 μg/mL卡那霉素的LB培养基上进行选择培养。对获得的抗性克隆进行菌落PCR鉴定,将鉴定正确的菌液送往上海生工生物技术公司进行测序。
1.2.2 转AtELHYPRP2基因烟草植株的再生
从测序正确的克隆提取 pCAMBIA1302-AtELHYPRP2-GFP质粒DNA,用液氮冻融法转化农杆菌 LBA4404 感受态细胞,在附加100 μg/mL 链霉素、50 μg/mL 卡那霉素和 20 μg/mL利福平的YEB培养基上进行选择培养。对获得的阳性克隆进行菌落PCR鉴定,用鉴定正确的克隆转化秦烟95叶片外植体。将叶片放入带有滤纸的培养皿中,用剪刀将其剪成 1 cm×1 cm大小,然后浸入OD600≈0.6的农杆菌菌液中侵染5 min。用无菌滤纸吸干菌液后,将叶片外植体转接到附加1 mg/L 6-BA、0.2 mg/L NAA的MS培养基上,在黑暗条件下共培养3 d。将暗培养的烟草叶片转移到附加 500 mg/L头孢霉素、25 mg/L潮霉素B的选择培养基上进行愈伤组织和芽的诱导。将长大的芽转至含0.1 mg/L NAA的1/2 MS培养基上生根。将完整的再生植株移栽到珍珠岩 蛭石 营养土 (1∶1∶2) 基质中培养,生长条件为16 h光照/8 h黑暗、65%湿度、21 ℃。
1.2.3 转基因烟草的分子鉴定
从具有潮霉素 B抗性的转基因烟草中提取基因组DNA,用AtELHYPRP2基因开放阅读框上下游引物进行PCR鉴定。取0.2 g转基因烟草叶片,在液氮中研磨后用Trizol试剂 (Invitrogen公司) 提取总RNA。经紫外定量后,将RNA稀释到合适浓度,用 ExScript RT Reagent Kit(TaKaRa公司) 合成cDNA。以cDNA为模板,用AtELHYPRP2基因开放阅读框上下游引物进行RT-PCR,检测转移基因的表达水平。RT-PCR以烟草Actin基因为内部参照,上下游引物序列分别为Tobacco F和Tobacco R (表1)。
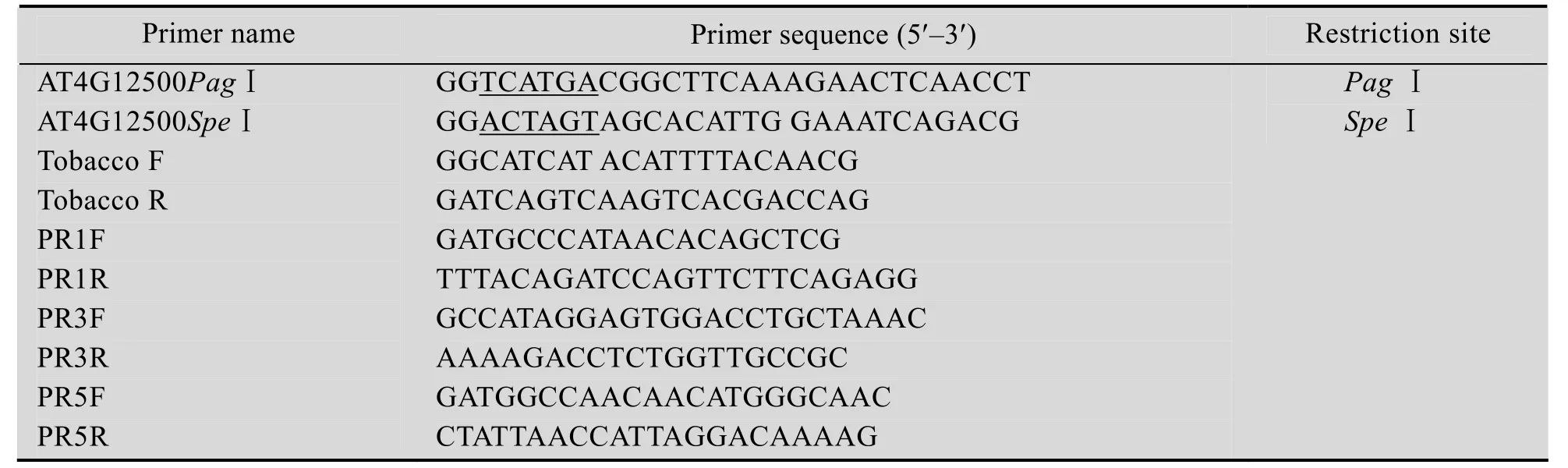
表1 PCR扩增所用引物序列Table 1 Primers used in PCR
1.2.4 赤霉菌侵染分析
赤霉菌Gibberella fujikuroi菌株在马铃薯培养基上于28 ℃倒置培养4 d后,用1/4液体马铃薯培养基悬浮孢子。经玻璃棉过滤除去菌丝后,将赤霉菌孢子与马铃薯培养基混匀,28 ℃倒置培养4 d;然后用打孔器将培养基打成直径为1 cm的小圆盘,接种于秦烟95野生型和转基因植株叶片上,于22 ℃、16 h光照/8 h黑暗、90%湿度条件下培养。5 d后观察叶片形态及赤霉菌侵染程度。侵染实验重复3次。
为了检测 H2O2的积累情况,侵染2 d后用0.5% DAB (3,3-二氨基联苯胺) 在 37 ℃对野生型和转基因烟草叶片进行过夜染色,经乙醇脱色后用 80%甘油封片观察。同时,用 0.4%台盼蓝对侵染2 d后的野生型和转基因烟草叶片于37 ℃染色1 h,在85%乙醇中煮10 min脱去叶绿素,用 80%甘油封片后在显微镜下观察细胞的存活状态。
1.2.5 AtELHYPRP2蛋白的亚细胞定位
取野生型秦烟95、AtELHYPRP2-GFP转基因烟草和GFP转空载烟草的叶片和根,平铺在加有1.5 μmol/L荧光染料碘化丙啶 (PI) 的载玻片上,浸润15–30 min后压片。在OLYMPUS 激光共聚焦扫描显微镜下观察GFP产生的绿色荧光和 PI结合细胞壁后产生的红色荧光,确定AtELHYPRP2蛋白的存在部位。GFP的激发光波长为488 nm,发射光波长为507 nm。PI的激发光波长为535 nm,发射光波长为615 nm。
1.2.6 SAR相关PR基因的表达分析
赤霉菌在马铃薯培养基中倒置培养4 d后,切成1 cm×1 cm的小块,接种于野生型秦烟95和转基因植株下部的叶片上,于22 ℃、16 h光照/8 h黑暗、90%湿度条件下培养。5 d后取侵染叶片和上部未侵染叶片,用 Trizol试剂提取总 RNA。经紫外定量后,将 RNA稀释到合适浓度,用ExScript RT Reagent Kit (TaKaRa) 合成cDNA。将cDNA稀释到200 ng/μL,作为模板,用 SAR相关 PR基因的上下游引物进行RT-PCR,检测 PR基因在野生型与转基因植株中的表达情况。RT-PCR以烟草Actin基因为内部参照,PR1基因的上下游引物分别为PR1F和PR1R,PR3基因的上下游引物分别为 PR3F和PR3R[19],PR5基因的上下游引物分别为 PR5F和 PR5R (表 1)。
2 结果与分析
2.1 AtELHYPRP2蛋白的结构分析
AtELHYPRP2基因的开放阅读框包含 534个碱基对,无内含子,编码的蛋白质由 177个氨基酸构成。AtELHYPRP2蛋白的理论等电点和分子量分别为8.93 kDa和18.35 kDa。预测该蛋白由N端的信号肽序列 (1–26)、中间富含脯氨酸的亲水性结构域PRD (27–94) 和C端保守的疏水性 8CM (95–177) 组成 (图 1)。对Genevestigator (https://www.genevestigator.com/)数据库中的芯片实验结果进行分析,发现AtELHYPRP2基因可以被生物和非生物胁迫因素诱导,说明该基因在拟南芥抗逆性方面可能具有一定的作用。采用DNAStar MegAlign中的Clustal W 算法进行序列比对,结果显示AtELHYPRP2与 EARLI1之间具有很高的同源性 (图 2)。
2.2 pCAMBIA1302-AtELHYPRP2-GFP融合表达载体的构建

图1 AtELHYPRP2蛋白(NP192987)的氨基酸序列Fig. 1 Deduced amino acid sequence of AtELHYPRP2. The signal peptide is underlined, 8CM is framed, and the conservative cysteine residues are shadowed.

图2 AtELHYPRP2与EARLI1氨基酸序列比对Fig. 2 Alignment of the amino acid sequences between AtELHYPRP2 and EARLI1.
AtELHYPRP2基因没有内含子,可根据开放阅读框设计一对引物,以基因组DNA为模板扩增它的编码序列。本实验所用的载体为pCAMBIA1302,在35S启动子和gfp报告基因之间有3个酶切位点,在构建融合表达载体时选择了NcoⅠ和SpeⅠ两个酶切位点。由于AtELHYPRP2基因内部存在NcoⅠ酶切位点,所以在扩增目的片段时,上游引物 5′-端引入了NcoⅠ同尾酶PagⅠ的识别和切割位点,下游引物5′-端引入了SpeⅠ限制性酶切位点。因为PagⅠ和SpeⅠ限制性内切酶所用的缓冲液不同,所以对纯化的AtELHYPRP2基因扩增产物进行了分步酶切,用NcoⅠ和SpeⅠ内切酶对 pCAMBIA1302质粒载体进行了双酶切。进一步用T4 DNA连接酶连接目的片段和载体片段,转化 DH5α感受态细胞后在附加50 μg/mL卡那霉素的LB培养基上进行选择培养。对获得的抗性克隆进行菌落PCR鉴定,可以扩增产生534 bp的条带 (图3A),符合预期大小。将鉴定正确的克隆送往上海生工生物技术公司进行测序,结果显示本实验克隆的AtELHYPRP2基因在序列上与GenBank中登录的数据完全一致。
2.3 AtELHYPRP2-GFP转基因烟草植株的再生
用液氮冻融法将pCAMBIA1302-AtELHYPRP2-GFP质粒导入农杆菌LBA4404感受态细胞,挑取抗性克隆,进行菌落PCR检测,结果产生符合预期大小的条带 (图3B)。对鉴定正确的农杆菌克隆进行扩大培养,采用叶圆盘转化法对秦烟 95无菌苗叶片进行遗传转化。将侵染过的叶片在附加1 mg/L 6-BA、0.2 mg/L NAA的MS培养基中暗培养3 d。将共培养的叶片外植体转入含500 mg/L Cef、25 mg/L HmB、1 mg/L 6-BA、0.2 mg/L NAA的MS培养基中进行选择培养,大约 1个月后长出愈伤组织。将愈伤组织转接到相同培养基中进行继代培养,20 d后分化出芽,然后转至附加0.1 mg/L NAA的MS培养基生根。将完整植株移栽到混合基质中,长大后进行分子生物学鉴定。
2.4 转基因烟草的分子鉴定
采用CTAB法从具有潮霉素B抗性的转基因烟草提取基因组DNA,进行PCR鉴定,结果显示7株再生植株中有6株整合有AtELHYPRP2-GFP转移基因 (图 4A)。从 6株AtELHYPRP2-GFP转基因烟草 (分别命名为 T1、T2、T3、T4、T5、T6) 叶片提取总 RNA,进行 RT-PCR,结果表明转移基因可以表达产生mRNA (图4B)。通过 Quantity One软件对转基因烟草中目的基因与组成性表达的Actin基因的转录水平进行分析,并以两者的比值作为不同转基因株系中目的基因的相对表达量,结果显示转基因株系1–6中AtELHYPRP2基因的相对表达量分别为1.406 25、1.609 8、0.598 3、2.485 4、1.486 9 和0.507 7。从6株转基因植株中选取5株提取总蛋白进行Western blotting印迹分析,结果显示在这5个转基因株系中都能够检测到目的蛋白 (图5)。
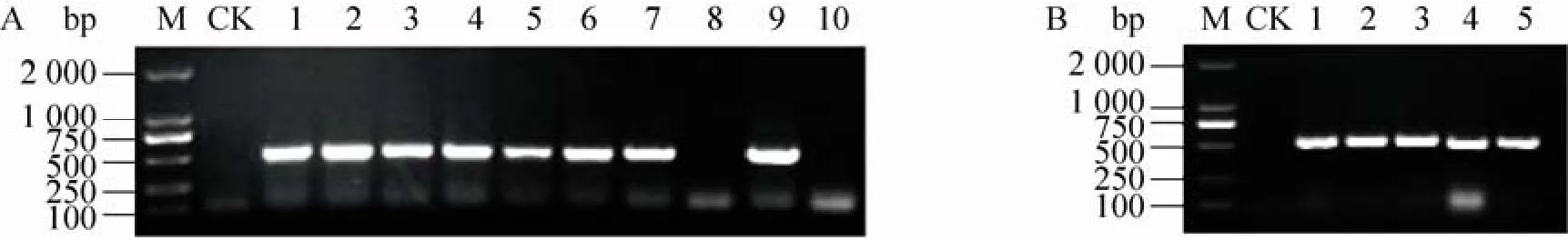
图 3 pCAMBIA1302-AtELHYPRP2-GFP转化大肠杆菌 DH5α细胞 (A) 及农杆菌 LBA4404细胞 (B) 的菌落PCR鉴定Fig. 3 Colony PCR of Escherichia coli DH5α and Agrobacterium tumefaciens LBA4404 transformed by pCAMBIA1302-AtELHYPRP2-GFP. (A) Colony PCR of Escherichia coli DH5α. M: DL2000 DNA ladder; CK:negative control; 1–10: different colonies transformed by ligation product. (B) Colony PCR of Agrobacterium tumefaciens LBA4404. M: DL2000 DNA ladder; CK: negative control; 1–5: different colonies transformed by pCAMBIA1302-AtELHYPRP2-GFP.
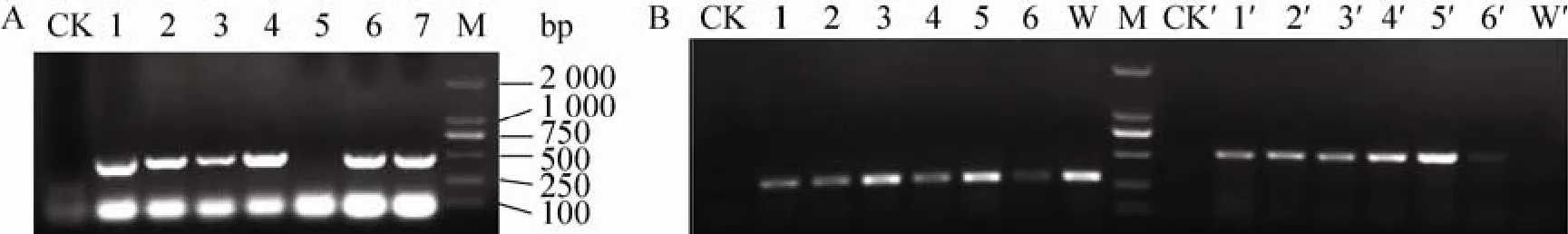
图4 AtELHYPRP2-GFP转基因烟草的PCR检测及RT-PCR分析Fig. 4 PCR identification and RT-PCR analysis of transgenic tobacco plants containing AtELHYPRP2-GFP. (A)PCR identification of transgenic tobacco plants. CK: wild-type tobacco plant; 1–7: putative transgenic plants; M:DL2000 DNA ladder. (B) RT-PCR analysis of transgenic tobacco plants. CK: negative control, without template; 1–6:RT-PCR of Actin gene in different transgenic tobacco plants (T1–T6); W: RT-PCR of Actin gene in wild-type tobacco plant; M: DL2000 DNA ladder; CK': negative control, without template; 1′–6′: RT-PCR of AtELHYPRP2-GFP in different transgenic tobacco plants (T1–T6); W': RT-PCR of AtELHYPRP2-GFP in wild-type tobacco plant.
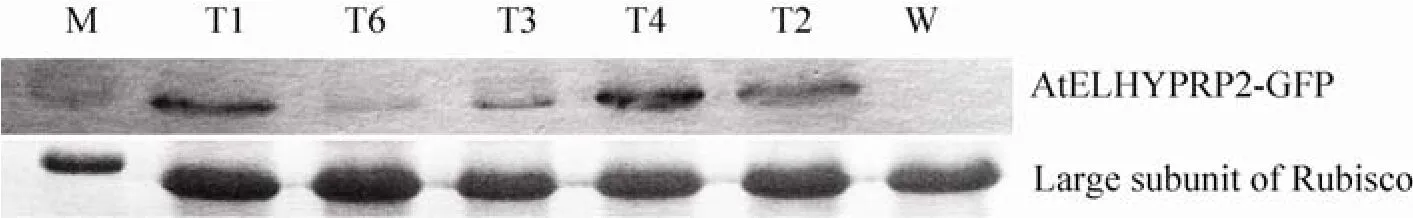
图5 AtELHYPRP2-GFP转基因烟草的Western blotting分析Fig. 5 Western blotting analysis of transgenic tobacco plants containing AtELHYPRP2-GFP. M: PageRuler™Prestained Protein Ladder RDM604; W: total protein of wild-type tobacco plant; T1, T2, T3, T4, T6: total protein of different transgenic tobacco plants. Top panel: Western blotting analysis of AtELHYPRP2-GFP expression in different transgenic tobacco plants. Lower panel: Rubisco was adopted to show the loading amount of different samples.
2.5 赤霉菌侵染分析
为了检测AtELHYPRP2基因对真菌病原体的抗性,切取第1代不同转基因烟草株系和不同野生型烟草个体同一部位、大小接近相同的叶片,进行赤霉菌侵染,结果显示侵染5 d后野生型烟草叶片侵染点周围的细胞逐渐坏死,损伤程度明显比转基因烟草叶片严重;同时,野生型烟草叶片明显变黄 (图 6)。这说明整合有AtELHYPRP2基因的转基因烟草植株对赤霉菌具有明显的抗性。同时,对赤霉菌侵染 8 d后的坏死斑大小进行了统计学分析,结果显示转基因烟草的坏死斑明显小于野生型烟草,且具有统计学差异 (图7)。为了检测AtELHYPRP2基因表达水平与抗菌性的关系,从6株转基因株系中选择T1、T2、T4、T6四个株系进行赤霉菌侵染实验,8 d后观察侵染情况。结果显示,AtELHYPRP2基因表达量高的烟草叶片上形成的坏死斑小于表达量低的转基因烟草(图 8)。

为了检测侵染位点H2O2的积累情况,将赤霉菌侵染 2 d后的转基因和野生型烟草叶片在DAB中染色过夜,经85%乙醇脱去叶绿素后用甘油封片观察。结果显示,转基因烟草叶片侵染位点被染成深红棕色的斑,说明接种后可造成 H2O2的大量积累,引发超敏反应 (图 9B)。而野生型烟草叶片侵染位点能产生弥散的浅红棕色的区域,说明接种后产生了低水平的H2O2积累,不能引发超敏反应 (图9A)。为了检测侵染位点的细胞存活状态,将赤霉菌侵染2 d后的转基因和野生型烟草叶片在台盼蓝中染色1 h,结果显示转基因烟草叶片侵染位点周围细胞的坏死状况比野生型烟草叶片轻,病原体没有扩散,而野生型烟草叶片侵染位点周围病原体已有明显的扩散 (图10)。
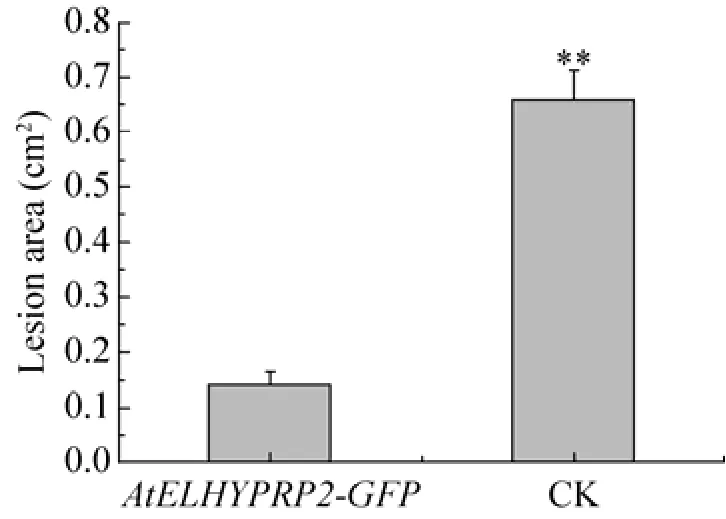
图7 赤霉菌侵染后AtELHYPRP2-GFP转基因烟草及野生型烟草叶片上坏死斑大小的统计学分析Fig. 7 Statistical analysis of the sizes of necrotic spots on leaves of transgenic tobacco plants harboring AtELHYPRP2-GFP and wild-type tobacco plants after infection with G. fujikuroi. Data were recorded 8 days post infection and were shown as the ±s of three replications. AtELHYPRP2-GFP: transgenic tobacco plants; CK, wild-type tobacco plants.

图8 不同AtELHYPRP2-GFP转基因烟草株系对赤霉菌的抗性Fig. 8 Resistance of different transgenic tobacco lines containing AtELHYPRP2-GFP to G. fujikuroi. T1, T2,T4, T6: different transgenic tobacco lines.
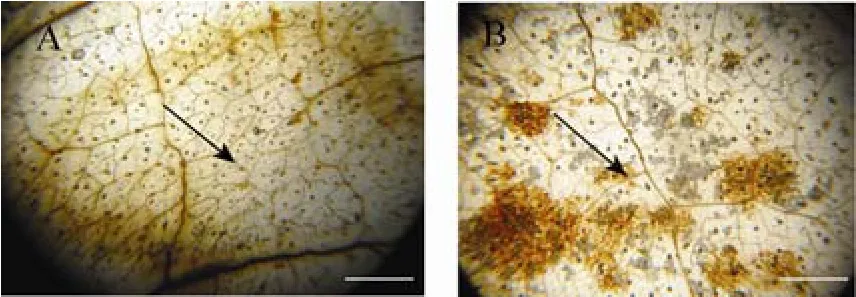
图9 赤霉菌侵染后H2O2积累水平的DAB染色Fig. 9 DAB staining of H2O2 accumulation after infection with G. fujikuroi. (A) Leaf of wild-type tobacco plants. (B) Leaf of transgenic tobacco plants.Arrow pointing to the infection site. Bar=1 mm.
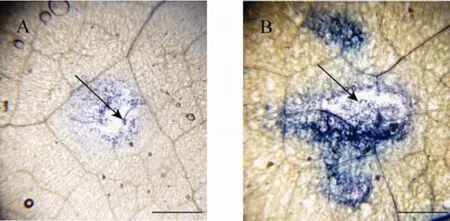
图10 细胞存活状态的台盼蓝染色Fig. 10 Observation of cell survival by trypan blue staining. (A) Leaf of transgenic tobacco plants. (B)Leaf of wild-type tobacco plants. Arrow pointing to the infection site. Bar=0.5 mm.
2.6 AtELHYPRP2蛋白的亚细胞定位
激光共聚焦显微观察结果显示,AtELHYPRP2-GFP转基因烟草根中的绿色荧光分布于细胞表面,能够与碘化丙啶对细胞壁染色后产生的红色荧光重合,说明AtELHYPRP2蛋白在细胞内被翻译合成后,可通过分泌途径定位到细胞表面,并且主要存在于细胞壁中 (图11A-I)。另外,还可以观察到绿色荧光分布于与粗面内质网相通的细胞核的外膜上,说明该蛋白也可能存在于内膜系统。已有的研究表明,DIR1、AZI1蛋白可定位于细胞核外膜、内质网及胞间连丝[12,18]。本研究发现与 AZI1属于同一亚家族的AtELHYPRP2蛋白既可以分泌到细胞表面,也可能定位于内膜系统。与此相反,在pCAMBIA1302空载体转化的转基因烟草中,GFP荧光存在于整个细胞中 (图11J-L)。
2.7 AtELHYPRP2对烟草系统性获得抗性相关基因表达的影响
RT-PCR结果表明,在AtELHYPRP2-GFP转基因烟草中,与SAR相关的PR1基因的本底表达量比野生型高,PR3、PR5基因的本底表达水平与野生型相差不大 (图 12A),说明转基因烟草中AtELHYPRP2基因的组成性表达能够影响系统性获得抗性中的主要基因。赤霉菌侵染5 d后,AtELHYPRP2-GFP转基因烟草被侵染叶片中3个PR基因的表达水平与野生型被侵染叶片相差不大。但是在上部未侵染叶片中,转基因烟草PR1和PR5基因的表达量整体比野生型高 (图12B),说明AtELHYPRP2基因在SAR中具有一定的作用。在侵染实验中,尽管PR1和PR5在不同野生型对照个体的系统叶片中的表达水平存在一定差异(图12B中2、4泳道),但都明显低于转基因烟草的系统叶片(图12B中6、8 泳道)。

图11 AtELHYPRP2蛋白的亚细胞定位Fig. 11 Subcellular localization of AtELHYPRP2. (A–F) Root transection of transgenic tobacco plants harboring AtELHYPRP2-GFP. (A, D) Fluorescence of GFP. (B, I) Fluorescence of PI. (C, F) Merge of A, B and D, E,respectively. (G–I) Longitudinal section of root of transgenic tobacco plant harboring AtELHYPRP2-GFP. (G)Fluorescence of GFP. (H) Fluorescence of PI. (I) Merge of G and H. (J–L) GFP fluorescence in transgenic tobacco plants transformed by empty vector.

图12 AtELHYPRP2-GFP对烟草中与SAR相关的PR基因的影响Fig. 12 Influence of AtELHYPRP2-GFP to tobacco PR genes related with SAR. (A) Basal expression level of PR genes. CK: negative control, without template; 1–2: wild-type tobacco plants; 3–6: transgenic tobacco lines. (B)Expression level of PR genes after G. fujikuroi infection. CK: negative control, without template; 1, 3: local wild-type tobacco leaves infected with G. fujikuroi; 2, 4: distal wild-type tobacco leaves after infection with G. fujikuroi; 5, 7:local transgenic tobacco leaves infected with G. fujikuroi; 6, 8: distal transgenic tobacco leaves after infection with G. fujikuroi.
3 讨论
植物对病原体的抗性可以用基因对基因学说加以解释。该学说认为当病原菌具有无毒基因 (Avr)、宿主植物具有抗性基因 (R) 时,R基因的表达产物和Avr基因的表达产物相互作用,会使植物个体表现出抗性[20]。植物有多条阻止病原体侵染的途径。当植物对病原体具有抗性时,经常会产生超敏反应 (Hypersensitive response, HR)。HR指侵染位置的细胞迅速进入程序化死亡过程,限制病原体向其他部位扩散,能够使周围的健康组织免受损害。HR往往伴随着一系列与防御相关的应答反应,包括过氧化氢等活性氧分子 (Reactive oxygen species,ROS)的爆发等[21]。活性氧对于细胞内和周围细胞是一种预警信号,它们能够引起细胞壁结构的加厚、植物抗毒素的产生、超敏反应和SAR反应等[22]。在病原体侵染时,有些植物不产生抗毒素,而是释放酚醛树脂、环烯醚萜苷类、芥子油苷和皂苷等有毒物质,这些有毒物质在正常情况下是以无毒的糖苷类形式储存于液泡中的[23]。
DAB染色可以反映病原体侵染后植物组织中主要的活性氧分子过氧化氢的积累水平。DAB在过氧化氢存在下会失去电子而形成浅棕色不溶性产物,可用于检测过氧化物酶的活性。本研究发现,用赤霉菌孢子侵染后,转基因烟草叶片侵染位点被DAB染成了深棕红色,有大量H2O2积累,引发了超敏反应。而野生型烟草叶片侵染位点只被染成弥散的浅棕红色,不能引发超敏反应。台盼蓝是一种细胞活性染料,常用于检测细胞膜的完整性。用赤霉菌孢子侵染后,野生型烟草叶片侵染位点附近细胞的坏死状况明显比转基因烟草严重。
真菌孢子与植物表面接触后,在合适条件下就会萌发。植物已进化出很多机制来阻止真菌孢子的萌发和萌发管的伸长过程,包括加厚的角质层等机械屏障和分泌化学物质,以防止菌丝侵入表皮[24]。已有的研究报道表明,EARLI1和AZI1对真菌病原体及酿酒酵母的生长有明显的抑制作用[16-17],AZI1基因在系统性获得抗性的信号传递过程中具有功能[11]。AtELHYPRP2基因与EARLI1、AZI1基因属于同一亚家族,本研究对烟草中与 SAR有关的基因进行表达分析,发现组成性表达AtELHYPRP2-GFP基因能够在本底水平上提高烟草PR1基因的表达量。在真菌诱导后,转基因烟草中PR1和PR5基因的系统表达水平要比野生型烟草高,说明AtELHYPRP2基因参与了 SAR。另外,本实验室还制备了以 Col-0为背景的AtELHYPRP2基因拟南芥过表达株系和RNA干扰株系,并且已经筛选出该基因的 T-DNA插入突变体,发现AtELHYPRP2基因在拟南芥局部和系统抗性中均具有一定的功能。利用GFP标签可以对蛋白质的亚细胞定位特征进行研究,GFP荧光的产生说明在烟草中表达产生的AtELHYPRP2-GFP融合蛋白能够正确折叠。本文涉及的在烟草中的实验结果说明该基因具有抗菌特征,并且显示带GFP标签的蛋白质是有功能的。
在植物遗传转化实验中,常用的报告基因有 β-葡萄糖醛酸酶 GUS基因和荧光素酶 LUC基因。大多数植物种类都没有背景GUS活性,4-甲基伞形酮-D-葡糖苷酸经 GUS水解产生的4-甲基伞形酮可以在365 nm激发光作用下发出455 nm波长的荧光,很容易对基因的表达水平进行量化;另外,GUS切割X-Gluc的糖苷键之后,糖苷配基将氧化脱氢形成二聚体靛蓝色沉淀,可用于显示完整组织中基因的表达模式[25]。但是,GUS检测实验对植物细胞是有害的,材料不能存活。在体外添加荧光素的条件下,利用荧光素酶基因可通过视频成像系统观察基因的表达活性[26-27],但它的测量必须在黑暗条件下进行,这将影响植物的生理特性,还必须把底物导入到植物组织中。绿色荧光蛋白发出的荧光可以直接进行观察,不需要外源底物或辅助因子的参与,并且对植物没有毒害作用[28],它的应用范围已经超过了GUS和LUC。本研究利用GFP在转基因烟草中对AtELHYPRP2蛋白进行了亚细胞定位,发现它定位于细胞壁上。作为细胞表面蛋白,AtELHYPRP2可能会破坏病原体细胞,抑制病原性真菌孢子的萌发,激发植物防御系统,并通过产生活性氧来引发植物的超敏反应,阻止真菌病原体向健康组织扩散。AtELHYPRP2在系统性获得抗性信号传递方面是否起作用,可通过后续的野生型-转基因烟草的嫁接实验检测它的移动性加以确定。
[1]Guo L, Yang H, Zhang X, et al. Lipid transfer protein 3 as a target of MYB96 mediates freezing and drought stress in Arabidopsis. J Exp Bot, 2013,64(6): 1755−1767.
[2]Nieuwland J, Feron R, Huisman BAH, et al. Lipid transfer proteins enhance cell wall extension in tobacco. Plant Cell, 2005, 17(7): 2009−2019.
[3]Pagnussat L, Burbach C, Baluška F, et al. An extracellular lipid transfer protein is relocalized intracellularly during seed germination. J Exp Bot,2012, 63(18): 6555−6563.
[4]Kader JC. Lipid-transfer proteins in plants. Annu Rev Plant Physiol Plant Mol Biol, 1996, 47(1):627−654.
[5]Sterk P, Booij H, Schellekens GA, et al.Cell-specific expression of the carrot EP2 lipid transfer protein gene. Plant Cell, 1991, 3(9):907−921.
[6]Foster GD, Robinson SW, Blundell RP, et al. ABrassica napusmRNA encoding a protein homologous to phospholipid transfer proteins, is expressed specifically in the tapetum and developing microspores. Plant Sci, 1992, 84(2):187−192.
[7]José-Estanyol M, Gomis-Rüth FX, Puigdomènech P. The eight-cysteine motif, a versatile structure in plant proteins. Plant Physiol Biochem, 2004, 42(5):355−365.
[8]Blein JP, Coutos-Thévenot P, Marion D, et al.From elicitins to lipid-transfer proteins: a new insight in cell signalling involved in plant defence mechanisms. Trends Plant Sci, 2002, 7(7):293–296.
[9]Maldonado AM, Doerner P, Dixon RA, et al. A putative lipid transfer protein involved in systemic resistance signalling in Arabidopsis. Nature, 2002,419(6905): 399−403.
[10]Buhot N, Gomès E, Milat ML, et al. Modulation of the biological activity of a tobacco LTP1 by lipid complexation. Mol Biol Cell, 2004, 15(11):5047−5052.
[11]Jung HW, Tschaplinski TJ, Wang L, et al. Priming in systemic plant immunity. Science, 2009,324(5923): 89−91.
[12]Chanda B, Xia Y, Mandal MK, et al.Glycerol-3-phosphate is a critical mobile inducer of systemic immunity in plants. Nat Genet, 2011,43(5): 421−427.
[13]Zhang Y, Schläppi M. Cold responsive EARLI1 type HyPRPs improve freezing survival of yeast cells and form higher order complexes in plants.Planta, 2007, 227(1): 233−243.
[14]Arondel V, Vergnolle C, Cantrel C, et al. Lipid transfer proteins are encoded by a small multigene family inArabidopsis thaliana. Plant Sci, 2000,157(1): 1−12.
[15]Josè-Estanyol M, Puigdomènech P. Plant cell wall glycoproteins and their genes. Plant Physiol Biochem, 2000, 38(1/2): 97−108.
[16]Li L, Zhang C, Xu D, et al. Expression of recombinant EARLI1, a hybrid proline-rich protein ofArabidopsis, inEscherichia coliand its inhibition effect to the growth of fungal pathogens andSaccharomyces cerevisiae. Gene, 2012, 506(1):50−61.
[17]Zhang X, Xu ZY, Schläppi M, et al. The inhibition function ofArabidopsisAZI1 gene to the growth ofSaccharomyces cerevisiaeandBotrytis cinerea.Plant Physiol J, 2011, 47(1): 57−62 (in Chinese).
张欣, 徐之艳, Schlappi M, et al. 拟南芥 AZI1基因对酿酒酵母细胞生长和蒜薹灰霉菌侵染的抑制作用. 植物生理学报, 2011, 47(1): 57−62.
[18]Yu K, Soares JM, Mandal MK, et al. A feedback regulatory loop between G3P and lipid transfer proteins DIR1 and AZI1 mediates azelaic-acid-induced systemic immunity. Cell Reports, 2013, 3(4): 1266−1278.
[19]Ménard R, Alban S, de Ruffray P, et al. β-1,3 Glucan sulfate, but not β-1, 3 glucan, induces the salicylic acid signaling pathway in tobacco and Arabidopsis. Plant Cell, 2004, 16(11): 3020−3032.
[20]Flor HH. Current status of the gene-for-gene concept. Annu Rev Phytopathol, 1971, 9(1): 275−296.
[21]Wang CF, Huang LL, Buchenauer H, et al.Histochemical studies O2-and H2O2on the accumulation of reactive oxygen species in the incompatible and compatible interaction of wheat-Puccinia striiformisf. sp.tritici. Physiol Mol Plant Pathol, 2007, 71(4/6): 230−239.
[22]Lamb C, Dixon RA. The oxidative burst in plant disease resistance. Annu Rev Plant Physiol Plant Mol Biol, 1997, 48(1): 251−275.
[23]Osbourn AE. Preformed antimicrobial compounds and plant defense against fungal attack. Plant Cell,1996, 8(10): 1821−1831.
[24]Grayer RJ, Kokubun T. Plant-fungal interactions:the search for phytoalexins and other antifungal compounds from higher plants. Phytochemistry,2001, 56(3): 253−263.
[25]Jefferson RA, Kavanagh TA, Bevan MW. GUS fusions: beta-glucuronidase as a sensitive and versatile gene fusion marker in higher plants.EMBO J, 1987, 6(13): 3901−3907.
[26]Marsh JL, Erfle M, Wykes EJ. The pIC plasmid and phage vectors with versatile cloning sites for recombinant selection by insertional inactivation.Gene, 1984, 32(3): 481−485.
[27]Millar AJ, Carré IA, Strayer CA, et al. Circadian clock mutants in Arabidopsis identified by luciferase imaging. Science, 1995, 267(5201):1161−1163.
[28]Quaedvlieg NEM, Schlaman HRM, Admiraal PC,et al. Fusions between green fluorescent protein andβ-glucuronidase as sensitive and vital bifunctional reporters in plants. Plant Mol Biol,1998, 38(5): 861−873.

