12种兽药中非法添加甲氧苄啶的HPLC-PDA检查方法的建立
周红霞,杜丹丹,王颖,李慧素,吴宁鹏∗
(1.河南省兽药监察所,郑州450008;2.郑州百瑞动物药业有限公司,郑州450000)
12种兽药中非法添加甲氧苄啶的HPLC-PDA检查方法的建立
周红霞1,杜丹丹2,王颖2,李慧素1,吴宁鹏1∗
(1.河南省兽药监察所,郑州450008;2.郑州百瑞动物药业有限公司,郑州450000)
采用十八烷基键合硅胶为填充剂,以0.02 mol/L磷酸二氢钾溶液-甲醇(73∶27,V/V)为流动相,建立了测定12种兽药中非法添加甲氧苄啶的HPLC-PDA法,并采用峰纯度检查和光谱相似度检查辅助对照品比对方法,对非法添加药物进行确证。在此液相条件下,对7种兽药粉散剂和5种注射液药物,进行添加回收试验和检测限的测定。结果显示,甲氧苄啶在粉剂中三个浓度(1%、5%、10%)添加回收率为74.6%~115.0%,RSD为0.1%~7.6%,在注射液中三个浓度(0.5%、1%、2%)的添加回收率为87.0%~119.7%,RSD为0.9%~4.1%。甲氧苄啶在各制剂中的检测限为0.5 mg/g(0.25 mg/mL)。改变试验条件后对峰纯度指示、光谱相似度进行考察,仍能满足要求。
甲氧苄啶;峰纯度检查;光谱相似度检查;高效液相色谱-二极管阵列检测
甲氧苄啶(Trimethoprim,TMP)是一种常用抗菌药,对多种革兰氏阳性和阴性细菌有抗菌作用,有抑制二氢叶酸还原酶的作用,为磺胺增效剂,主要与磺胺类制剂组成复方制剂,用于扩大抗菌谱,增强抗菌活性,在临床上广泛应用[1]。一些不法企业常违规在其他药剂中添加甲氧苄啶,以得到增效作用,实际上不但没有起到增效作用,反而会使动物产生耐药性,同时,长期大剂量的使用本品会对动物产生致畸作用,其在动物体内的残留,也会给人类的健康带来危害[2]。为了打击非法添加行为,为使用过程中甲氧苄啶的监控提供可靠依据,建立兽药中非法添加甲氧苄啶的检查方法,显得尤为重要。农业部公告2508号公布了仅硫酸庆大霉素注射液一种制剂中非法添加甲氧苄啶的检查方法[3],本研究建立了盐酸多西环素可溶性粉、磷酸泰乐菌素预混剂、替米考星预混剂及喹诺酮类制剂等共12种兽药制剂中非法添加甲氧苄啶的HPLC-PDA检测方法。
1 材料与方法
1.1 材料
1.1.1 对照品来源 甲氧苄啶对照品,含量100.0%,批号H0160704,中国兽医药品监察所提供。
1.1.2 样品来源 盐酸多西环素可溶性粉、磷酸泰乐菌素预混剂、替米考星预混剂、喹诺酮类制剂等12种制剂,均来市售产品,经检测均不含甲氧苄啶。
1.1.3 试剂 甲醇,色谱纯;磷酸二氢钾,分析纯;纯化水,实验室MILLIPORE超纯水仪自制。
1.1.4 仪器设备 高效液相色谱仪(Waters2695,PDA,Empower2色谱工作站软件);MILIPORE超纯水器;METTLER XP205电子分析天平;超声波清洗器:KQ-3200E型;1 mL注射器。
1.2 方法
1.2.1 阴性空白溶液配制 精密称取(量取)阴性样品约1.0 g(或2.0 mL),置50 mL容量瓶中,加流动相适量,超声10 min,静置,用流动相稀释至刻度,摇匀。精密量取5.0 mL,置50 mL容量瓶中,用流动相稀释至刻度,摇匀,备用。
1.2.2 对照品溶液的制备 精密称取甲氧苄啶对照品25 mg,于50 mL容量瓶中,加甲醇溶解,并定容至刻度,摇匀,得到500 μg/mL的标准储备液,精密量取标准储备液,用流动相分别稀释制成1、2、5、10、20、50、100、200、500 μg/mL的标准系列工作溶液,置4℃冰箱中保存。
1.2.3 色谱条件 参照文献[4]色谱柱Waters Xbridge C18(4.6×150 mm,3.5 μm);流动相:甲醇-0.02 mol/L磷酸二氢钾(27∶73);二极管阵列(PDA)检测器,采集波长范围为200~400 nm,分辨率为1.2 nm;记录270 nm波长处的色谱图;柱温30℃;进样量10 μL。
1.2.4 标准曲线 按照1.2.3项色谱条件,依法测定1.2.2项下系列标准工作溶液,以峰面积(y)对浓度(x)进行线性回归。
1.2.5 回收率试验 参照文献[5]精密称取甲氧苄啶原料10、50、100 mg各3份,分别置50 mL容量瓶中,加入1 g供试品,混匀,加适量流动相溶解,超声约10 min,静置,定容至刻度;从上述溶液中精密量取5 mL,置50 mL容量瓶中,加流动相稀释,定容摇匀,得相当于甲氧苄啶20、100、200 μg/mL浓度添加水平的溶液,精密量取10 μL,注入液相色谱仪,按照1.2.3项下液相条件记录色谱图。(粉剂及预混剂按照上述方法操作,注射液略有不同,各取2 mL空白注射液制剂,甲氧苄啶原料添加量为10、20、40 mg各3份,得相当于甲氧苄啶20、40、80 μg/mL浓度的3个添加水平,其他操作相同。)
1.2.6 专属性试验 按1.2.3项下色谱条件,分别对甲氧苄啶对照品溶液、供试品(添加甲氧苄啶)溶液和阴性空白溶液进行测定。
1.2.7 检测限 精密称取制剂1 g(或精密量取注射液2 mL),分别精密加入1.2.2项下的甲氧苄啶对照品溶液适量,制成系列添加浓度0.1、0.25、0.5、1、2、5、10、20 μg/mL。精密量取10 μL,注入液相色谱仪,按照1.2.3项下液相条件记录色谱图。依法测定。光谱图失真前的浓度为该测试药物的检测限[6]。
1.2.8 耐用性试验 改变柱温为25、30、35℃;改变流动相比例分别为80∶20、75∶25、70∶30;改变流速分别为0.4、0.6、0.8 mL/min;选择不同品牌色谱柱(Waters SunfireTMC18(4.6×250 mm,5 μm);Agilent XORBA SB-C18(3.0×250 mm,5 μm);SHIMADZU VP(4.6×150 mm,5 μm);Waters Xbridge C18(4.6×150 mm,5 μm),对其峰型、分离度、峰纯度指示、出峰时间进行考察。
2 结果与分析
2.1 峰纯度检查 对供试品溶液色谱图中甲氧苄啶峰进行峰纯度检查[6],结果见图1、图2。结果显示,甲氧苄啶的纯度角度小于纯度阈值(图2、表1),表明在此液相条件下,甲氧苄啶的出峰处无其他干扰峰,为单一物质峰,方法可行。

图1 供试品(磷酸泰乐菌素预混剂)添加甲氧苄啶光谱图及色谱图
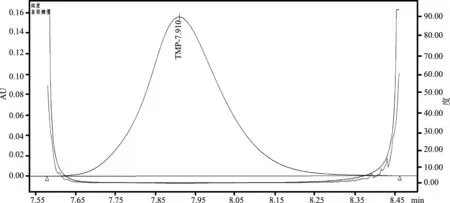
图2 供试品(磷酸泰乐菌素预混剂)添加甲氧苄啶纯度检查图
2.2 光谱相似度检查 对供试品溶液中甲氧苄啶的光谱图与光谱库进行匹配,匹配角度小于匹配阈值(表1),表明供试品溶液中相应色谱峰的光谱与甲氧苄啶对照品的光谱非常相似,可认为是同一物质。
2.3 专属性考察 通过供试品空白试验排除对于被测物的干扰,以甲磺酸培氟沙星可溶性粉为例,结果表明在甲氧苄啶出峰处无干扰(图3、图4)。

表1 峰纯度检查结果表
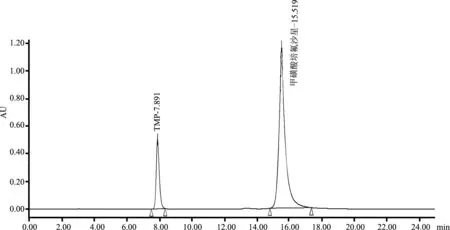
图3 添加样品色谱图

图4 空白基质(样品和试剂)色谱图
同时,峰纯度检查结果显示在此液相条件下,甲氧苄啶为单一物质峰。峰纯度检查:甲氧苄啶色谱峰光谱均匀,纯度较高,可认为单一物质。光谱相似度检查:供试品溶液甲氧苄啶色谱峰与光谱图中甲氧苄啶对照品的光谱匹配。
2.4 标准曲线与线性范围 将1.2.2项中标准系列工作液进行测定,以峰面积(y)对浓度(x)进行线性回归,甲氧苄啶的回归方程Y=21525X+3002.8和相关系数r为0.9999。结果表明:甲氧苄啶在1~500 μg/mL的浓度范围内线性关系良好。
2.5 回收率试验 考虑到本试验中甲氧苄啶对照品使用量较大,本试验用符合纯度要求的兽药原料药代替对照品进行添加试验,即在阴性空白样中分别添加甲氧苄啶原料药,共添加3个浓度,通过试验结果获得回收率及相对标准偏差。该方法中粉剂、预混剂中添加甲氧苄啶的回收率为74.6%~115.0%,RSD为0.1%~7.6%;注射液中添加甲氧苄啶的回收率为87.0%~119.7%,RSD为0.9%~4.1%。说明该检测方法可靠,添加回收结果见表2、表3。
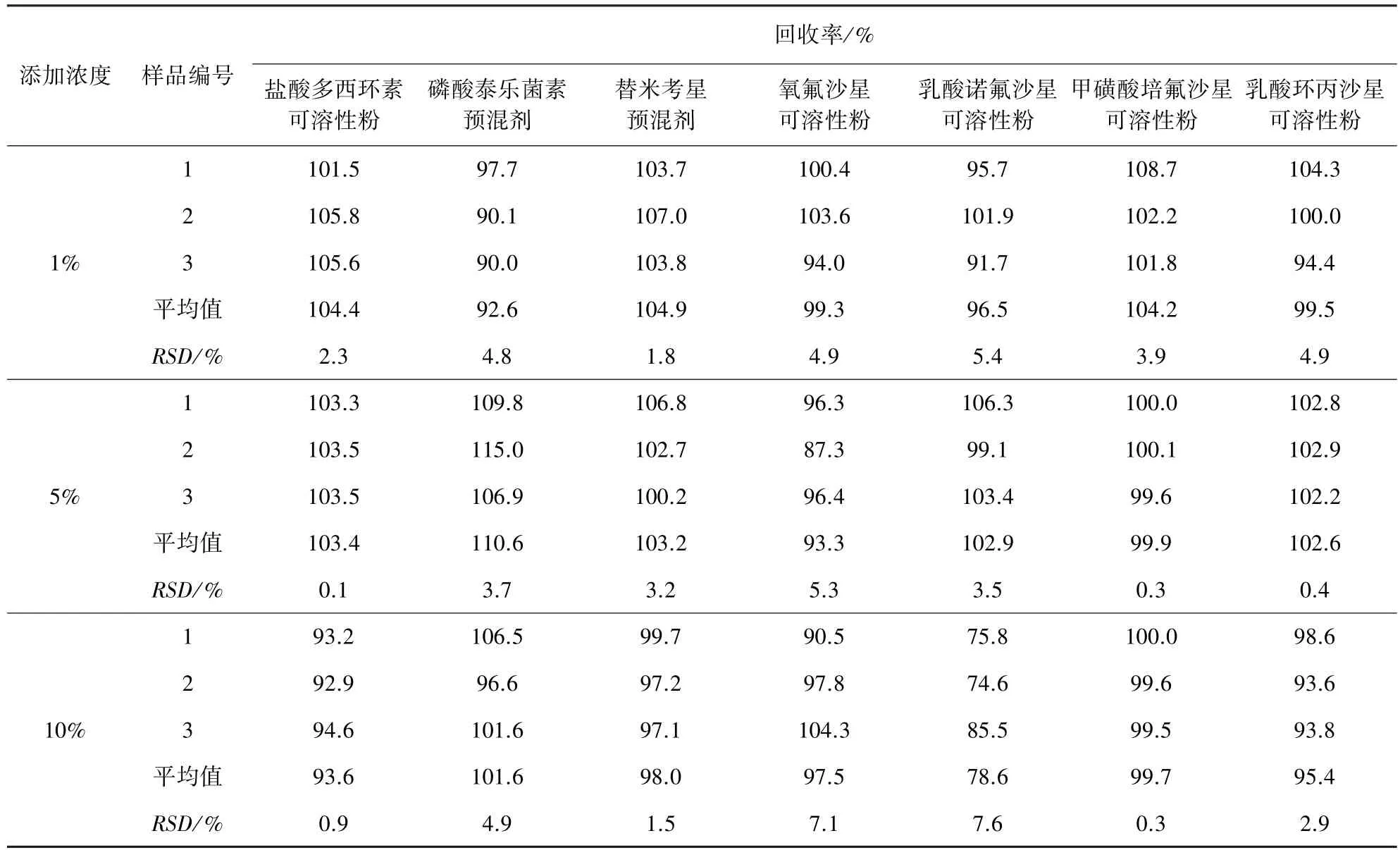
表2 兽药粉剂、预混剂中添加甲氧苄啶回收率试验结果
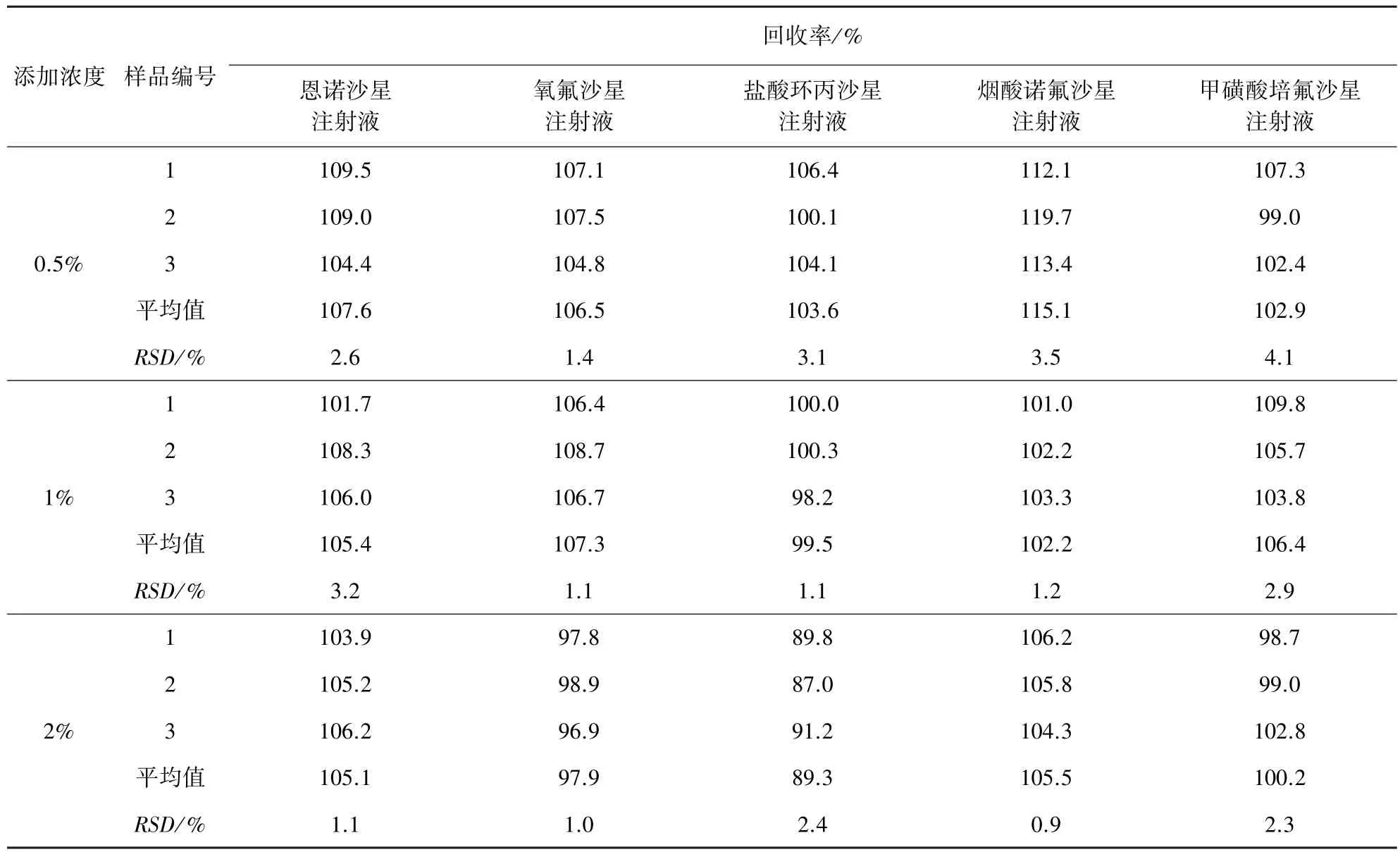
表3 兽药注射液中添加甲氧苄啶回收率试验结果
2.6 检测限 综合考虑色谱图峰型、峰面积和甲氧苄啶有效浓度等因素,结果表明,浓度为0.5 μg/mL,光谱图失真;浓度为1 μg/mL,光谱图不失真。以光谱图失真前的浓度作为方法的检测限,供试品中甲氧苄啶的检测限分别为0.5 mg/g(粉散剂)、0.25 mg/mL(注射液)(图5)。

图5 添加甲氧苄啶浓度为1 μg/mL的光谱图及色谱图
2.7 耐用性 柱温、流动相比例、流速、色谱柱的改变对分离度、峰纯度指示、光谱相似度的考察结果显示,能够满足要求,只是保留时间变化。甲氧苄啶保留时间受柱温影响较小,随柱温升高,保留时间略提前;结果显示随流动相有机相比例的增加,甲氧苄啶保留时间缩短;随着流速的增加,保留时间明显提前;4款不同品牌色谱柱均可用于该检查,仅保留时间不同,方法耐用性较好。
3 讨论
3.1 检测波长的选择 利用二极管阵列检测器,在200~400 nm波长范围内进行紫外吸收图谱扫描,甲氧苄啶在203、270 nm波长处有最大吸收。考虑到200 nm附近有“末端吸收”,而且在液相色谱分离中常用的溶剂如甲醇、乙腈等在此波长下有紫外吸收;对本文所选的12种兽药制剂进行紫外扫描发现,在270 nm附近均不会产生干扰作用,故选择270 nm为测定波长。
3.2 流动相的选择 相关文献资料报道[3,7-9]使用的流动相有:乙腈-0.0174 mol/L磷酸溶液(20∶80),甲醇-0.02 mol/L磷酸二氢钾溶液(30∶70),甲醇-0.1 mol/L磷酸二氢钾溶液(pH为2.5)(30∶70),考虑甲氧苄啶的稳定性、出峰时间是否漂移、峰型是否对称等,含有磷酸溶液的流动相,甲氧苄啶主峰随着时间的延长向前漂移,不稳定,最终确定流动相为甲醇:0.02 mol/L磷酸二氢钾溶液,并对流动相比例进行考察,以出峰时间、色谱峰宽以及干扰基质的分离情况等作为考察点,通过试验,最终确定流动相比例为甲醇-0.02 mol/L磷酸二氢钾溶液(27∶73)。
3.3 稀释液的选择 参考《中华人民共和国兽药典》(2010年版)甲氧苄啶的测定方法,根据甲氧苄啶的溶解性:在三氯甲烷中略溶,在乙醇或丙酮中微溶,在水中几乎不溶,在冰醋酸中易溶解[10],本次试验比较了多种稀释液溶剂系,发现乙腈、甲醇、不同比例的甲醇水和乙腈水、流动相进行溶解时,采用流动相进行稀释,甲氧苄啶峰型对称,无杂质峰的干扰,最终确定流动相为溶媒。
3.4 回收试验的影响因素 本试验中,乳酸诺氟沙星可溶性粉的添加浓度为10%时,回收率相对偏低,其主要原因是样品处理过程中采用超声溶解,会出现乳化现象,可能使得目标分析物没有完全地溶解,从而造成回收率偏低。烟酸诺氟沙星注射液的添加浓度为0.5%时,回收率相对偏高,最高可达119.7%,主要原因可能为称样量较小(10 mg左右),天平读数波动较大,造成回收率结果偏高。
欧洲联盟对于动物性食品中兽药的使用有着严格的调节控制,对抗生素、促生长剂、抗菌药物(如甲氧苄啶)等兽药的最大残留量进行检测和控制时,采用高效液相-串联质谱技术(LC-MS)[11-12]对抗菌药物中甲氧苄啶进行测定。我国农业部公告2508号中对11个兽药非法添加化学药物的检测方法[3],采用高效液相色谱法(HPLC-UV)对甲氧苄啶进行测定。本研究建立的对12种制剂中非法添加甲氧苄啶药物的检测方法,为国内首个建立的对甲氧苄啶药物监测的HPLC-PDA法,该方法操作简便,具有高效高分离度的特点,具有很高的参考应用价值。
4 结论
本试验采用高效液相色谱法结合二极管阵列检测器,通过对稀释液、波长以及流动相的考察,建立了兽药中非法添加甲氧苄啶的HPLC-PDA检测方法,该检测方法实现了添加药物与其他物质峰的色谱分离,经峰纯度检查确保添加药物出峰处无干扰,同时该方法较稳定、准确、重现性好,可用于其他兽药中非法添加甲氧苄啶的检测,具有较高的实用价值。
[1] 王荭晖.中成药非法添加化学药物研究进展[J].安徽医药,2011,15(9):1168.
[2] 宋慧敏,毕昊容,邵德佳,等.兽药粉剂/预混剂中甲氧苄啶的测定[J].中国兽药杂志,2007,41(1):33-35.
[3] 中华人民共和国农业部公告第2508号.硫酸庆大霉素注射液中非法添加甲氧苄啶检查方法[S].
[4] 郭时金,沈志强,张志美,等.HPLC法检测磺胺间甲氧嘧啶钠和甲氧苄啶方法的研究[J].家畜生态学报,2010,31(4):73-76.
[5] 高秀蕊,王秀萍.HPLC测定复方头孢氨苄中的头孢氨苄和甲氧苄啶含量方法的改进[J].中国抗生素杂志,2004,29(11):694-696.
[6] 董玲玲,范强.氟苯尼考粉中非法添加烟酰胺和氨茶碱的HPLC-PDA检测方法的建立[J].中国兽药杂志,2014,48(5):47-50.
[7] 岳莉,赵万晴.高效液相色谱法测定甲氧苄啶片的含量[J].安徽医药,2010,14(3):288-289.
[8] 王宝佳,邱洪,王福兰,等.高效液相色谱法测定复方四环素片中甲氧苄啶含量[J].中国药业,2008,17(21):29-30.
[9] 朱晓华,翁棋兰,王静,等.高效液相色谱同时检测鱼肉组织中4种磺胺与甲氧苄啶的残留量[J].南京农业大学学报,2009,32(4):138-142.
[10]中国兽药典委员会.中华人民共和国兽药典(一部)[M].北京:中国农业出版社,2010.
[11]A.A.M.Stolker,T.Zuidema,M.W.F Nielen.Residue analysis of veterinary drugs and growth-promoting agents[J].Trends in Analytical Chemistry,2007,26(10):967-979.
[12]Lglesias A.Detection and quantitative analysis of 21 veterinary drugs in river water ueing high-pressure liquid chromatography coupled to tandem mass spectrometry[J].Envion Sci PollutRes Int,2012,19(8):3235-3249.
(编辑:侯向辉)
Determination of Trimethoprim in the 12 Kinds of Verterinary Drugs by HPLC-PDA
ZHOU Hong-xia1,DU Dan-dan2,WANG Ying2,LI Hui-su1,WU Ning-peng1∗
(1.Henan Institute of Veterinary Drug Control,Zhengzhou 450008,China;2.Zhengzhou Bairui Animal Pharmaceutical Co Ltd,Zhengzhou 450000,China)
C18 column was used,mobile phase was phosphate buffer and methnol(73∶27,V/V),and established a method for determination of trimethoprim in the 12 kinds of veterinary drugs by HPLC-PDA.Peak purity test and spectrum similar test were helped to identify the trimethoprim.Under this liquid condition,the test of added recycling,the determination of detection limit were operated.Results showed that the added recycling rate of TMP in the veterinary powder under three levels(1%,5%,10%)were 74.6%~115.0%,the RSD were 0.1%~7.6%.and injection under three levels(0.5%,1%,2%)were 87.0%~119.7%,the RSD were 0.9%~4.1%.Detection limit of trimethoprim in the preparation has got by this method was 0.5 mg/g(0.25 mg/mL).Changing the test conditions,the purity test,spectral similarity can meet the requirements.
trimethoprim;peak purity test;spectrum similar test;HPLC-PDA
2014-07-28
A
1002-1280(2014)11-0043-06
S859.83
周红霞,研究员,从事兽药质量监测与监督。
吴宁鹏。E-mail:wnppeking2002@163.com

