长链脂肪酸通过GPR120 对脂肪细胞炎症、内质网应激及胰岛素信号分子的影响
代 喆,季振中,徐焱成⋆
(1.武汉大学中南医院 内分泌科,湖北武汉 430071;2.武汉大学中南医院 综合科,湖北武汉 430071)
近年来,中国糖尿病发生率迅速增高,与肥胖的发生率升高密不可分[1]。 生活方式和饮食结构的改变是超重和肥胖的主要危险因素[2,3]。2010 年最新研究表明, 中国糖尿病患病率达到了9.7%,糖尿病前期患病率达到15.2%。 超重、肥胖、中心性肥胖和升高的甘油三酯水平都是糖尿病及糖尿病前期患病率增加的主要危险因素[4]。
肥胖状态下, 过度增大的脂肪细胞因其储存甘油三酯的能力已经饱和,由于“溢出效应”对于胰岛素的抑制脂解作用不能有效应答, 发生了胰岛素抵抗[5],诱发了糖尿病的发生发展。 近年来,脂肪酸受体蛋白备受研究者的关注。 G 蛋白受体(G protein receptor,GPR120) 是最近发现的一种细胞膜脂肪酸受体蛋白[6],是长链脂肪酸的特异性受体[7]。 GPR120 敲除的高脂饮食小鼠易肥胖,且并发肥胖引起的炎症状态、胰岛素抵抗、糖耐量异常、 脂肪肝等一系列病理生理异常[8]。GPR120 是如何介导和调节长链脂肪酸对胰岛素信号通路的影响目前还不清楚。 本研究拟从细胞学层面对其机制进行初步阐释。
1 材料与方法
1.1 脂肪组织的选取
选取5 例择期行胆结石胆囊手术的患者的大网膜脂肪组织约20g, 均签署知情同意书, 男3例、女2 例;年龄47.3±6.2 岁。BMI 25.2±3.9kg/m2,空 腹 血 糖5.1±0.4mmol/L,TC 5.6±0.9mmol/L,TG 2.5 ±0.7mmol/L,LDL -C 4.3 ±1.1mmol/L,HDL -C 0.8±0.2mmol/L。 患者排除肝肾功能不全、肿瘤、感染性疾病及其他内分泌疾病。
1.2 主要试剂
GPR120 特异性抑制剂GW9508、PA 及二十二碳六烯酸(docosahexaenoic acid,DHA)购自美国Sigma 公司;DMEM 培养基购自美国Gibco 公司; 胎牛血清购自杭州四季青公司;Trizol 购自美国Invitrogen 公司,RT-PCR 试剂盒,DNA Marker及Protein Marker 购自日本Takara 公司; 抗人GPR120、FABP4、TNFα、p-eIF2α、 胰岛素信号通路蛋白IRS-1 及β-actin 抗体购自Santa 公司;Bradford 蛋白定量试剂盒购自上海碧云天公司,其他试剂为分析纯。
1.3 实验方法
1.3.1 成熟脂肪细胞的分离培养
参照已有的方法[9],将新鲜的内脏脂肪组织剪碎后, 加入含胶原酶和BSA 的缓冲液中,37℃震荡消化1h,轻轻搅拌将细胞打散。 将细胞悬液吸出后,400g 离心1min, 成熟的脂肪细胞会漂浮在上层,将上层成熟的脂肪细胞分离,并加入37℃白蛋白缓冲液400g 离心1min, 反复3 次后收获成熟脂肪细胞并放入含BSA10%的DMEM 培养基中进行培养。
1.3.2 研究分组
长链多不饱和脂肪酸DHA 研究分为4 组:(1)空白对照组;(2)100μmol/L DHA 作用组;(3)100μmol/L DHA+10μmol/L GW9508 作用组;(4)100μmol/L DHA+20μmol/L GW9508 作用组。长链饱和脂肪酸PA 研究分为4 组:(1) 空白对照组;(2)100μmol/L PA 作 用 组;(3)100μmol/L PA+10μmol/L GW9508 作 用 组;(4)100μmol/L PA+20μmol/L GW9508 作用组。 每组试验重复3 次。
1.3.3 实时定量PCR 检测
细胞干预培养24h 后吸出上清液,用PBS 洗2 次,Trizol 提取细胞样本的总RNA, 并逆转录成cDNA 置于-20℃保存。 实时定量PCR 在罗氏LC480 系统上进行,每个样本设3 个平行对照。各基因的引物分别为:eIF2α:上游5'-TCAGGGTGGTAAAGTATGT-3', 下游5'-GGATTGACTATGGTGGGT -3';FABP4: 上 游 5' -AGAGGATGATAAACTGGTGGTG -3',下游 5' -CGAACTTCAGTCCAGGTCAA-3';GPR120: 上游5'-AGCCACCCTGTGCCCTACCT-3', 下 游5'-GAGCCGTGATTGTGCCGTTG-3';IRS-1:上游5'-GAAGAAGTGGCGGCACAAGTCG-3', 下 游5'-CTGGTCAGGCAAAGGCGGTAGA-3';β-actin:上游5'-TGGCACCCAGCACAATGAA-3', 下游5'-CTAAGTCATAGTCCGCCTAGAAGCA-3'。 mRNA的表达水平由Ct 值确定, 并与相应的β-actin 的Ct 值比较,得出mRNA 的相对表达水平。
1.3.4 Western blot 法检测GPR120、FABP4、TNFα、p-eIF2α 及IRS-1 的蛋白表达水平
蛋白提取, 定量, 进行聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜,封闭,TBST 洗膜3 次,加入一抗4℃孵育过夜, 辣根过氧化物酶标记的二抗室温孵育1h,TBST 洗膜3 次,免疫印迹化学发光试剂盒曝光,显影,定影,分析。蛋白的相对表达水平,与相应的β-actin 蛋白表达水平比较得出。
1.3.5 统计学方法
应用SPSS17.0 统计软件进行统计学分析,组间比较采用t检验,多组间比较采用方差分析。
2 结果
2.1 长链多不饱和脂肪酸DHA 对脂肪酸受体及胰岛素信号通路的影响
表1 示,在DHA 的刺激下,与空白对照组相比,GPR120(P<0.01)和FABP4(P<0.01)的mRNA水平增加,TNFα (P<0.01) 和p-eIF2α (P<0.05)mRNA 水平下降,IRS1(P<0.05)mRNA 水平升高。加 入10μmol/L GW9508 后, 与DHA 组 相 比,GPR120(P<0.05)、FABP(P<0.05)和IRS1(P<0.05)mRNA 水平下降,TNFα(P<0.01)和p-eIF2α(P<0.01)mRNA 水平升高。 加入20μmol/L GW9508后,与DHA 组相比,GPR120,FABP 和IRS1mRNA水 平 均 显 著 下 降 (均P<0.01),TNFα 和peIF2αmRNA 水平显著升高(均P<0.01)。
在DHA 刺激下(图1A),GPR120、FABP4 的表达均增加 (均P<0.01),TNFα (P<0.01) 和peIF2α(P<0.05)表达下调,IRS1(P<0.05)表达上调。 加入GPR120 特异性抑制剂GW9508 后,GPR120(P<0.01)和FABP4(P<0.01)表达减少,伴随着TNFα(P<0.01)和p-eIF2α(P<0.01)表达较不加GPR120 抑制剂时上调,IRS1(P<0.05)表达下调。

表1 DHA 和GW9508 作用下相关蛋白表达的相对定量

表2 PA 和GW9508 作用下相关蛋白mRNA 表达的相对定量
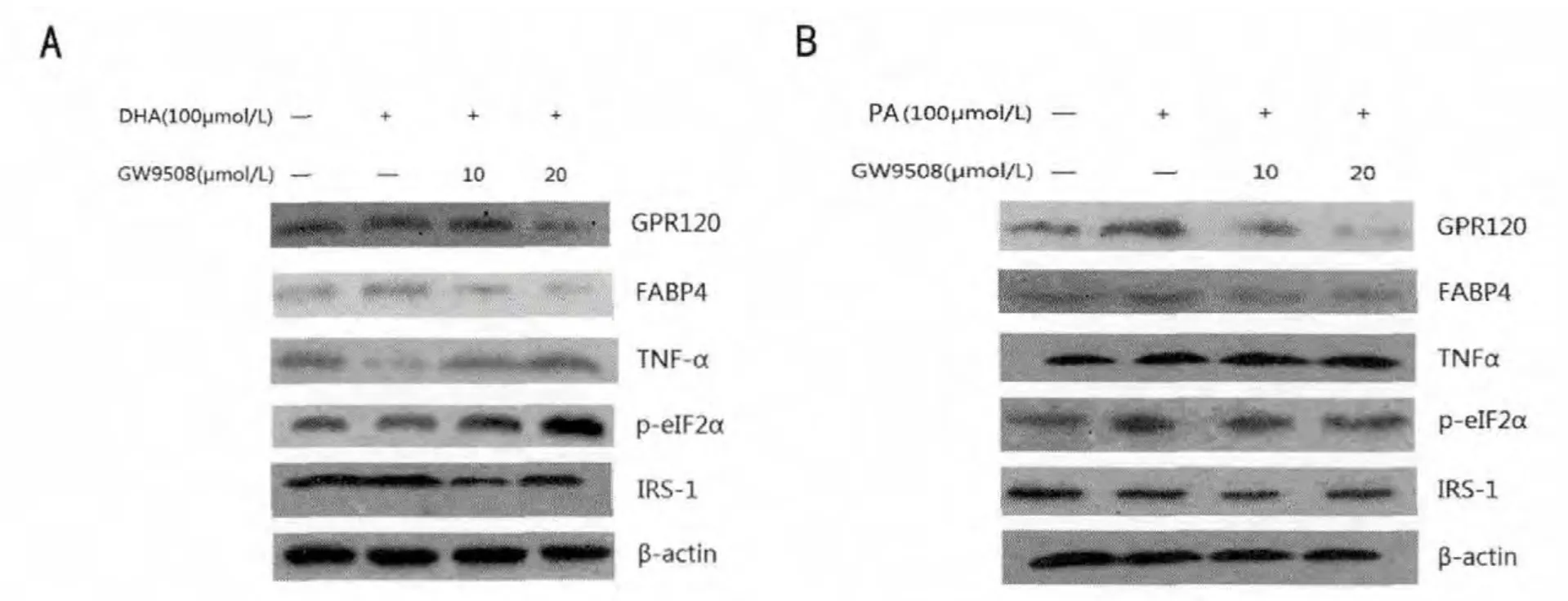
图1 人脂肪细胞分别在DHA、PA 作用下及合并不同浓度GPR120 抑制剂(GW9508)作用下相关蛋白的表达
2.2 长链多饱和脂肪酸PA 对脂肪酸受体及胰岛素信号通路的影响
表2 示, 在PA 的刺激下, 与空白对照组相比,GPR120(P<0.01)和FABP4(P<0.01)的mRNA水平增加,TNFα (P<0.05) 和p-eIF2α (P<0.01)mRNA 水平升高,IRS1(P<0.05)mRNA 水平下降。加 入10μmol/L GW9508 后, 与PA 组 相 比,GPR120(P<0.01)和FABP(P<0.01)水平下降,TNFα(P<0.05)和p-eIF2α(P<0.05)mRNA 水平升高。加 入20μmol/L GW9508 后, 与DHA 组相比,GPR120(P<0.01),FABP(P<0.01)和IRS1(P<0.05)mRNA 水平下降,TNFα(P<0.01)和p-eIF2α(P<0.05)mRNA 水平显著升高。
在PA 的刺激下(图1B),除TNFα(P<0.05)和p-eIF2α(P<0.01)表达上调、IRS1(P<0.05)表达下调外,其余结果与DHA 刺激下相同。
3 讨论
研究发现,脂肪酸不仅是一种营养物质,同样也可以作为一种信号分子, 通过多种方式参与炎症和内质网应激信号通路:(1)可以直接激活天然免疫系统受体Toll 样受体4(Toll-like receptor 4,TLR4),活化炎症通路[10];(2)可以被转运到脂肪细胞内后,通过与脂肪酸结合蛋白(FABPs)的结合,在细胞内发挥作用[11];(3)可以通过内质网应激通路发挥作用。另外,脂肪酸也在脂肪细胞中直接诱导内质网应激的发生[12]。 内质网应激可诱发炎症机制,并与其形成恶性循环,加重脂肪细胞功能失调。 软脂酸作为一种营养物中含量最丰富的饱和脂肪酸之一, 同时也是脂肪细胞脂解的产物和TLR4 受体的活化信号,激活炎症通路,促进炎症相关的胰岛素抵抗的发生发展[6]。 虽然ω3 不饱和脂肪酸DHA 对TLR4 无明显作用, 然而,DHA却可以完全抑制棕榈酸所诱导的TNFα 表达[6]。GPR120 受体在受到ω3 脂肪酸的刺激后,可以抑制LPS、TLR2、TLR3 和TNFα 在3T3-L1 和巨噬细胞中介导的炎症反应[13]。这些发现提示,脂肪组织在处理脂肪酸的信号和代谢时, 存在着平衡机制,脂肪酸受体作为脂肪酸作用的“守门人”,可能起到了重要作用。
本研究结果显示,DHA 作用于脂肪细胞时,如果GPR120 的表达受到抑制, 可降低胰岛素下游通路IRS1 的表达, 减弱其胰岛素增敏作用,TNFα 表达水平升高, 提示其抗炎症作用受到抑制;p-eIF2α 表达水平升高,提示抗内质网应激作用受到抑制。 相应的,在PA 作用于脂肪细胞时,如果GPR120 的表达受到抑制, 可增加其诱导炎症和内质网应激水平, 进一步加强致胰岛素抵抗的作用。已有研究发现,在脂肪细胞中GPR120 的减少会降低IRS1 和GLUT4 的表达水平[14]。
脂肪酸结合蛋白4(FABP4)是一种重要的脂肪酸结合蛋白,可以介导炎症、内质网应激、胰岛素抵抗等多种机制[15],并且,FABP4 与GPR120 具有一样的表达部位, 均表达于巨噬细胞和脂肪细胞;也具有一样的天然配体,中长链脂肪酸;并且在GPR120 表达下调时,FABP4 也表现出一致的变化[16,17]。 本研究结果显示, 在GPR120 的配体DHA 和PA 脂肪酸的刺激下,GPR120 和FABP4表现出一致的表达升高趋势, 而在GPR120 的表达受到抑制后,GPR120 和FABP4 表现出下降趋势,进一步提示了两者可能存在协同作用。
GPR120 在巨噬细胞功能异常中的调控作用也不容忽视。研究提示,脂肪细胞和巨噬细胞共存的状态下,受到相同的刺激时,所分泌的炎症因子水平明显大于单一细胞[10]。这种对话机制的放大,可以进一步通过内分泌的方式对全身组织器官产生影响,促进了胰岛素抵抗的发生发展。在脂肪组织中,GPR120 同时在脂肪细胞和巨噬细胞上都有表达。与瘦型人群相比,肥胖人群的脂肪组织中GPR120 的表达水平也更高[15]。 当巨噬细胞GPR120 的表达减少时,DHA 的抗炎症反应也会减弱[14]。 GPR120 还介导了ω3 脂肪酸在巨噬细胞中对NLRP3 炎症小体及其下游的caspase1 的抑制及对IL-1 分泌的抑制[18]。 除了在脂肪组织中,GPR120 还大量分布于小肠、味蕾和肺,新近的研究发现,GPR120 在人类和大鼠的胰腺中有表达,主要分布于巨噬细胞和间质细胞[19]。 目前相关的治疗药物也在进一步探索中[20]。
[1] Wang Y,Mi J,Shan XY,et al.Is China facing an obesity epidemic and the consequences? The trends in obesity and chronic disease in China[J].Int J Obes (Lond),2007,31(1):177-188.
[2] Reynolds K,Gu D,Whelton PK,et al.InterASIA Collaborative Group.Prevalence and risk factors of overweight and obesity in China[J].Obesity (Silver Spring),2007,15(1):10-18.
[3] Barry M.Popkin.Will China’s nutrition transition overwhelm its health care system and slow economic growth?[J].Health Affairs,2008,27(4):1064-1076.
[4] Yang W,Lu J,Weng J,et al.China National Diabetes and Metabolic Disorders Study Group.Prevalence of diabetes among men and women in China [J].N Engl J Med,2010,362(12):1090-1101.
[5] Frayn KN.Obesity and metabolic disease:is adipose tissue the culprit?[J].Proc Nutr Soc,2005,64 (1):7-13.
[6] Hirasawa A,Tsumaya K,Awaji T,et al.Free fatty acids regulate gut incretin glucagon-like peptide-1 secretion through GPR120[J].Nat Med,2005,11(1):90-94.
[7] Cartoni C,Yasumatsu K,Ohkuri T,et al.Taste preference for fatty acids is mediated by GPR40 and GPR120 [J].J Neurosci,2010,30(25):8376-8382.
[8] Ichimura A,Hirasawa A,Poulai n-Godefroy O,et al.Dysfunction of lipid sensor GPR120 leads to obesity in both mouse and human[J].Nature,2012,483(7389):350-354.
[9] Carswell KA,Lee MJ,Fried SK.Culture of isolated human adipocytes and isolated adipose tissue [J].Methods Mol Biol,2012,806:203-214.
[10] Shi H,Kokoeva MV,Inouye K,et al.TLR4 links innate immunity and fatty acid-induced insulin resistance [J].J Clin Invest,2006,116(11):3015-3025.
[11] Furuhashi M,Hotamisligil GS.Fatty acid-binding proteins:role in metabolic diseases and potential as drug targets[J].Nat Rev Drug Discov,2008,7(6):489-503.
[12] Jiao P,Ma J,Feng B,et al.FFA-induced adipocyte inflammation and insulin resistance: involvement of ERstress and IKKbeta pathways [J].Obesity (Silver Spring),2011,19(3):483-491.
[13] Oh DY,Talukdar S,Bae EJ,et al.GPR120 is an omega-3 fatty acid receptor mediating potent anti-inflammatory and insulin-sensitizing effects[J].Cell,2010,142(5):687-698.
[14] Li X,Yu Y,Funk CD.Cyclooxygenase -2 induction in macrophages is modulated by docosahexaenoic acid via interactions with free fatty acid receptor 4 (FFA4)[J].FASEB J,2013,27(12):4987-4997.
[15] Furuhashi M,Fucho R,Gorgün CZ,et al.Adipocyte/macrophage fatty acid -binding proteins contribute to metabolic deterioration through actions in both macrophages and adipocytes in mice[J].J Clin Invest,2008,118(7):2640-2650.
[16] Gotoh C,Hong YH,Iga T,et al.The regulation of adipogenesis through GPR120 [J].Biochem Biophys Res Commun,2007,354(2):591-597.
[17] Ichimura A,Hirasawa A,Hara T,et al.Free fatty acid receptors act as nutrient sensors to regulate energy homeostasis [J].Prostaglandins Other Lipid Mediat,2009,89 (3-4):82-88.
[18] Yan Y,Jiang W,Spinetti T,et al.Omega-3 fatty acids prevent inflammation and metabolic disorder through inhibition of NLRP3 inflammasome activation [J].Immunity,2013,38(6):1154-1163.
[19] Zhao Y,Zha D,Wang L,et al.Phenotypic characterization of GPR120-expressing cells in the interstitial tissue of pancreas[J].Tissue Cell,2013,45(6):421-427.
[20] Hudson BD,Shimpukade B,Mackenzie AE,et al.The pharmacology of TUG-891,a potent and selective agonist of the free fatty acid receptor 4(FFA4/GPR120),demonstrates both potential opportunity and possible challenges to therapeutic agonism[J].Mol Pharmacol,2013,84(5):710-725.

