微创治疗高血压脑出血术后并发症临床分析*
赵 展 张 威 卓礼霞 殷利明 钟德泉 王文涛 徐伟光
(广东药学院附属第一医院,广东 广州 510080)
高血压脑出血是临床常见急症之一,有很高致死率和致残率,随着人类寿命的延长,以及物质生活水平的提高,高血压脑出血发病率日益增高,并且发病年龄有逐渐下降的趋势,严重危害人们的身体健康,给社会和家庭带来沉重的负担。随着医生对此病的认识的不断提高以及手术技术和微创手术的应用,高血压脑出血手术死亡率已明显下降[1]。但是微创手术后仍然有一些并发症发生,影响高血压性脑出血患者的预后,我科在2006年6月至2013年6月开展高血压脑出血颅内血肿微创清除术152例,分别采用钻孔引流以及小骨窗开颅,我们对手术后发生的并发症进行分析,现总结如下。
1 资料与方法
1.1临床资料
152例病例都符合1995年中华医学会第4次全国脑血管病学术会议修订的脑出血病的诊断要点[2],既往均有高血压病史。我们依据患者家属的意愿以及患者具体病情,把高血压脑出血颅内血肿微创清除术分为两组:钻孔引流组(88 例)和小骨窗开颅组(64 例)。两组患者一般资料在性别、年龄、出血部位、出血量、GCS 评分等方面差异无统计学意义(P>0.05),具有可比性,详见表1。
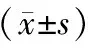
表1 两组患者手术前的一般资料对比
1.2手术方法
①钻孔引流组:手术前根据头颅CT或者MR片明确出血部位,避开重要血管丰富区及重要功能区,选择距血肿中心较近的部位做头皮切口并钻孔,依据定位用带针芯的引流管缓慢向预定的靶点穿刺,穿刺血肿成功多有突破感,达到预定的深度后拔除针芯,这时可见有部分血肿引出,用注射器缓慢抽吸血肿液态部分,然后固定引流管于头皮,术后血肿腔内注入2~3万u尿激酶引流残余血肿,每天2~3次,依据复查颅内血肿情况择时拔管。②小骨窗开颅组:取患侧颞部或者靠近皮层血肿部位做直切口,钻骨孔后扩大骨窗直径至2.5~3.0 cm,先行血肿穿刺,缓慢吸出部分血肿减压,顺穿刺方向或者皮层血肿破口切开皮层,逐渐进入血肿腔,显微镜下小心清除大部分凝血块,不处理血肿壁,发现出血点时予电凝止血,生理盐水冲洗清亮后血肿腔置引流管外引流,常规关颅,手术后依据头颅CT复查血肿的情况,决定是否使用尿激酶以及择时拔管。
1.3术后处理
两组患者术后都给予常规处理,加强支持治疗,使用抗生素预防感染,纠正水电解质紊乱,预防消化道出血及其他并发症,出现并发症予积极处理。
1.4统计学处理
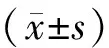
2 结 果
2.1两组微创手术治疗高血压脑出血术后相关并发症(包括一个患者出现一个或者数个并发症)的统计结果及分析。 两组比较,钻孔引流组发生颅内再出血大于小骨窗开颅组(P<0.05),小骨窗开颅组发生颅内积气大于钻孔引流组(P<0.05),皆有统计学意义。而在手术后发生肺炎、电解质紊乱、消化道出血、颅内感染、急性肾损伤、泌尿系感染诸方面方面差异无统计学意义(P>0.05),详见表2。

表2 两组微创治疗高血压脑出血术后相关并发症比较[n(%)]
2.2成功救治144例,成功率为94.74%,其中植物生存状态10例。死亡8例,死亡率为5.26%,其中包括再出血3例,肺部感染2例,全身衰竭2例,颅内感染1例。
3 讨 论
3.1肺部感染
肺部感染是高血压脑出血微创手术后最常见的并发症,国内有报道微创颅内血肿清除术后肺部感染率为23.71%[3],在本次研究中,两组病例发病率没有明显区别,平均为21.05%。脑出血手术后肺部感染与患者基础疾病密切相关,高龄、既往有肺部疾病史、出血量大、多部位出血及出血破入脑室的患者,更易发生院内肺部感染[3]。手术后患者大多长期卧床,有不同程度的意识障碍或呈现昏迷状态,抵抗力低下、体质虚弱、肺活量下降,咳嗽反射存在不同程度减弱和消失,口腔和气管分泌物排出不畅,使用脱水剂和利尿药物使痰液变得粘稠,痰液不易排除,为细菌的滋生繁殖提供了有利条件,引起坠积性肺炎;由于患者神志不清,各种原因引起咽反射消失或减退。而高血压脑出血手术前后患者容易出现呕吐.导致呕吐物及口腔气道分泌物吸入肺部形成吸入性肺炎。多次侵入性的操作如反复吸痰、气管插管或气管切开可导致气管、支气管局部黏膜损坏,细菌易侵入下呼吸道,引起肺部感染[4],手术后使用H2受体阻断药或致敏药使胃液碱化,增加了胃内细菌定值的危险,而留置胃管损伤胃肠黏膜,削弱病人的吞咽反射,胃管的压迫又易造成食管黏膜、鼻咽部黏膜溃疡且刺激咽部而引起恶心呕吐,将胃内细菌带至咽部进入呼吸道,引发肺部感染[5]。手术后肺部感染影响患者预后,需要积极防治,对清醒患者指导并鼓励其咳痰,对咳痰无力及昏迷患者要加强各项护理,注意保持呼吸道通畅,及时翻身、拍背、吸痰,积极沐舒坦雾化吸入。对短期内不能清醒的患者应果断性作气管切开,气管切开者严格执行无菌操作。合理应用抗生素,根据痰培养结果及时更换抗生素,加强全身支持治疗,积极治疗原发病等。
3.2颅内再出血
颅内再出血是高血压脑出血微创手术后常见的并发症,多发生于手术后24小时内,可明显增加患者的病死率。国内有报道微创颅内血肿清除术后发生率为14%[6],在本次研究中,钻孔引流组发生颅内再出血(14.77%)大于小骨窗开颅组(7.81%),有统计学意义(P<0.05),考虑为小骨窗开颅组手术在直视下操作,结合显微镜的应用,术者可以在良好的照明及放大条件下确切止血。而钻孔引流组在非直视下操作.不能在直视下进行有效的止血。国内报道颅内再出血与患者的凝血功能、出血病因、出血部位、血肿形状、脑中线移位、破入脑室、穿刺定位、首次抽吸量、手术时机有相关性,其中凝血功能、血肿形状、手术时机与颅内再出血关系最为密切[7],与患者的年龄、性别、血肿量没有明显相关性。
患者长期高血压可造成脑内动脉硬化和玻璃样或纤维样变性,使血管壁弹性丧失,强度降低,形成局灶性缺血性坏死和许多粟粒状微型动脉瘤,而手术只能清除血肿,血管病变的因素并未解除,手术后各种因素作用于血管,从而引发颅内再出血[8]。我们考虑颅内再出血的原因有:(1) 患者手术前伴有相关血液疾病或者存在有影响凝血机制的因素。(2) 发病至手术时间过短。(3)小骨窗手术中血肿清除追求过于干净,新鲜创面出血不易彻底止血;手术中操作粗糙,未发现责任血管,或者对责任血管的烧灼不确切,盲目采用明胶海绵压迫或者生物胶止血。(4)穿刺过程中由于是盲穿,可能有新的脑组织和血管损伤;术中首次抽吸力量过大,血肿排空太多或速度太快,由于容积代偿作用,可致颅内再出血。(5) 术后血压过高,或者波动幅度过大。(6) 手术后冲洗血肿腔时应用尿激酶过早或量过大,导致局部凝血机制障碍引起出血。(7)手术后拔除引流管过程中,其侧孔引起新的血管损伤。
针对上述原因,我们可以采取的预防措施有:完善术前检查,对有严重肝功能凝血功能障碍者及时补充维生素K,必要时加用新鲜血浆或者凝血因子成分输入;发病6 h内尽量不用甘露醇;如果患者情况许可,尽可能选择在发病6 h以后手术;小骨窗手术清除血肿时做到尽量不损伤血肿壁,避免形成新鲜创面,显微镜下电凝止血要充分可靠,以明胶海绵支撑血肿腔;依据CT准确定位血肿,避开血管丰富区穿刺,避免反复多次穿刺;术中应缓慢抽吸血肿,首次抽吸量不宜超过50%,可用生理盐水“等量置换”抽吸出血肿;术后使血压逐步降至150~160/90—100 mmHg或维持于原血压的2/3左右,去除引起血压升高的危险因素,保持大小便通畅和情绪稳定,对烦躁者给予适当的镇静;手术后保持避免颅压过低,脑室外引流的高度距侧脑室平面的10~20 cm为宜;手术后应用尿激酶冲洗血肿腔时不宜过早或量过大,保留时间不宜超过4个小时;应轻捻引流管慢慢拔除,注意不使侧孔损伤脑组织和血管。微创术后都留有连接血肿腔的引流管,术后发生颅内再出血,血液也可通过引流管排出体外,另外还可以通过引流管,以冰生理盐水加肾上腺素及凝血酶灌注血肿腔后,再开放引流,绝大多数都可有效止血。如果出血量大病情危重者,宜急诊行开颅清除血肿。
3.3消化道出血
在本次研究中,两组病例发病率没有明显区别,平均为9.87%。消化道出血多发生于2~14 d。高血压脑出血患者颅内有血肿,多伴有颅内压增高,累及脑干及丘脑下部发生原发性或继发性损害,在应激状态下容易出现植物神经功能紊乱,交感神经及迷走神经出现兴奋,导致胃黏膜血管痉挛收缩,发生糜烂和出血;过度的交感反应致胃黏膜缺血后出现一个反跳的过度副交感神经兴奋,胃酸分泌增多,加重胃黏膜糜烂和出血。高血压出血的患者基础病较多,各项生理功能大多有所下降,胃黏膜往往为缺血缺氧状态,容易糜烂和出血,特别是发病前伴有糖尿病或胃肠功能差的患者。手术后药物(特别是糖皮质激素)的应用,增强了胃黏膜的损害。以上原因导致胃肠黏膜保护屏障受损,胃蛋白酶大量逆向渗入缺血缺氧的胃黏膜细胞引起应激性溃疡和出血性胃炎[9],出现消化道出血。
手术后应密切观察患者的血压、脉搏及肢端体温等情况变化,予以降颅压,常规使用H2受体拮抗剂。昏迷患者应及时留置胃管,严密观察胃液、呕吐物、大便颜色及性状。如果已经发生消化道出血,胃管内应用冰盐水和止血药物,静脉应用抑酸剂,对血容量不足的患者应该进行扩容,必要时进行输血。保守治疗无效时可行胃镜下止血,必要时行手术止血。
3.4颅内积气
颅内积气术后较常见,国内报道发生率高低不同,从8.89%[10]到60%[11不等。在本次研究中,小骨窗开颅组发生颅内积气(21.88%)大于钻孔引流组(9.09%),有统计学意义(P<0.05)。考虑原因为:小骨窗开颅组开颅清除部分血肿后,脑内压力降低,脑组织塌陷,空气进入颅内,到达颅内高位,在关颅时虽然已经尽量注入生理盐水置换空气,但是很难完全排除。其他的原因考虑为:手术中抽吸血肿负压过大或抽吸过多,过度使用脱水剂,冲洗血肿时未注意排净管内或注射器内空气,致使气体被注入颅内。手术后长时间低位引流过度,注药以及更换引流袋时操作不慎致空气进入;患者手术后伴有意识障碍,导致引流管非计划性脱落等。
颅内积气应该以预防为主,主要措施有:清除血肿颅内减压后,关颅时调整患者头位,使骨窗在最高点,注入生理盐水尽量排除颅内空气;手术中抽吸血肿时不宜用力过猛,负压过大;冲洗血肿过程中注意排净管内或注射器内空气;不要过量使用脱水剂;手术后引流袋顶端要高出穿刺点10~15cm,并观察引流量;注药以及更换引流袋时操作要规范;患者烦躁时要予以镇静,防止引流管非计划性脱落。CT发现手术后颅内积气多出现在双侧侧脑室前脚,额部及血肿腔内,大多无明显症状,可通过调整患者体位,使气体能从引流管引出,一般7~10d内自然吸收。症状重时应及时复查CT,了解颅内情况和积气部位和积气量,严重的颅内积气时,可于平卧时颅内气体的高位处钻孔穿刺抽气、引流。
3.5颅内感染
术后继发颅内感染是神经外科常见的并发症,其发生率可达2%~4%[12。在本次研究中,两组病例发病率没有明显区别,平均为3.95%,颅内感染的主要原因为:①手术切口脑脊液漏。患者手术后血脑屏障被破坏。造成颅内和外界相通,引流管或者切口与脑室或者蛛网膜下腔相通,脑脊液从切口溢出,脑脊液中缺少补体和抗体,没有吞噬细胞,高营养的脑脊液和脑内积血容易成为细菌和病毒的良好培养基;②手术前准备不够充分,皮肤消毒不严格,器械污染,手术过程没有严格无菌操作。预防性抗生素使用的时机不恰当。③非计划性拔管或者置管时间过长。有意识障碍的患者容易不自觉的拔管,引流管与外界相通,空气中的细菌直接种植以及其他部位的间接感染导致颅内感染的发生。引流管放置时间越长感染率越高[13]。④因为患者有意识障碍不配合,手术后伤口换药,引流管更换以及注药时,容易致伤口以及物品污染。⑤手术后患者病情重,合并症多,免疫力及抵抗力低下可增加颅内感染的机会。
针对颅内感染引起的原因,颅内感染的预防有:①常规分层缝合切口,引流管经头皮下潜行一段距离后另外戳孔引出,不直接从头皮切口引出,加压包扎伤口,可以有效减少了脑脊液的溢出;手术后伤口经常换药更换敷料,拔管后有渗漏时,可予加强缝合,减少切口周围潮湿现象,减少了细菌和病毒存在的培养基,截断了细菌和病毒进入颅内的路径,减少术后颅内感染的几率。②手术前做好各项准备工作,手术中严格无菌操作③手术后做好引流管的管理,不配合的患者予以镇静。伤口换药、引流管更换以及注药要严格无菌操作。综合多种因素来决定拔除引流管时间,并尽可能早拔管,脑室引流管也应尽早拔除,一般为3-5天,不超过一周[14]。拔管前和拔管后常规使用脱水剂降低颅内压。④手术后积极治疗患者的基础疾病,处理患者的各种合并症,予患者足够的营养,提高患者的免疫力。
如果明确有颅内感染,应该拔除原有的引流管,另外选择部位置管,根据药敏结果选用能透过血脑屏障的抗生素,尽早鞘内或脑室内注射抗生素,全身应用抗生素治疗要求用量足时间长。
3.6电解质平衡紊乱
在本次研究中,两组病例发病率没有明显区别,平均为16.45%,其中低血钠15例,高血钠4例,低血钾10例。脑出血累及下丘脑,使抗利尿激素分泌异常;患者因高颅压、频繁呕吐导致胃液的大量丢失;脑出血后导致血脑屏障开放,影响中枢神经系统对水电解质、酸碱平衡的调控[15];手术后患者进食少, 静脉补充水、电解质不均衡;脱水剂及肾上腺皮质激素应导致排出电解质增加。以上因素导致水电解质平衡紊乱和酸碱失衡。因此我们在临床上应鼓励患者早期进食或者予以鼻饲;定期复查电解质,掌握好静脉补充水、电解质的量,依据不同情况进行及时处理。
3.7急性肾损伤
在本次研究中,两组病例发病率没有明显区别,平均为11.18%。长期高血压患者,肾脏细小动脉硬化,容易致肾功能不全;脑出血后致交感神经兴奋,使肾脏血流减少;手术后使用脱水剂和补液量不足,造成血容量不足,使肾脏血流减少;大分子的甘露醇主要经肾脏代谢,不合理的应用易造成肾小管损伤;手术中以及手术后止血药物的使血液呈高凝状态。上述缺血和缺氧造成肾脏灌注不足,易导致急性肾小球、肾小管损伤[16]。高血压脑出血患者的肾脏损害以预防为主,脱水剂应小剂量、多次应用,注意监测患者的尿量,保证液体入量,维持正常血容量,定期检查电解质,及时发现和纠正电解质紊乱。出现肾损伤时,停用肾毒性脱水药物甘露醇,改用其他脱水药物,例如甘油果糖或者白蛋白等,必要时使用血液净化或者透析治疗。
3.8泌尿系感染
国内有报道微创颅内血肿清除术后泌尿系感染率为20.6%[17]。本次研究两组病例泌尿系统感染的发病率没有明显区别,平均为7.24%,较报道低。高血压脑出血微创术后患者一般基础疾病较重,需要卧床时间较长,另外有不同程度的意识障碍,控制泌尿系的神经系统以及控制排尿的高级中枢调节失调,致尿失禁或者排尿困难,需要留置尿管时间较长;如果出现其他系统感染,长期大剂量抗生素应用,容易引起菌群失调,也容易引起泌尿系感染。处理上如果患者病情许可应鼓励其多饮水,清醒后应尽早拔除尿管;加强尿管护理,严格无菌操作;定期复查尿常规。如果出现感染迹象,给予抗泌尿系感染药物。
通过本次研究,可以知道微创治疗高血压脑出血手术后并发症仍然有一定发生率,影响疾病的预后,提示我们在临床要高度重视,提早预防,尽量减少并发症的发生,尽早发现和治疗并发症,促进患者的恢复。
[1] 王忠诚.神经外科学[M].武汉:湖北科学技术出版社,2002:689-690.
[1] 中华神经外科学会.各类脑血管病诊断要点[J].中华神经科杂志,1996,29(6):379-381.
[2] 练德义. 97例高血压脑出血颅内血肿微创术后肺部感染分析[J]. 临床医药,2009,18(11):46-47.
[4] 刘花,刘仲海,沈玉杰.神经外科医院感染的调查[J].中华医院感染学杂志,2005,15(2):149-151.
[5] 肖西平,黄利虹,周静,等.普外老年留置胃管患者获得性肺部感染的预防[J].中华医院感染学杂志,2005,15(7);762-763.
[6] 吴钢群. 高血压脑出血微创术后再出血的原因及防治措施[J]. 浙江创伤外科,2011,16(4):469-470.
[7] 赵德强,潘速跃,陈建辉. 微创颅内血肿抽吸术再出血影响因素的Logistic回归分析[J]. 中国急救医学,2009,29(1):5-8.
[8] 张建伟,歧国彭,华奇,等.微创治疗高血压脑出血术后相关并发症的原因及处理体会[J].中国实用医药,2012,7(18):103-104.
[9] 黄如训,苏镇培.脑卒中[M].北京:人民卫生出版社,2001:204-210.
[10] 张云赣,汤海涛.微创颅内血肿清除术并发症的预防及处理[J].中外健康文摘,2010,7(28):85-86.
[11] 卢铁兵.微创颅内血肿清除术并发颅内积气22例[J].医药前沿,2012,4:310.
[12] McClelland S.Postoperrative Intracranial Neurosurgery Infection Rates in North America Versus Europe:a Systematic Analysis[J].Am J Infect Control.2008.36(8):570-573.
[13] 张志.40例颅内感染的临床分析[J].内蒙古医学杂志,2008,40:934-935.
[14] 尉玉杰,王磊,井慎,等.重症颅内感染例的诊治体会[J].齐齐哈尔医学院学报,2009,30(13):1575-1576.
[15] 李宏斌. 微创治疗高血压脑出血术后相关并发症临床分析[J].中国医药导报,2010,7(24): 156-157.
[16] 钱硕,王光弟,鲁晓杰.高血压脑出血术后多器官功能障碍综合征的相关因素分析[J].江苏医药,2008,34(3):289—291.
[17] 都彬,赵红果.微创治疗高血压脑出血术后相关并发症的原因及处理[J].中国当代医药,2011,18(20):151-152.

