单侧耳蜗损毁后小鼠耳蜗核及下丘生长相关蛋白-43的表达
叶放蕾 李世超 陈蓓 王晓东
生长相关蛋白-43(growth associated protein-43,GAP-43)又称神经调素、B-51、F1,是上世纪80年代初由Skene等[1,2]从兔再生的外周神经中获取的钙调素连接蛋白,在脊椎动物的非神经组织中几乎不表达,被认为是神经系统特异性蛋白。在神经系统的发育、损伤再生及突触重建等事件中,常可以检测到GAP-43 mRNA及蛋白质水平显著升高,被视为是神经元发育与再生的一个内在决定因子,被列为研究神经系统生长、发育及损伤后修复等神经系统可塑性的首选标志物[3]。本实验拟通过建立听觉剥夺小鼠的动物模型,观察听觉剥夺后小鼠耳蜗核及下丘生长相关蛋白-43表达的变化,以进一步了解听觉剥夺后小鼠听觉脑干中枢的可塑性。
1 材料与方法
1.1听觉剥夺动物模型的制备 实验动物为成年健康昆明小鼠30只,2~3月龄,体重25.00~35.00 g,平均29.50 g,雌雄不拘;无外耳道和中耳感染,耳廓反射灵敏,无噪声暴露及耳毒性药物使用史。随机分为单侧耳蜗损毁术后3、7、15、30、60天组及对照组,每组5只。前5组小鼠用5%水合氯醛行腹腔注射麻醉(0.10 ml/10 g),右侧为术侧,备皮,耳后切口,完全切除鼓室后壁,确定耳蜗位置,损毁耳蜗内部结构,注入无水酒精;用浸有适量氧氟沙星滴眼液和地塞米松混合液的明胶海绵填塞鼓室,缝合切口,行ABR检测,120 dB SPL声刺激未引出反应波形则确认造模成功。对照组仅行“假手术”,即:耳后切口,缝合,不损毁耳蜗。各组动物保温复苏至苏醒,置于正压屏蔽环境中适应性饲养。
1.2脑干标本采集 对照组于术后当天、耳蜗损毁后各组动物于相应时间点取出脑干制作组织切片。方法:4%多聚甲醛PBS溶液缓慢灌注至小鼠全身强直后, 断头,游离取出脑干组织,浸于4%多聚甲醛PBS溶液中固定。石蜡包埋,冠状位连续切片,片厚度4 μm。隔5张取一张。
1.3免疫组化染色 二甲苯脱蜡,梯度酒精脱水,抗原热修复,阻断内源性过氧化物酶,封闭内源性生物素等处理后,滴加一抗兔抗鼠GAP-43,放入4°C的冰箱过夜,37℃孵育40 min。滴加山羊抗兔二抗工作液约50μl覆盖于组织上,37℃孵育40 min后封片观察。免疫反应产物呈棕黄色颗粒。
1.4计算机图像分析 应用Olympus BX51生物显微镜及郑州大学医学院Biosens Digital Imaging System v1.6系统,对染色的全部切片行定量分析。于400倍镜下随机选取各实验组和对照组耳蜗核及下丘无重叠的5个部位,检测每张切片GAP-43阳性着色的平均光密度值(mean optical density,MOD),MOD值越大GAP-43阳性表达越强。
1.5统计学方法 采用SPSS11.0软件,应用单因素方差分析对各组间MOD值差异进行分析,两组间的比较用独立样本t检验或校正t检验,多组间的两两比较应用LSD-t检验。
2 结果
2.1单侧耳蜗损毁后小鼠耳蜗核GAP-43的表达 单侧耳蜗损毁后3、7、15天组,术耳同侧耳蜗核GAP-43含量水平呈上升趋势,较对照组及术耳对侧表达升高;术后30天,术耳同侧耳蜗核GAP-43表达水平开始下降,但仍高于对照组和对侧,差异有统计学意义(P<0.05);术后60天,GAP-43表达水平与对照组及对侧差异无统计学意义(P>0.05);术耳对侧各时间点耳蜗核GAP-43含量水平与对照组比较差异无统计学意义(P>0.05)(表1、图1)。
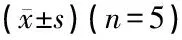
表1 对照组及单侧耳蜗损毁后各组两侧耳蜗核及下丘GAP-43平均光密度
注:*与对照组比较,P<0.05;△与对侧同时间点比较,P<0.05

图1 对照组及单侧耳蜗损毁后不同时间组两侧耳蜗核及下丘GAP-43平均光密度趋势图
光镜下可见对照组耳蜗核中GAP-43阳性染色很弱,阳性表达水平低或为阴性,分布于耳蜗神经元细胞膜周围。耳蜗损毁术后不同时间点各组小鼠耳蜗核中GAP-43阳性免疫反应产物的分布和对照组大致相同,但阳性染色显著加深,阳性颗粒明显增多(图2)。
2.2单侧耳蜗损毁后小鼠下丘GAP-43的表达 光镜下见对照组下丘中GAP-43阳性染色较弱,阳性表达水平低,弥散在神经元细胞胞浆内,分布较均匀。单侧耳蜗损毁后各组下丘中GAP-43阳性产物的分布部位与对照组大致相同,但阳性染色显著加深,阳性颗粒显著增多,阳性表达的细胞数目有不同程度的增加(图3)。

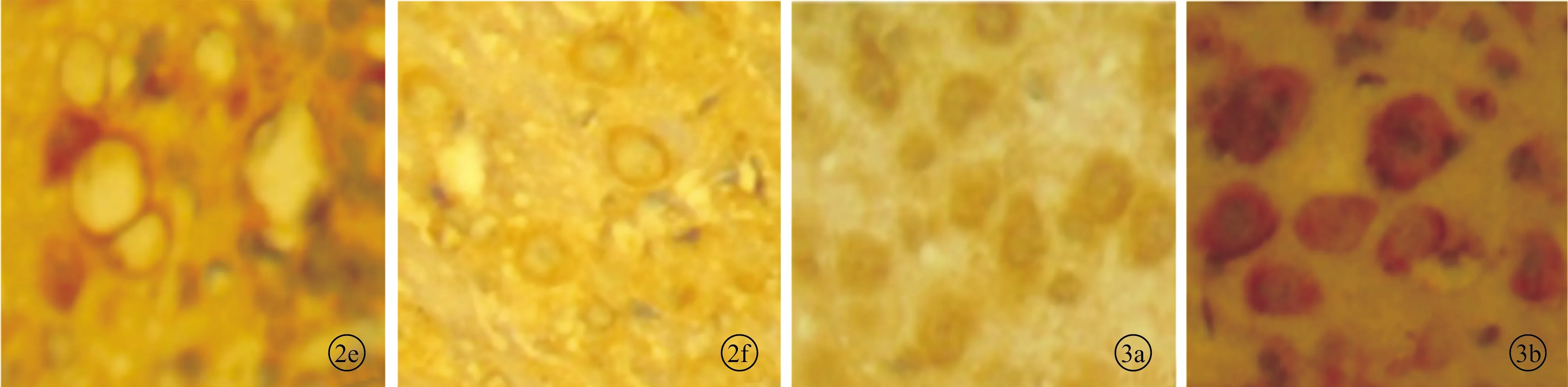

图2 各组动物耳蜗核GAP-43表达(免疫组化染色×400) a、b、c、d、e、f分别为对照组和术后3、7、15、30、60天组
小鼠单侧耳蜗损毁后3、7、15天,术耳同侧和对侧下丘GAP-43表达水平较正常对照组逐渐升高,差异有统计学意义(P<0.05),且术耳同侧的表达水平低于对侧(P<0.05);术后30天术耳同侧和对侧表达水平逐渐下降,但仍高于对照组(P<0.05),且术侧表达低于对侧(P<0.05)(表1、图1);术后60天,其表达继续下降,术耳同侧及对侧与对照组、术耳同侧与对侧的表达差异无统计学意义(均P>0.05)。
3 讨论
GAP-43作为一种突触前蛋白,主要表达于神经系统,非神经组织中很少表达,与神经系统的发育、轴突的再生和可塑性等紧密联系。在个体发育期间,GAP-43在听觉脑干核特征性表达,成熟后在这些核团中表达消失[4]。它通过引导轴突生长和调节新连接形成而影响轴突生长能力,即使在缺乏其它营养因子时也能使神经元发出新的终末[5]。
Michler等[6]发现强纯音损伤后,术后3天大鼠外侧橄榄核GAP-43微量表达, 术后9天表达增强,第3周达到高峰,表达持续约1.5 年;耳蜗切除后3~16天,对侧外侧橄榄核GAP-43阳性表达持续升高,可维持1年,说明耳蜗损毁后橄榄核表现出了中枢重塑。楚铜等[7]发现大鼠单侧耳蜗损毁后耳蜗核内GluR2/3受体表达亦呈现出一过性先升高后降低的过程,进而引起细胞形态学功能改变,听觉中枢重塑。耳蜗核作为哺乳动物听觉中枢系统的第1级听觉中枢,位于延脑的上方,同侧听神经入脑后,终止于耳蜗核团中的前腹侧核、后腹侧核及背核,接受同侧耳蜗信息的传入, 并与上级中枢及其它听觉中枢核团密切联系,对接受的声信号进行初步加工整合;研究[8]表明,声信号传入受阻后,耳蜗核首先发生重组。从本研究结果看,在单侧耳蜗损毁后,小鼠同侧耳蜗核内GAP-43的表达呈现出先升高后降低的过程,可能与听觉中枢去外周神经后,启动了耳蜗核内潜伏状态的神经元,GAP-43mRNA转录增加,使GAP-43表达增加;而术耳对侧耳蜗核GAP-43表达无明显变化,可能是由于耳蜗核主要接受同侧蜗神经刺激的缘故。具体GAP-43mRNA转录增加的机制有待进一步研究。
下丘是脑干听觉中枢对声信号刺激进行加工处理和传递的主要中继核团,下丘神经元对声刺激的反应复杂,全部听觉上行和下行通路都在下丘形成一一映射的突触联系,正是这种联系使下丘具备了兴奋和抑制双重效应[9]。下丘中央核团最少接受4个低位不同听觉核团同侧及对侧的纤维传入,调节机制复杂;郜元坤等[10]发现双侧耳蜗损毁后,大鼠双侧下丘内GAP-43表达呈现出先升高后下降的过程;本研究结果显示单侧耳蜗损毁后,小鼠双侧下丘内GAP-43表达均呈先升高后下调的过程,可能正常情况下蜗神经产生抑制性信号,抑制下丘内神经元表达GAP-43,当去除外周神经后,下丘神经GAP-43的表达增加。李孟等[11]指出双侧耳蜗损毁后听觉皮层突触素亦一过性升高,表明在耳蜗损毁后听觉皮层亦出现重塑现象;Meidinger等[12研究亦发现大鼠单侧耳蜗损毁后,在听觉皮层内GAP-43的表达亦有相似的变化;此过程可能与大脑皮层神经元轴突再生或突触的重新形成有关,但其具体机制仍在研究中。
关于听觉中枢重塑性的研究日益增多,GAP-43作为调节轴突出芽生长和轴突导向的重要蛋白,已成为研究神经再生和轴突可塑性机制的关键蛋白。轴突的再生及突触的重新建立需要一系列信号分子的协同作用,此过程尚需进一步研究。
4 参考文献
1 Benowitz LI, Routtenberg A.GAP-43: an intrinsic determinant of neuronal development and plasticity[J].Trends Neurosci,1997,20:84.
2 Huang X, Chen S, Tietz E. Immunocytochemical detection of regional protein changes in rat brain sections using computer-assisted image analysis[J]. J Histochem Cytochem,1996,44:981.
3 Dergham P,Ellezam B,Essagian C,et a1.Rho signaling pathway targeted to promote spinal cord repair[ J].J Neurosci,2002,22:33.
4 Hassiotis M, Ashwell KW, Marotte LR, et al .Gap-43 immunoreactivity in the brain of the developing and adult wallaby (Macropuseugenii)[J]. Anat Embryol, 2002, 206:97.
5 Gianola S,Rossi F.GAP-43 overexpression in adult mouse Purkinje cells overrides myelin-derived inhibition of neurite growth[J] .Eur J Neurosci,2004,19:819.
6 Michler SA, Illing RB. Acoustic trauma induces reemergence of the growth- and plasticity-associated protein GAP-43 in the rat auditory brainstem[J]. J Comp Neurol, 2002,451:250.
7 楚铜, 金晓杰,王家东. 大鼠单侧耳蜗损伤后蜗核中GluR2/3受体表达的变化[J]. 听力学及言语疾病杂志, 2006,14:283.
8 Kraus KS, Ding D, Zhou Y, et al. Central auditory plasticity after carboplatin-induced unilateral inner ear damage in the chinchilla: Up-regulation of GAP-43 in the ventral cochlear nucleus [J]. Hearing Research,2009,255:33.
9 Pollak GD, Park TJ.The effects of GABA ergic inhibition on monaural response properties of neurons in the mustache bat's inferior colliculus[J]. Hear Res,1993,65:99.
10 郜元坤, 华清泉, 廖华,等.大鼠双侧耳蜗毁损后下丘核生长相关蛋白表达研究[J].听力学及言语疾病杂志,2010,18:48.
11 李孟,华清泉, 廖华,等. 双侧耳蜗毁损后大鼠听皮层突触素表达的变化[J]. 听力学及言语疾病杂志, 2008,16:495.
12 Meidinger MA, Hildebrandt-Schoenfeld H, Illing RB. Cochlear damage induces GAP-43 expression in cholinergic synapses of the cochlear nucleus in the adult rat: a light and electron microscopy study[J]. Eur J Neurosci,2006,23:3 187.

