黑荆树不同外植体愈伤组织诱导与芽分化的研究
唐佳佳,尚旭岚,洑香香
(南京林业大学森林资源与环境学院,江苏 南京 210037)
黑荆树不同外植体愈伤组织诱导与芽分化的研究
唐佳佳,尚旭岚,洑香香*
(南京林业大学森林资源与环境学院,江苏 南京 210037)
为建立高效的黑荆树快速繁殖体系,以黑荆树叶片、茎段和下胚轴为外植体,在添加不同植物生长调节剂的MS培养基上进行了愈伤组织的诱导和不定芽的分化研究。结果表明:综合最高诱导率结果和愈伤组织的生长状况,外植体的愈伤组织诱导能力顺序为叶片(44.83%)>下胚轴(36.35%)>茎段(30.05%);愈伤组织诱导最佳培养基为MS+1.5 mg/L 6-BA+0.005 mg/L TDZ+1.0 mg/L IBA。叶片和下胚轴所诱导的愈伤组织均可分化出不定芽,但芽诱导率差异达极显著水平;不定芽分化最佳培养基为MS+0.01 mg/L TDZ+0.2 mg/L IBA,叶片愈伤组织的芽分化率最高可达32.60%。
黑荆树;外植体;愈伤组织;诱导;芽分化
黑荆树(Acacia mearnsii De Wild)树皮含单宁达40%,是当今世界上主要的鞣质树种之一,也是生产薪炭材、包装纸用纸浆材的上好树种。黑荆树树皮中富含原花色素,原花色素是迄今发现的为数不多的几种能够防止大脑和神经组织氧化的抗氧化剂之一[1]。此外,黑荆树对控制水土流失、改良土壤都起着重要的作用,是重要的经济和生态树种[2]。黑荆树虽然易于用种子繁殖,但组织培养技术可以加速优良无性系的快速繁殖和推广。自黑荆树组织培养技术研究开展以来,黑荆树组织培养条件和建立植株再生体系的影响因素依然是学者一直在研究的重要课题[3-7]。建立高频再生体系需要诱导愈伤组织,愈伤组织的诱导是实现细胞大规模培养和建立高产细胞系的前提和基础[8]。
外植体的选择是愈伤组织诱导和建立再生体系的第一环节。外植体可以选择为茎尖、胚、胚轴、子叶、幼芽、嫩叶和幼根等。关于黑荆树愈伤组织的培养已有报道[4-6],但从愈伤组织上分化出不定芽,至今还未见报道。本试验选择黑荆树的叶片、茎段和下胚轴3种外植体,进行愈伤组织的诱导与分化,探讨外植体种类、植物生长调节剂组合对黑荆树愈伤组织培养的影响,为进一步建立组织培养快繁技术体系提供技术保障。
1 材料与方法
1.1 材料
黑荆树种子由云南楚雄种子园提供。
1.2 方法
1.2.1 外植体的准备与处理
(1)叶片和茎段外植体:用100℃开水处理种子20 min后,换清水浸泡24 h,挑选吸胀的种子播在等体积珍珠岩和草炭的基质中,待苗高达到约15 cm时即可取叶片和茎段作为外植体。流水轻轻冲洗外植体表面脏物后,用洗洁精溶液浸泡振荡3 min,流水冲洗1 h;沥干水后,置于超净工作台上,用70%酒精消毒20 s,0.1%HgCl2消毒8 min,再用无菌水清洗4~5次。将消毒好的叶片切成0.5 cm× 1.0 cm的小块,将茎段切成0.5~1.0 cm的小段,接种在愈伤组织诱导培养基上。
(2)下胚轴外植体:用100℃开水处理种子20 min后,换清水浸泡24 h,挑选吸胀的种子在70%酒精中消毒1 min,0.1%HgCl2消毒15 min,再用无菌水漂洗4~5次后接种在MS培养基上。10 d左右取无菌苗下胚轴,切成长约5 mm的小段,接种在愈伤组织诱导培养基上。
1.2.2 愈伤组织的诱导与分化 愈伤组织诱导培养:将处理后的外植体材料接种到MS诱导培养基上,添加植物生长调节剂6-BA,TDZ和IBA,组成3因素3水平正交试验设计(见表1)。每个处理接种8瓶,每瓶3个相同外植体,试验重复3次。接种后定期观察,培养期间及时剔除污染的培养瓶,以免交叉污染。30 d后统计各处理的接种数(除去污染数目)、愈伤率,比较愈伤组织的长势,筛选最适宜愈伤组织诱导的外植体和最佳分化培养基。
愈伤组织分化培养:将各外植体诱导得到的愈伤组织切成大小相近的小块,转接到MS分化培养基中,添加植物生长调节剂TDZ和IBA(见表1)。在分化过程中定期观察、统计。
1.2.3 培养条件 培养基中琼脂质量浓度为6 g/L,蔗糖质量浓度为30 g/L,pH值5.8。除愈伤组织诱导培养需在外植体接种后暗培养24 h外,其余均在光照条件下进行培养。培养室温度(24± 2)℃,光照强度为50 μmol/(m2·s),光照时间为12 h/d。
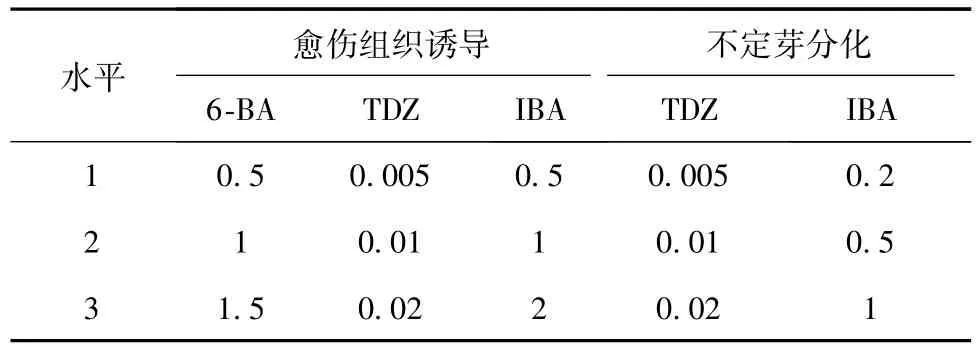
表1 愈伤组织诱导和不定芽分化培养基中的植物生长调节剂质量浓度 mg/L
1.2.4 数据处理和分析 培养30 d后,统计各个处理的愈伤组织诱导率和不定芽分化率。愈伤组织诱导率=(出现愈伤组织的叶片数/接种后未污染叶片数)×100%;不定芽分化率=(分化不定芽愈伤组织块数/接种愈伤组织块数)×100%。利用专业统计软件DPS进行数据处理,并用Duncan氏法进行差异显著性检验。
2 结果与分析
2.1 黑荆树愈伤组织的诱导
2.1.1 最佳外植体的筛选 3种外植体,在加入不同质量浓度的生长素和细胞分裂素类物质的培养基上诱导愈伤组织。观察发现,接种10 d左右,叶片明显增厚,呈卷曲状,茎段和下胚轴膨大增粗;15 d左右,3种外植体均从伤口处陆续长出淡绿色愈伤组织。
不同外植体在不同植物生长调节剂组合的诱导培养基中,愈伤组织诱导率有很大差别(见表2)。叶片的诱导率范围为10.29%~44.83%,下胚轴的诱导率范围为12.09%~36.35%,茎段的诱导率范围为11.98%~30.04%。比较不同外植体获得的最高诱导率,发现叶片的诱导率最高,下胚轴次之,茎段最差。方差分析表明,不同外植体的诱导率差异显著;从愈伤组织的类型和质地来看,叶片诱导的愈伤组织中绿色、有光泽、质地致密的愈伤组织量较多(见图1-1),下胚轴愈伤组织中淡黄色、质地松软的愈伤组织量中等(见图1-2),茎段愈伤组织中淡黄绿色、质地松软的愈伤组织量较少(见图1-3);从愈伤组织出现的时间来看,下胚轴需13 d左右,叶片需15 d左右,茎段需18 d左右。对愈伤出现的时间、诱导率、愈伤组织类型及取材难易程度综合分析,认为叶片是黑荆树诱导愈伤组织最适合的外植体。
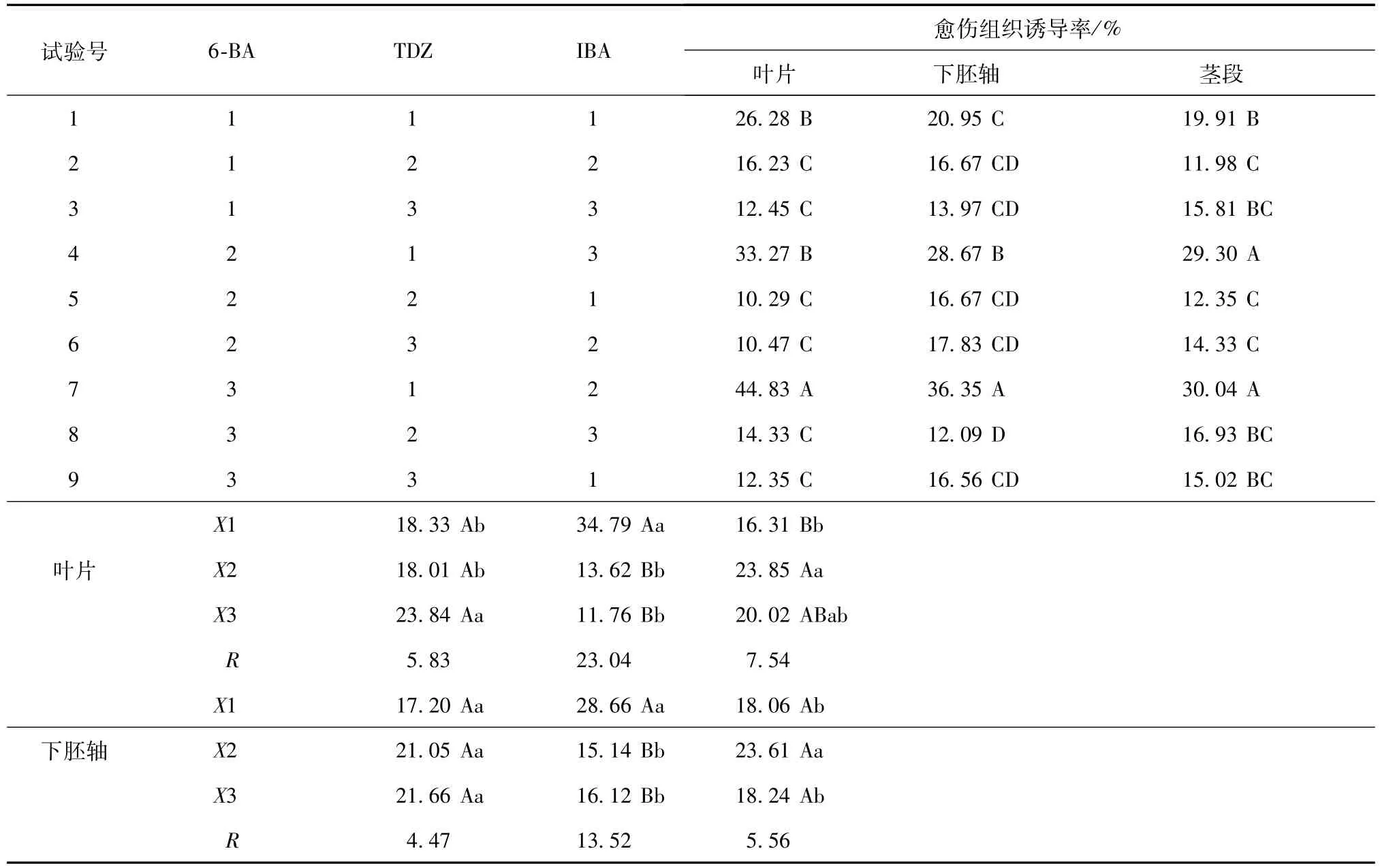
表2 不同外植体在不同诱导培养基上的诱导率比较
2.1.2 植物生长调节剂对愈伤组织诱导的影响愈伤组织的诱导不仅要考虑诱导率和愈伤组织的数量,而且要重视愈伤组织的质量(不定芽的分化)。方差分析表明,同一外植体在不同培养基上的诱导率差异均达极显著水平,说明不同植物生长调节剂种类和质量浓度对愈伤组织的诱导率有极显著影响。对诱导产生愈伤组织的数量、颜色和质地进行观测发现,3种外植体在7号培养基上不仅诱导率高,而且愈伤组织产量高,质量较好,利于继续培养。
对叶片和下胚轴的愈伤组织诱导率进行方差分析(见表2),结果发现,TDZ对叶片和下胚轴愈伤组织诱导的影响均极显著;IBA对叶片和下胚轴愈伤组织诱导的影响分别呈极显著和显著;6-BA对叶片和下胚轴愈伤组织诱导的影响分别呈显著和不显著。从影响程度来看,影响最大的是TDZ,其次是IBA,6-BA的影响最小。综合考虑愈伤组织诱导率和生长状况,适宜的愈伤组织诱导培养基为MS+1.5 mg/L 6-BA+0.005 mg/L TDZ+1.0 mg/L IBA,在其上叶片的愈伤组织诱导率达45%左右。
2.2 不定芽的诱导
将各外植体诱导的愈伤组织进行继代培养,当愈伤组织长度大于0.5~1.0 cm时,接入不定芽诱导培养基中。结果表明,外植体中只有叶片(见图1-4、1-5)和下胚轴(见图1-6)的愈伤组织可以分化不定芽,茎段的愈伤组织不能分化不定芽。其中叶片愈伤组织在不同诱导培养基上的芽诱导率范围为13.03%~32.60%,下胚轴的芽诱导率范围为4.79%~14.33%(见表3)。总体来看,不管在何培养基上,叶片愈伤组织的芽诱导率都高于下胚轴,分化率存在极显著差异。根据不定芽的最高诱导率进行筛选,认为培养基MS+0.01 mg/L TDZ+0.2 mg/L IBA上,不定芽分化率高,且生长良好。
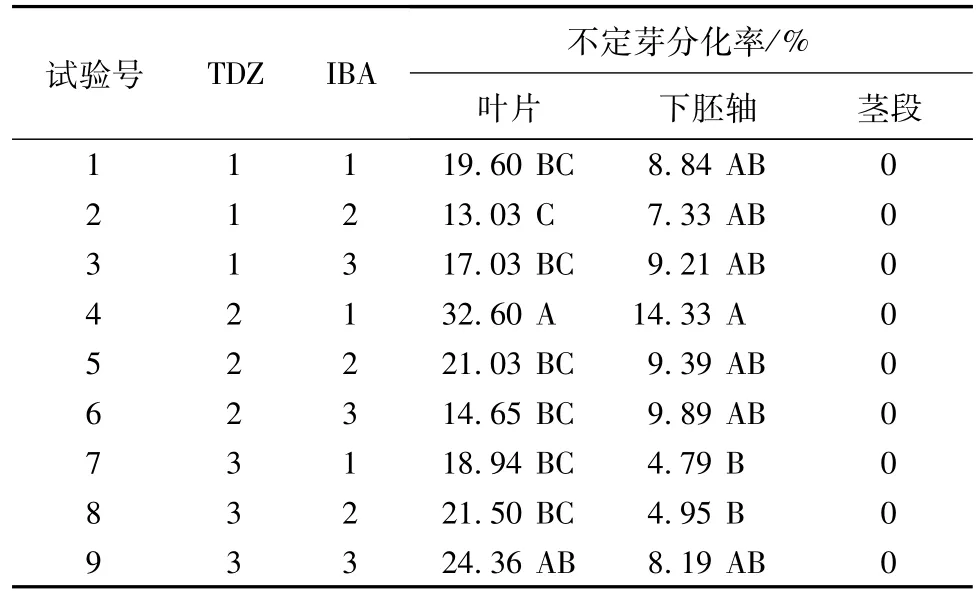
表3 植物生长调节剂对黑荆树愈伤组织分化的影响
方差分析表明(见表4),TDZ对叶片和下胚轴不定芽分化都呈极显著差异,起着主要作用;IBA和2种激素类物质的交互作用,对叶片愈伤组织的芽分化的影响,分别呈现显著和极显著差异,而对下胚轴愈伤组织的芽分化影响不显著。
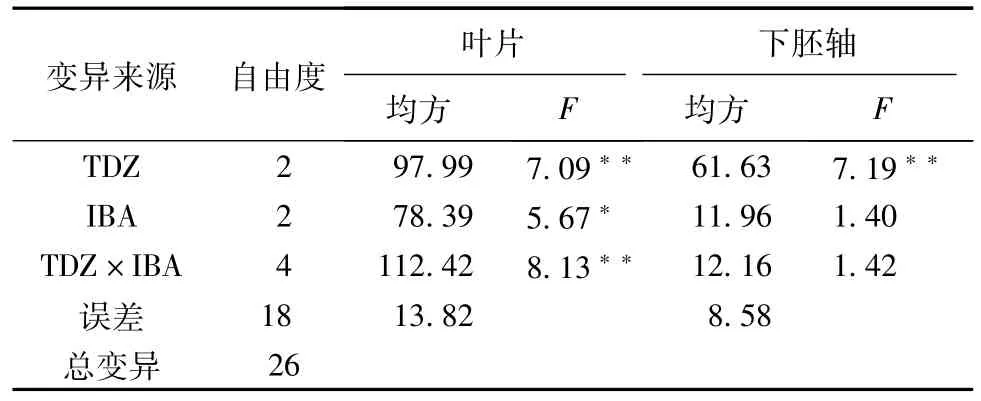
表4 TDZ与IBA不同质量浓度组合培养基中不定芽分化率方差分析
3 结论与讨论
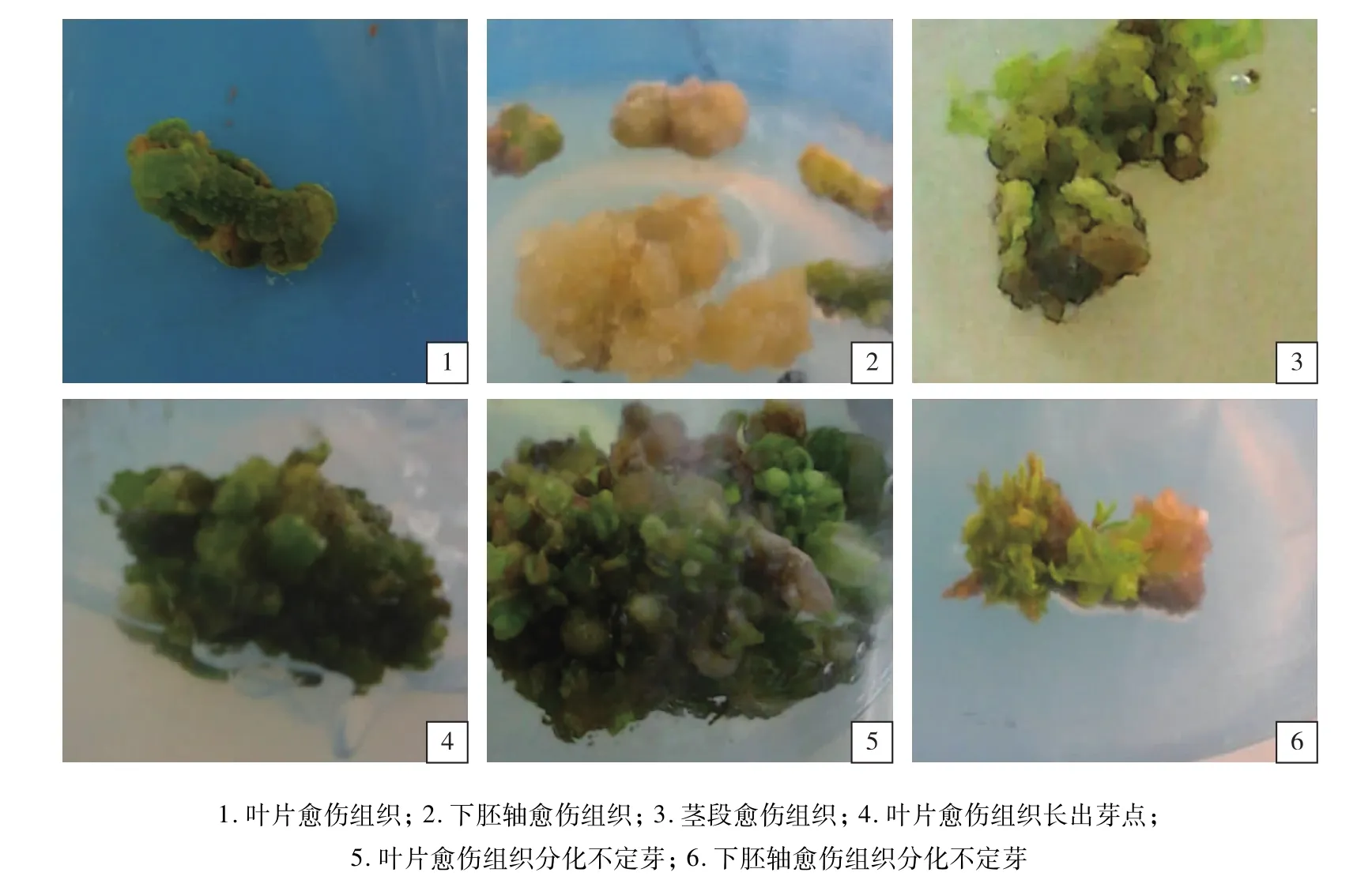
图1 不同外植体愈伤组织的诱导和芽分化情况
植物愈伤组织的诱导主要受外植体本身、培养基和培养环境3大因素的调控[9-11]。不同植物的器官和组织,其形态发生能力各不相同;即使同种植物不同部位外植体,所需要的营养和植物激素的用量也不相同。诱导效果差异的原因可能是由于它们的生理状态和所处的生育时期不同,其内源激素浓度和比例不同[12-13]。本研究中,3种外植体产生愈伤组织的能力不同,叶片比下胚轴、茎段愈伤组织诱导能力强,且其愈伤组织的芽分化能力也强。表现在叶片出愈时间早、诱导率高、产生的愈伤组织量多且质量好、不定芽分化率高等,这与许多植物的表现一致[8]。
外植体在愈伤组织诱导过程中,对激素种类和质量浓度的反应差别甚大。本试验利用TDZ、6-BA与IBA协同作用诱导愈伤组织,TDZ诱导叶片和下胚轴愈伤组织的作用极显著,影响大于6-BA,这可能与外植体本身所含的内源激素的种类、浓度水平差异和对外源激素的反应灵敏性不同有关[14]。在组织培养中,添加TDZ有利于愈伤组织的诱导增殖,且与6-BA有很好的协同作用[15]。
另外,TDZ对外植体芽的再生诱导效果好[16-19],许多难以离体分化的植物因采用TDZ而达到高频分化[9]。吴雪梅等[20]在草莓叶片和杨海芸等[21]在蝴蝶兰叶片的组织培养中发现,TDZ比6-BA能更好地诱导不定芽发生,笔者在本试验中也得出相同的结论。分析可能由于TDZ具有极强的细胞分裂素活性,细胞可以能长时间保持较高的分化能力[22],且TDZ具有一定的作用范围,在最适宜的含量范围内,其对不定芽的诱导作用最明显,含量过低效果不明显,含量过高对不定芽的生长有毒害作用,产生玻璃化现象[23]。本研究中0.01 mg/L TDZ有利于叶片和下胚轴愈伤组织不定芽的分化,质量浓度过高或过低不定芽分化率明显降低,分析可能是TDZ质量浓度过高或过低导致细胞分裂素与生长素失衡。另外,TDZ在0.01 mg/L下,随着IBA质量浓度的增加,不定芽的分化率呈极显著差异,分析可能是外源性激素IBA抑制了TDZ诱导内源性生长素积累,从而一定程度上抑制了外植体的不定芽发生[24]。所以愈伤组织不定芽的分化不仅与外源激素的质量浓度有关,还和外源激素间的比值有关。
[1] 刘夏睿,王 飞.黑荆树树皮原花色素生物活性的研究[J].林产化学与工业,2007,27(3):44-48.
[2] 张华通,瞿应昌,周志坚.黑荆树茎尖培养技术的研究[J].广东林业科技,1996,12(4):17-22.
[3] 龚 峥.黑荆树离体微型繁殖的研究[J].广东林业科技,1995,11(1):32-35.
[4] 龚 峥,瞿应昌,周志坚.黑荆树愈伤组织和细胞悬浮培养实验[J].广东林业科技,1993(1):11-15.
[5] 王敬文,蒋 晶.低温驯化的黑荆树悬浮培养细胞中可溶性蛋白质含量变化[J].林业科学研究,1993,6(6):661-665.
[6] 王敬文,蒋 晶.脱落酸诱导黑荆树悬浮细胞抗冻性[J].林业科学,1994,30(5):385-390.
[7] 张庆华,黄文奕,蔡丽萍,等.黑荆树组织培养繁殖技术的研究[J].经济林研究,1993,11(1):33-36.
[8] 苗永美,简 兴,石 静.菘蓝两种外植体愈伤组织诱导研究[J].生物技术通报,2008(1):147-150.
[9] 王洪霞,郭尚敬.TDZ对甜椒不定芽分化的影响[J].北方园艺,2012(3):104-106.
[10]周丽丽,王 晶,闫俊芳,等.不同外植体对红掌初代培养及愈伤组织诱导的影响[J].安徽农业科学,2012,40(28):13720-13724.
[11]郭军战,费昭雪,成密红.红掌不同外植体愈伤组织诱导与不定芽分化的研究[J].西北林学院学报,2006,21(3):72-74.
[12]陈正华.木本植物组织培养及其应用[M].北京:高等教育出版社,1986.
[13]周维燕.植物细胞工程原理与技术[M].北京:中国农业大学出版社,2001.
[14]杨继涛,邹志荣,张素勤,等.植物激素对非洲菊花托愈伤组织诱导的研究[J].西北农业学报,2003,12(3):133-135.
[15]陈宗礼,齐向英,张向前,等.TDZ和6-BA对枣树继代培养的影响[J].西北农业学报,2006,15(3):162-165.
[16]徐晓峰,黄学林.TDZ:一种有效的植物生长调节剂[J].植物学报,2003,20(2):227-237.
[17]Bretagne B,Chupeau M,Chupeau Y,et al.Improved flax regeneration from hypocotyls using thidiazuron as a cytokinin source[J].Plant Cell Reproduction,1994(14):120-124.
[18]周连霞,马锋旺,陈登文,等.TDZ对仙客来不同外植体再生的影响[J].西北农林科技大学学报:自然科学报,2006,34(4):39-42.
[19]Karam N S,Al-Majathoub M.In vitro shoot regeneration from mature tissue of wild cyclamen Mill[J].Scientia Horticulturae,2000(86):323-333.
[20]吴雪梅,汤浩茹,李 燕,等.不同培养条件对“丰香”草莓离体叶片再生的影响[J].园艺学报,2004,31(5):657-659.
[21]杨海芸,吴 霞,王广东,等.不同培养条件对蝴蝶兰离体叶片不定芽发生的影响[J].南京农业大学学报,2007,30(1):44-49.
[22]谢寅峰,张志敏,尚旭岚,等.青钱柳茎段腋芽萌发和丛生芽增殖[J].林业科学,2011,47(1):50-55.
[23]Huetteman C A,Preece J E.Thidiazuron:a potent cytokinin for woody plant tissue culture[J].Plant Cell,Tissue and Organ Culture,1993(33):105-119.
[24]程强强,庄东红,许大熊,等.TDZ高效诱导蝴蝶兰叶片不定芽及植株再生[J].植物科学学报,2011,29(4):524-530.
Callus induction and differentiation with diverse explants of Acacia mearnsii
TANG Jia-jia,SHANG Xu-lan,FU Xiang-xiang*
(College of Forest Resources and Environment,Nanjing Forestry University,Nanjing 210037,China)
To establish an efficient tissue culture system for rapid propagation of Acacia mearnsii,the leaves,stem segments and hypocotyls were used as explants and cultured on MS medium.And effects of different types and concentrations of plant growth regulators on the induction and differentiation of callus were examined.The results showed that for the induction rate and the growth of callus,leaves were the best of three explants with the suitable medium of MS+1.5 mg/L 6-BA+0.005 mg/L TDZ+1.0 mg/L IBA.The callus of leaves and hypocotyls could induce adventitious buds.Moreover,different explants had a significant effect on differentiation rate.As for the adventitious buds differentiated from leaves’callus,the best differentiation value up to 32.60%was gained on medium of MS+0.01 mg/L TDZ+0.2 mg/L IBA.
Acacia mearnsii;Explant;Callus;Induction;Bud differentiation
Q813.1.3
A
10.3969/j.issn.1001-7380.2014.02.002
1001-7380(2014)02-0006-05
2014-02-20;
2014-02-26
国家林业公益性行业科研专项(201104019);江苏高校优势学科建设工程资助项目(PADA);江苏高校协同创新中心资助项目
唐佳佳(1990-),女,安徽安庆市人,硕士研究生,主要从事林木种苗科学与技术研究。E-mail:tang900622@163.com。
*通信作者:洑香香(1969-),女,江苏南京市人,教授,研究方向:森林培育。E-mail:xxfu@njfu.edu.cn。

