经肝动脉碘化油/无水乙醇混合剂栓塞消融术治疗兔VX2肝癌的实验研究
钱亭,陈茂振,高峰,尹化斌
·实验研究Experimental research·
经肝动脉碘化油/无水乙醇混合剂栓塞消融术治疗兔VX2肝癌的实验研究
钱亭,陈茂振,高峰,尹化斌
目的通过比较不同容积比例的碘化油-无水乙醇混合剂(Lipiodol-ethanolmixture,LEM)治疗兔VX2肝癌模型的效果,确定LEM的最佳容积比例。方法将18只新西兰白兔按碘化油∶无水乙醇容积比例3∶1(A)、2∶1(B)、1∶1(C)、1∶2(D)、1∶3(E)、1∶4(F)分为6组,每组3只。1周后取肿瘤组织行病理学检查,观察肿瘤生长率,肿瘤微血管密度,肿瘤细胞凋亡指数(apoptosis index,AI)及肿瘤边缘肝组织损伤情况。结果A、E、F 3组肿瘤体积增大,A组肿瘤生长率明显高于其他5组,差异有统计学意义(P<0.05),B、C、D 3组肿瘤体积缩小,但与肿瘤体积增大的E、F组比较,差异无统计学意义(P>0.05)。不同容积比例LEM中,无水乙醇比例与肿瘤微血管密度呈负相关(R2=0.840,F=89.432,P<0.001)。A组肿瘤AI明显低于C、D、E、F组(P<0.05),A、B组间差异无统计学意义(P>0.05)。B组与C、F组间差异有统计学意义(P<0.05),其他各组间差异无统计学意义(P>0.05)。A、B组肿瘤周围肝组织损伤明显低于其他各组(P<0.05)。结论从安全性方面考虑,LEM的最佳容积比例为2∶1。若能做到超选择插管至肿瘤供血动脉,严密透视监视下注射,适当提高无水乙醇比例,疗效更佳。
肝癌;经动脉无水乙醇消融术;无水乙醇;碘化油;动物实验
经动脉无水乙醇消融术(transarterial ethanol ablation,TEA)具有微创、价格低廉等外科手术无法比拟的优势,已较早应用于治疗原发性肝癌的基础及临床研究,并取得一定疗效。但对于不同容积比例的碘化油-无水乙醇混合剂(Lipiodol-ethanol mixture,LEM)的治疗效果未达成一致意见。选择最佳容积比例的LEM对于更好的利用TEA规范化治疗原发性肝癌有重要意义。
1 材料与方法
1.1 实验动物及模型建立
1.1.1 实验动物18只新西兰白兔,普通级,雌雄不限,体质量2.0~3.0 kg,由上海国睿生命科技有限公司提供。荷瘤兔由上海市第九人民医院提供。按碘化油∶无水乙醇容积比例3∶1(A)、2∶1(B)、1∶1(C)、1∶2(D)、1∶3(E)、1∶4(F)将兔分为6组,每组3只。
1.1.2 兔VX2肝癌模型的制备荷瘤兔全麻,常规备皮、消毒、铺洞巾,完整剥离出肿瘤组织,放入盛有0.9%氯化钠溶液的换药碗中。用弯眼科剪去除瘤组织外多余的筋膜、肌肉组织及瘤块内坏死组织。再用弯眼科剪将瘤组织剪碎成1mm3小块备用。实验动物术前禁食,术中麻醉(盐酸氯胺酮∶速眠宁Ⅱ为1∶1,0.2~0.3m l/kg)后,仰卧位固定于CT检查床,CT引导下用18号穿刺针经肋间皮肤穿刺至肝左外叶,深约10mm,通过鞘塞入瘤组织块,术后2周用于实验研究[1]。
1.2 方法
1.2.1 影像学检查常规磁共振序列包括T1WI、T2WI抑脂。T1WI采用FSPGR双回波序列,扫描参数如下:TE 80ms,TR 900ms,层数20,层厚3.0mm,层距0.5 mm,视野20 cm,矩阵128×128,激励次数1.00。T2W I采用FRFSE抑脂序列:TE 90 ms,TR 3 600 ms,层数20,层厚3.0 mm,层距0.5 mm,视野20 cm,矩阵128×128,激励次数4.00。在T1WI、 T2WI扫描完成后行DWI检查,DWI采用single shot SE DWIEPI序列,b值取600 s/mm2。具体参数如下:TE 56 ms,TR 5 000 ms,层数20,层厚3.0 mm,层距0.5 mm,视野20 cm,矩阵128×128,激励次数8.00。术后1周MRI检查同前。
1.2.2 TEA术将模型兔全麻,备皮,仰卧位固定,腹股沟区常规消毒、铺巾,触摸右侧股动脉搏动最强处做手术切口,分离和暴露股动脉。用20 G穿刺针穿刺股动脉,引入导丝及微导管,在透视情况下将微导管选择性插入腹腔干,推注约1m l对比剂造影,然后超选择性插入肝左动脉[2],再次推注对比剂造影,以确定微导管位置及肿瘤血供情况。在透视下先给予0.5 ml 1%利多卡因,然后缓慢推注现配的LEM,当看到血流静止时,停止推注(推注量约为1m l)。术后结扎股动脉,保留股深动脉。分层缝合肌肉组织、皮肤。
1.2.3 病理标本制作TEA术后1周处死动物,完整取出肝脏。标本均用4%甲醛溶液固定(<24 h),常规石蜡包埋,切片厚4μm,行常规HE、CD31免疫组化及TUNEL法染色。
1.2.4 计量资料统计①肿瘤生长率=(肿瘤TEA术后体积-肿瘤TEA术前体积)/肿瘤TEA术前体积×100%。其中,肿瘤体积(V)=L×W2/2,(L代表肿瘤的最大层面长径,W代表与L垂直的最宽径)。由于MRI-DWI图像上肿瘤与周围组织对比度好,因此长径及宽径的测量在MRI-DWI测得。术前、术后测量应尽可能选择同一层面。②微血管密度(MVD)计数:采用Weidner等[3]的方法,首先低倍镜(50倍或100倍)观察选择瘤巢内及瘤巢周围MVD最高区域,即血管“热点”区;再在高倍镜(200倍)视野下计数微血管数目,记录3个视野,取平均值。在计数微血管时,以与周围肿瘤细胞和结缔组织成份有明显区别的任一染成棕色的血管内皮或内皮细胞簇作为1个血管计算,只要结构不相连,其分支结构也作为1个血管计数。③调亡指数(AI)计算:采用TUNEL法染色,读片时,细胞核染色呈棕褐色者为阳性细胞。每张切片上随机选取5个视野,并计算出凋亡细胞在全部癌细胞中所占比例,即AI=(凋亡细胞数/癌细胞总数)×100%。
1.3 统计学处理
采用SPSS16.0软件进行统计学处理。应用单因素方差分析(One-way ANOVA),LSD法及回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 成瘤情况及影像表现
18只新西兰白兔均造模成功并完成各项检查。术前,实验兔肝肿瘤实质在MRIT1WI呈等信号,T2WI及DWI呈高信号;术后肿瘤信号不均匀。见图1。
2.2 肿瘤生长率
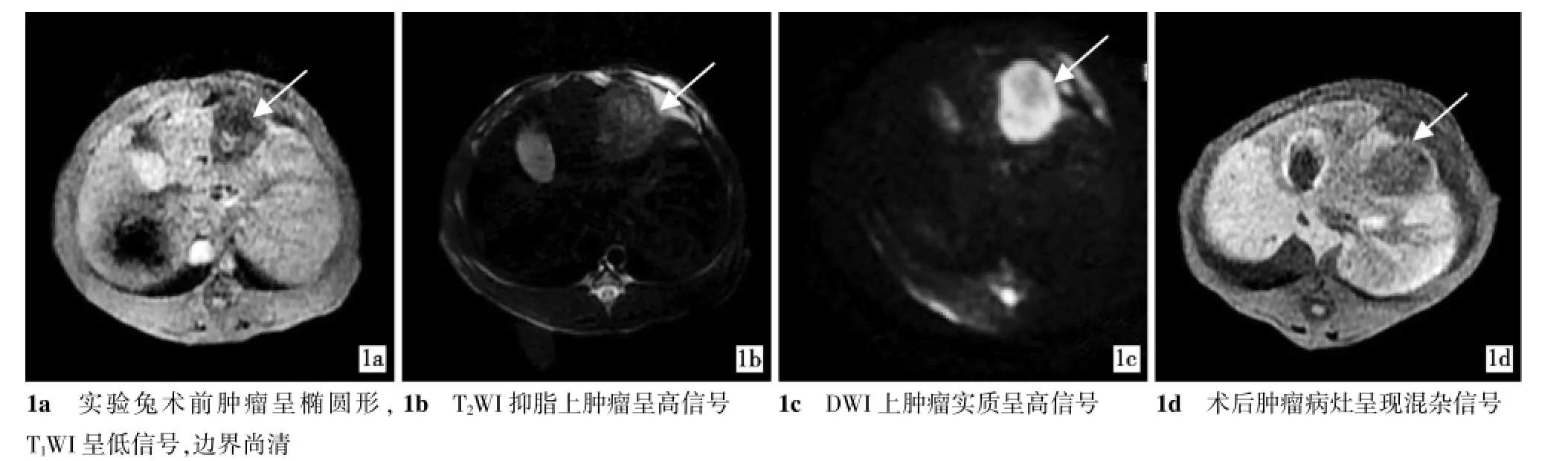
图1 TEA术前、术后肿瘤MRI表现
MRI-DWI图像中测得肿瘤长径及宽径,并计算肿瘤生长率。术前各组肿瘤直径差异无统计学意义(P>0.05)。术后,A、E、F 3组肿瘤体积增大,A组肿瘤生长率明显高于其他各组(P<0.05),B、C、D 3组肿瘤体积缩小,但与肿瘤体积增大的E、F组间差异无统计学意义(P>0.05)。见表1。

表1 术前、术后肿瘤体积及肿瘤生长率的变化(x±s)
2.3 肿瘤MVD
各组MVD表达情况如表2、图2所示,不同容积比例LEM组中,无水乙醇比例与MVD呈负相关(R2=0.840,F=89.432,P<0.01),见图3和表2。
2.4 肿瘤AI
A组肿瘤AI明显低于除B组以外的其他各组(P<0.05),A、B组间差异无统计学意义(P>0.05)。B组与C、F组间差异有统计学意义(P<0.05),其他各组间差异无统计学意义(P>0.05)。见图4和表2。

表2 各组MVD、AI及肝组织损伤情况(x±s)

图2 MVD表达,内皮细胞被染成棕褐色(免疫组化,×400)
2.5 肝组织损伤情况
采用Median Suzuki评分(分期)[4]分别对各组肝组织坏死情况、气球样变及肿瘤周围肝血窦充血情况进行评分并分期,结果如图5所示,不同容积比例的LEM与Median Suzuki评分(分期)行相关性分析,呈正相关(R2=0.954,F=82.376,P=0.001)。见图6和表2。

图3 不同容积比例LEM中,无水乙醇比例与MVD呈负相关
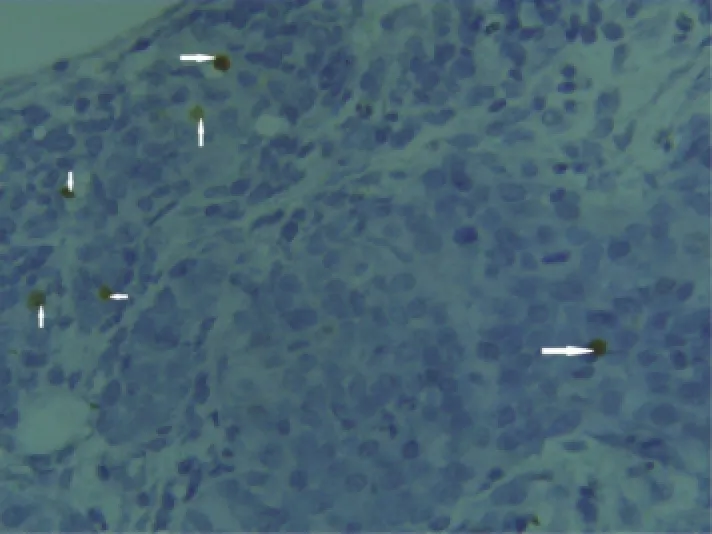
图4 术后7 d,肿瘤凋亡细胞核染成深棕色(箭头)(TUNEL,×400)

图5 肝组织坏死、气球样变及肿瘤周围肝血窦充血情况(HE,×200)
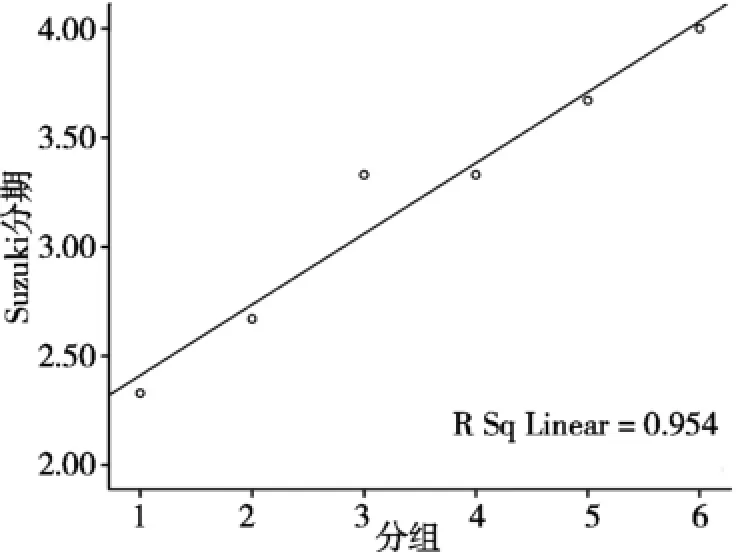
图6 不同容积比例的LEM与Median Suzuki评分(分期)呈正相关
3 讨论
3.1 TEA术的发展史及优势
原发性肝癌是最常见的恶性肿瘤之一。手术切除是治疗早期肝癌的首选方法,但可行手术切除者不到30%。
介入治疗成为不可手术切除患者的主要治疗手段[5],包括经皮穿刺消融和经血管栓塞治疗。经皮无水乙醇化学消融术(percutaneous ethanol injection,PEI)是治疗小肝癌的有效手段之一,其原理是无水乙醇能快速渗入组织并引起组织蛋白变性、凝固,组织脱水,随之纤维化。经肝动脉化疗栓塞(TACE)最常用于不可切除肝癌的初始治疗[6],以碘化油作为栓塞剂,长期随访发现单纯TACE近期效果较好,但远期疗效并不理想。无水乙醇作为一种液态栓塞剂已应用于临床。无水乙醇可破坏血管内皮,导致内皮细胞受损、坏死、甚至脱落,血栓形成引起血管闭塞,最终导致肿瘤组织缺血、坏死。
TEA联合了无水乙醇及碘化油栓塞的双重作用,且无水乙醇与碘油混合后也便于透视下观察栓塞剂的流向,从而避免因栓塞剂反流导致的误栓。Yu等[7]通过二期临床试验证实TEA术是一种安全、有效的治疗不可切除肝癌的方法,其效果优于传统TACE术[8]。
3.2 LEM容积比例的选择
TEA术中碘化油与无水乙醇的最佳浓度比还未达成一致意见。Cheung等[9]研究表明无水乙醇与碘化油容积比例为3∶1时,可有效、安全治疗肝细胞癌。Gu等[10]则认为二者比例为1∶1时效果好。本研究通过比较不同容积比例的LEM治疗兔VX2肝癌动物模型的效果,确定LEM的最佳容积比例。综合分析肿瘤生长率、MVD、AI及肝组织损伤情况,可更全面的判断不同容积比例LEM对肿瘤的疗效。
3.2.1 肿瘤生长率本研究通过测定术前、术后肿瘤体积的变化,即TGR初步判定疗效。其中,A组肿瘤生长率明显高于其他各组,提示由于乙醇浓度较低,对肿瘤灭活作用较差,治疗后肿瘤仍明显生长,效果较差。B、C、D 3组肿瘤体积缩小,表明LEM有效作用于肿瘤组织,抑制肿瘤生长。结合肝损伤结果分析E、F两组,肿瘤体积增大可能源于LEM反流入正常肝组织,从而使进入肿瘤组织的量减少,降低了对肿瘤的杀伤作用,但与B、C、D组间差异无统计学意义,仍能表明LEM可阻断肿瘤血供,破坏肿瘤细胞,减少肿瘤增长速度。
3.2.2 肿瘤MVD MVD被认为是反映肿瘤微血管形成的指标。介入术后,肿瘤组织缺血、缺氧,增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)增加,从而导致VEGF表达升高,它通过刺激血管内皮细胞增殖及增加血管通透性促进肿瘤血管生成,MVD计数增加[11]。本研究中,介入术后,随着LEM中乙醇浓度的增加,MVD呈下降趋势。从而表明高浓度的乙醇更能发挥其作为消融剂的优势,破坏微血管,减少肿瘤新生血管生成。
3.2.3 肿瘤细胞AI已有实验表明,介入治疗不仅引起肝细胞坏死,还可诱导肝细胞凋亡,AI可反映TEA术对肿瘤组织的破坏性[12]。本研究中,A组肿瘤细胞AI明显低于除B组以外的其他各组,A、B组间差异无统计学意义。B组与C、F组间差异有统计学意义,其他各组之间差异无统计学意义,提示高浓度乙醇更能有效诱导细胞凋亡,但其分子机制需进一步探索。
3.2.4 肝损伤情况采用Median Suzuki评分(分期)分别对各组肝组织坏死、气球样变及肿瘤周围肝血窦充血情况进行评分并分期,可判断不同容积比例LEM对正常肝组织的损伤情况。研究表明,A、B两组评分明显低于其他各组,A、B两组安全性较高。分析原因可能为A、B两组碘化油浓度较高,DSA下显影较清晰,能更加有效监测肝内LEM的流动情况,从而防止LEM进入正常肝组织造成损伤。同时,A、B两组乙醇浓度较低,对肝组织的损伤作用较弱。因此,随着乙醇浓度的升高,会引起部分LEM反流入正常肝组织,造成损伤。
本实验的主要缺点为动物样本量不足;同时,因VX2兔肝左动脉较细,所选微导管不能超选择插至肿瘤供血动脉,故当无水乙醇比例较高时导致瘤周肝组织损伤较低无水乙醇组严重。
因此,综合考虑以上各种因素,从安全性方面考虑,碘化油∶无水乙醇的最佳容积比例为2∶1。鉴于随着无水乙醇比例的增加,肿瘤细胞AI增加,肿瘤区MVD减少,所以,如能超选择插管至肿瘤供血动脉,严密透视监视下注射,适当提高无水乙醇比例,疗效会更好。
[1]史东宏,曹建民,许健,等.CT引导下兔VX2肝癌模型的制作及综合评估[J].介入放射学杂志,2008,17:725-728.
[2]江雄鹰,罗荣光,黄金华,等.兔VX2肝癌模型建立与经兔股动脉微导管超选择性肝左动脉插管技术的探讨[J].介入放射学杂志,2011,20:214-217.
[3]Weidner N.Tumour vascularity andproliferation:clear evidence of a close relationship[J].JPathol,1999,189:297-299.
[4]Suzuki S,Toledo-Pereyra LH,Rodriguez FJ,et al.Neutrophil infiltration as an important factor in liver ischemia and reperfusion injury.Modulating effects of FK506 and cyclosporine[J].Transplantation,1993,55:1265-1272.
[5]陈自谦,杨利,杨熙章,等.肝癌介入治疗现状与进展[J].介入放射学杂志,2008,17:223-227.
[6]Vivarelli M,Montalti R,Risaliti A.Multimodal treatment of hepatocellular carcinoma on cirrhosis:an update[J].World J Gastroenterol,2013,19:7316-7326.
[7]Yu SC,Hui EP,Wong J,et al.Transarterial ethanol ablation of hepatocellular carcinomawith lipiodol ethanolmixture:phaseⅡstudy[J].JVasc Interv Radiol,2008,19:95-103.
[8]Yu SC,Hui JW,Hui EP,et al.Embolization efficacy and treatment effectiveness of transarterial therapy for unresectable hepatocellular carcinoma:a case-controlled comparison of transarterial ethanol ablation with lipiodol-ethanolmixture versus transcatheter arterial chemoembolizat[J].JVasc Interv Radiol,2009,20:352-359.
[9]Cheung YC,Ko SF,Ng SH,et al.Survival outcome of lobar or segmental transcatheter arterial embolization with ethanollipiodolmixture in treating hepatocellular carcinoma[J].World J Gastroenterol,2005,11:2792-2795.
[10]Gu YK,Luo RG,Huang JH,et al.Transarterial embolization ablation of hepatocellular carcinoma with a lipiodol-ethanol mixture[J].World JGastroenterol,2010,16:5766-5772.
[11]陈长广,倪才方,陈珑.肝动脉栓塞联合射频消融对兔肝癌模型VEGF及MVD的影响[J].介入放射学杂志,2013,22:936-939.
[12]兰春慧,房殷春,樊丽琳,等.介入治疗对兔VX2肝癌细胞增殖和凋亡的影响[J].临床消化病杂志,2005,17:203-205.
Transhepatic arterial embolization-ablation therapy w ith Lipiodol-ethanolm ixture for the treatment of VX2liver cancer in experimental rabbits
QIAN Ting,CHEN Mao-zhen,GAO Feng,YIN Hua-bin. Department of Radiology,ShanghaiMunicipal Fifth People's Hospital,Shanghai200240,China
YIN hua-bin,E-mail:hbyin1961@126.com
ObjectiveTo determ ine the optimal volumeproportion of iodized oil(Lipiodol)-ethanol mixture by comparing the clinical efficacy of transhepatic arterial embolization-ablation therapy using different volumeproportion of Lipiodol-ethanol mixture in treating experimental rabbitmodels with VX2liver cancer. M ethods VX2tumor was implanted in eighteen adultmale New Zealand white rabbits.The 18 VX2rabbit models were random ly and equally divided into the following six groups according to the Lipiodol-ethanol volume ratio∶groupA(3∶1),groupB(2∶1),groupC(1∶1),groupD(1∶2),groupE(1∶3)and groupF(1∶4).One week after the treatment,all the rabbits were sacrificed and their livers were removed and sent forpathologic examination.The tumor growth rate,the microvascular density,the apoptosis index(AI)of tumor tissues and the injury of the hepatic tissue adjacent to the tumor were evaluated.ResultsA fter the treatment,the tumor's size was increased in groupA,E and F.The tumor growth rate of groupA was significantly higher than thatof the other five groups,and the difference was statistically significant(P<0.05).The tumor's size of groups B,C and D was decreased,although the difference was not significant when compared with the tumor's size of groups E and F(P>0.05).Theproportion of ethanol in Lipiodol∶ ethanolm ixture bore a negative relationshipto themicrovascular density counts(R2=0.840,F=89.432,P<0.001).AI of groupA was strikingly lower than that of groups C,D,E and F(P<0.05).The difference in AI between groupA and groupB was not significant(P>0.05),while the difference inAIbetween groupB and groupC or between groupB and groupFwas statistically significant(P<0.05),and no significant difference in AI existed between each other among other groups(P>0.05).The injury extent of the hepatic tissue adjacent to the tumor in groupA and B was remarkably milder than that of other groups(P<0.05).ConclusionWhen considered in terms of safety,the optimal volumeproportion of Lipiodol-ethanol mixture should be 2∶1.Successful super-selective catheterization of the tumor feeding artery,strict and close fluoroscopic monitoring of the injection andproper increase in theproportion of ethanol can definitely improve the therapeutic efficacy.(JIntervent Radiol,2014,23:706-710)
liver cancer;transarterial ethanol ablation;ethanol;iodized oil;animalmodel
R735.7
B
1008-794X(2014)-08-0706-05
2013-12-02)
(本文编辑:侯虹鲁)
10.3969/j.issn.1008-794X.2014.08.013
上海市闵行区卫生局自然科学研究课题(2011MHZ19)
200240上海市第五人民医院放射科(钱亭、尹化斌);南京医科大学附属淮安第一人民医院放射科(陈茂振);上海中医药大学附属岳阳医院放射科(高峰)
尹化斌E-mail:hbyin1961@126.com