铀酰与多肽和蛋白质相互作用研究进展
刘洋,肖成梁,梅雷,屈国普,石伟群,*
1.南华大学核科学技术学院,湖南衡阳421001;2.中国科学院高能物理研究所,核辐射与核能技术重点实验室,北京100049
铀酰与多肽和蛋白质相互作用研究进展
刘洋1,2,肖成梁2,梅雷2,屈国普1,*,石伟群2,*
1.南华大学核科学技术学院,湖南衡阳421001;2.中国科学院高能物理研究所,核辐射与核能技术重点实验室,北京100049
随着核能事业的快速发展,人们越来越关注锕系核素对生态环境和生物体所造成的影响,其中锕系元素的生物毒理行为正成为核能基础研究热点之一。锕系阳离子与生物分子特别是多肽和蛋白质的相互作用研究对于理解其在生物体内转运、吸收和沉积等基本毒理学问题至关重要。铀作为核燃料循环中主要的锕系元素,其毒理学问题更具研究意义。本文综述了铀酰离子(UO22+)在分子水平上与氨基酸、多肽和蛋白质之间相互作用机理的研究进展。分析了所形成配合物的配位模式、分子结构以及热力学数据等;评价了血浆蛋白对铀在人体内转运、吸收和沉积所起的作用;讨论了能特异性识别UO22+的多肽和蛋白质的设计原理,对本领域今后的发展动向也进行了展望。
铀酰;氨基酸;多肽;蛋白质;相互作用;分子水平
随着核能事业的快速发展、核电产业的迅速增长,对铀的需求量也不断加大。在铀矿开采、核燃料制造、乏燃料后处理和核废物处理与处置等核燃料循环的环节中,放射性核素均有可能在工业活动和地质运动中通过迁移、扩散、转移和转化等途径进入到环境中,从而直接或间接对人居环境和生物体造成严重影响。
对生物体而言,铀不仅具有与放射性比活度相关的放射毒性,且具有重金属的化学毒性。毒理学研究表明:尽管所有铀的同位素及其衰变子体均具有放射性,会对人体器官造成内照射损伤,但铀中毒通常不是放射学效应引起的,而是来自于体内的生物化学相互作用[1]。因此人们普遍认为内污染导致损伤主要是源于铀的化学毒性。铀的化学毒性与其在进入人体途径、价态、体内化合物的形式有密切关系[2]。通常,铀元素进入人体的暴露途径主要有吸入、食入和伤口渗入等。大多数四价铀化合物都不溶于水,水溶液中大多以六价的铀酰(UO22+)形式存在,因此体液中铀主要以UO22+形式存在。在人体血液中铀主要以铀酰盐或者铀酰-蛋白质复合物的形式存在[3],并通过血液循环迅速分布到各组织器官中,如肾脏、骨骼、肝脏和脾脏等。
尽管关于铀与生物体相互作用的研究工作已有大量的文献报道,但是大部分侧重于研究铀在生物体内不同组织中的分布与沉积情况[4-5],以及其毒理效应[6]、促排剂[7]等。人们对UO22+生理毒性的分子机制尚未明确了解。蛋白质是UO22+在生物体内的主要结合分子,但是在分子水平上关于UO22+与多肽及蛋白质相互作用的机理同样还不明确,定量研究UO22+与多肽及蛋白质结合性能的结果还很少。因此,在分子水平上从结构特征及热力学稳定性等因素定量研究铀与氨基酸、多肽和蛋白质的相互作用机理,对于理解铀在生物体内的转运、吸收和沉积的分子机制等基本毒理问题至关重要。同时,该方向的研究将对设计高效低毒的锕系元素阳离子促排药物及研发能特异性结合UO22+的分子并用于铀生物监测和修复亦具有重要的现实意义。
1 UO2+2与多肽相互作用研究
1.1 氨基酸
氨基酸作为构成蛋白质的基本单位,能赋予多肽及蛋白质特定的分子结构形态,使其分子具有生化活性。因此,在分子水平上研究氨基酸与铀的相互作用将为研究多肽及蛋白质等更复杂的生物大分子提供参考依据。
从20世纪50年代开始,UO22+与氨基酸的相互作用研究便已展开,该时期的研究主要关注UO22+与氨基酸配合物的结构,即确定氨基酸是通过氨基还是羧基或者两个基团共同参与UO22+的配位。众所周知,氨基酸属于两性电解质,羧基和氨基都能与UO22+相互作用。而这些功能基团属于Lewis和Bronsted酸碱,其配位形式与pH值相关。氨基酸的氨基和羧基的lg K值分别为9和2。电位滴定的结果显示,在较低的pH值(2~4)下,氨基的质子化作用阻止其与UO22+的络合,而只是通过羧基上的两个氧原子与UO22+双齿配位。pH较高时,氨基去质子作用使得氨基酸的氨基氮原子和羧基氧原子同时参与配位。在几乎所有关于UO22+与氨基酸的研究中都发现羧基基团是比较活跃的UO22+结合位点。Lagrange等[8]通过电位滴定和紫外光谱以及红外光谱证实了多种氨基酸中羧酸和氨基基团同时与UO22+配位。通过晶体学和核磁共振对甘氨酸及其—SH—衍生物与UO22+配合在结构上的研究证实了UO22+更倾向于与羧酸基团配位[9]。不同的侧链基团也可能改变氨基酸与UO22+的配位形式。通过13C NMR结果表明,天冬氨酸(R=—CH2—COO-)的侧链羧基上的氧原子替代氨基与UO22+配位,而半胱氨酸侧链巯基并没有参与配位[10]。这也印证了作为硬受体的铀原子更倾向于与硬氧原子而不是软硫原子配位。侧链基团为脂肪族羟基的丝氨酸和苏氨酸同样也并未发现侧链羟基与UO22+配位[11]。表1总结了文献中已报道的各种氨基酸与UO22+配合物稳定常数值。从表1可以看出,文献中都只考虑了四种配合物的累积稳定常数值,分别为(UO2)LH2+、(UO2)L2H22+、(UO2)L+和(UO2)L02(L为氨基酸);α-氨基酸与UO22+配合物的稳定常数几乎都相同,根据平衡UO22++L=(UO2)L+,形成常数的加权平均值为lg K1=8.4±0.7(I= 0.1 mol/L),其中氨基对该值的贡献为5.8±0.5,羧基为2.6±0.2。
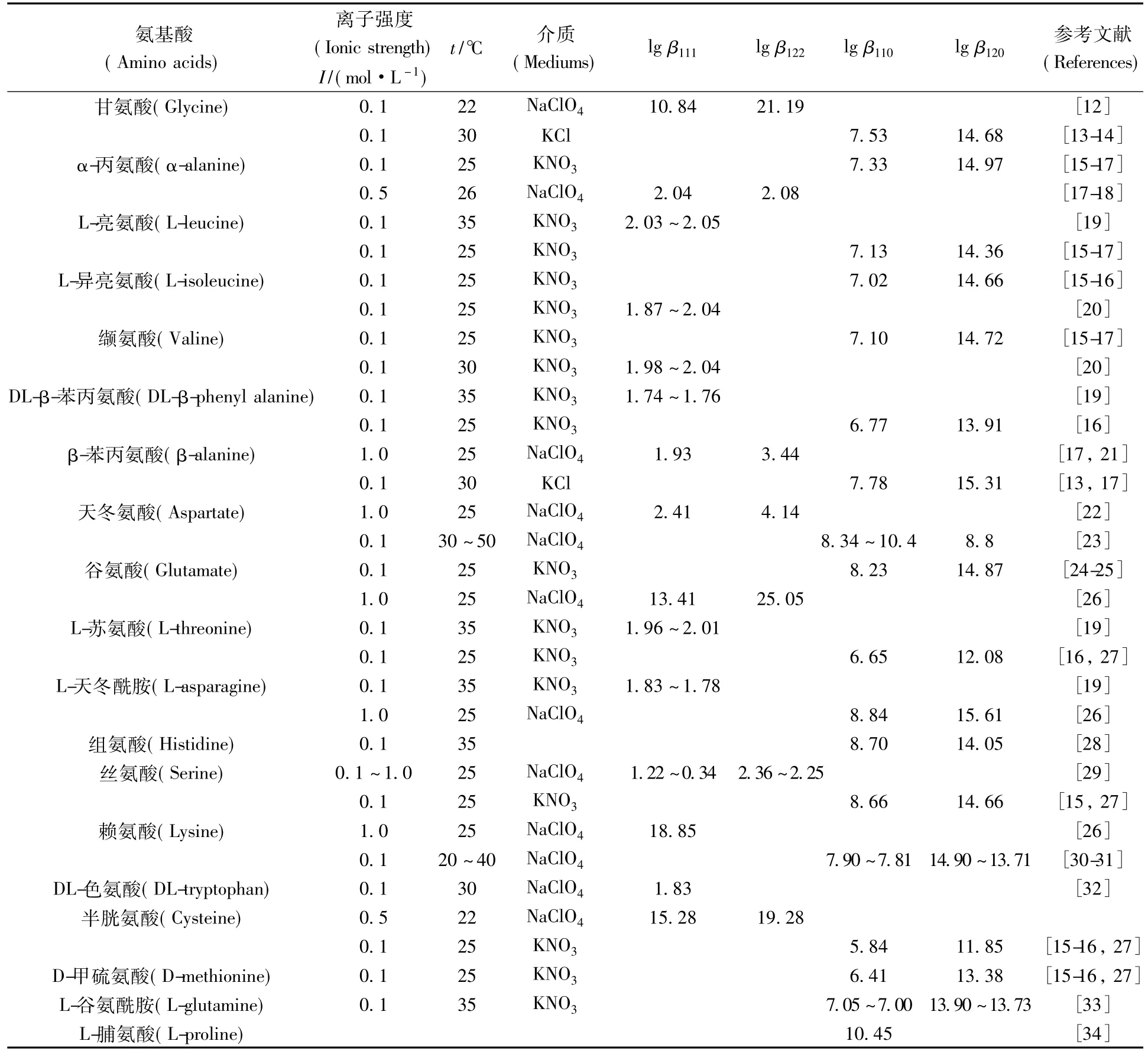
表1UO22+与氨基酸配合物的稳定常数值Table 1Summarized stability constants of uranyl-amino acid complexes
通过对比表1中的UO22+与氨基酸的各种配位行为,UO22+-氨基酸配合物的稳定性主要取决于以下因素:(1)羧酸和氨基基团之间的—CH2—基团的个数和最终形成螯合环尺寸的大小;(2)在氨基酸上α-碳上其它能与UO22+结合基团的数量、种类及所处位置;(3)体系中的pH值、温度、离子强度等条件。
1.2 多肽
在众多能与UO22+相互作用的蛋白质中,除特定的蛋白质外,大部分蛋白质与UO22+的结合都不是特异性的。蛋白质分子往往可以非选择性地结合多个UO22+,形成配合物的稳定性各不相同;而且蛋白质通常具有复杂的四级结构,影响蛋白质与UO22+结合的因素较多,因此要分别确定其结合位点和相应的配合物结构具有相当的难度。一个简化问题的方式就是研究蛋白质片段或模型多肽与UO22+的结合行为和机理,在此基础上设计合成能特异性识别UO22+的多肽。
(1)蛋白质片段多肽
钙调蛋白是真核生物细胞中的胞质溶胶蛋白,每个蛋白分子内有四个钙离子结合位点,其主要功能为根据钙离子浓度的变化来控制细胞内重要的生化反应。Le Clainche等[35]采用草履虫钙调蛋白中具有EF手图像模体的第一钙结合位点作为模版(CaM:EQAEFKEAFAALFDKDGDGTITTKELGTVMRSL),设计合成了含33个氨基酸的模型多肽(CaM-M1c:EQAEFKEAFAALCDKDGDGTITTKELGTCMRSL)。再将该模型多肽的两个天冬氨酸改造为苏氨酸获得对UO22+具有很强结合能力并且具有选择性的新多肽分子(CaM-M3c: EQAEFKEAFAALCTKDGTGTITTKELGTC-MRSL)。时间分辨激光诱导荧光(TRLIF)滴定实验结果显示单体的(CaM-M3c)(UO2)络合物解离常数KD值达到了18 μmol/L。圆二色谱的结果表明结合UO22+后该多肽分子从无规则构象到α-螺旋构象的改变,而钙离子和其它镧系金属离子都不能使其构象改变,这说明CaM-M3c对UO22+具有特异性的结合。该多肽分子在被低浓度UO22+沾污的泉水中仍然表现出对铀酰离子很强的结合能力和选择性,使得该分子有望应用于专门测定低浓度铀污染的生物探针和传感器。磷酸化(phosphorylation)或磷酸化作用,是指在蛋白质或其他类型分子上,加入一个磷酸基团,也可定义成“将一个磷酸基团导入一个有机分子”,此作用在生物化学中占有重要地位。蛋白质磷酸化可发生在许多种类的氨基酸上,其中以丝氨酸为多,其次是苏氨酸和酪氨酸。磷酸化多肽即指通过磷酸化作用后的侧链基团含有磷酸基团的多肽(序列中包含丝氨酸、苏氨酸或酪氨酸)。通常,蛋白质中的羰基、羧基、酚羟基和磷酰基提供氧原子与UO22+配位[36]。对比UO22+配合物结构发现,酚羟基、磷酰基中氧原子与铀原子之间的键长最短,说明磷酰基对UO22+亲和能力较强[37]。自然界中铀酰与磷酸基团天然共存的钙铀云母矿石和具有三脚架结构双磷酸盐的Uranophiles锕系促排药物[38]都印证了该观点。Merroun等[39]则从铀矿废料堆中的球状杆菌JG-A12中发现了磷酸化的蛋白质:卵黄高磷蛋白和S层蛋白。两种蛋白都对UO22+表现出非常好的结合能力,而蛋白中磷酸基团直接参与UO22+的配位。因此可以预见,磷酸基团的引入将大大提高多肽结合UO22+的亲合力。通过调节多肽序列,将多肽进行磷酸化修饰,能达到提高选择性结合UO22+的目的。Pardoux等[40]选取钙调蛋白中其中一个EF-手性结构的钙离子结合位点,对其序列中的苏氨酸进行磷酸化修饰,将其用于研究UO22+的生物毒性。研究结果表明,在pH=6的条件下磷酸化多肽(DKDGDGYITpAAE)与UO22+的结合能力是其对应原多肽(DKDGDGYITAAE)的5倍。在pH=7、即生理pH值条件下,UO22+与磷肽结合的解离常数达到亚纳摩尔量级。通过傅立叶变换红外光谱(FTIR)证实了在该条件下磷酸根基团与UO22+的直接相互作用。因此,在生理条件下,磷酸根基团直接决定了铀酰与蛋白质结合能力。
(2)模型多肽
铀主要沉积在肾脏和骨骼中,放射显影研究发现铀酰离子在骨骼中沉积分布情况与钙离子比较相似,而在一些病例中发现铀在骨骼的生长区域具有很高的浓度。骨桥蛋白是一种磷酸化的、非有序结构的蛋白,其主要功能为调控骨骼的生长。最近研究表明,铀在体内的慢性毒性机理与铀和体内磷酸基团的相互作用有关。骨桥蛋白可能对铀在骨骼中的沉积起到至关重要的辅助作用。Safi等[41]选取骨桥蛋白中金属结合位点处的磷酸化多肽片段“pSDEpSDE(H8V)”作为研究对象,结合热力学、光谱学技术以及理论计算方法在热力学、结构性质方面对该模型磷酸化多肽进行了研究。通过量热滴定及时间分辨荧光技术获得了模型磷酸化多肽H8V与铀酰离子配合物的化学计量比和结合能力以及种态分布。红外光谱直接证实了H8V中磷酸基团参与铀酰离子的配位。密度泛函理论(DFT)计算结合U的L3边扩展X光吸收精细结构谱(extended X-ray absorption fine structure,EXAFS)数据拟合分析表明,磷酸基团的一个氧原子、羧酸基团的两个氧原子以及两分子水与UO22+配位。对比H8V与其原型骨桥蛋白的EXAFS实验结果发现,该模型多肽H8V和骨桥蛋白在pH=5.5的条件下与铀酰的配位环境非常相似。两者如此相似的可能原因在于骨桥蛋白不存在一种明确定义的三级结构,蛋白序列具有很好的柔韧性,而H8V所在区域呈现出不折叠的完全展开的构型。结合上述实验表明该模型多肽能够很好地模拟全长序列的骨桥蛋白。研究人员也推测该蛋白的调节作用为铀在人体中生物矿化的主要原因。因此,更多关于全长骨桥蛋白与UO22+相互作用、以及其对铀在骨骼中沉积所起到的作用值得研究。在生理条件下,当UO22+的浓度在微摩尔量级时,其在血清中的主要存在种态由[UO2(CO3)2]2-+CO23-=[UO2(CO3)3]4-表示。其中结合三个碳酸根的UO22+占主导地位,结合两个碳酸根的UO22+也部分存在于体内。在生理pH和碳酸根浓度下,与UO22+具有中等络合能力的配体都需要与第三个碳酸根离子竞争才能与UO22+形成配合物。Huang等[42]发现多肽DAHK和GGH与UO22+能够形成[UO2(CO3)2Ln]n-2类型的铀酰-碳酸根-多肽的三元配合物。由于这两种多肽上的羧基基团与UO22+结合是非特异性的,其配合物UO2(CO3)2(GGH)和UO2(CO3)2(DAHK)的稳定常数并不高,分别为lg K=2.2±0.4和lg K=3.1± 0.4。该研究结果表明羧酸基团与UO22+的非特异性结合可能是UO22+在血清中输运的一种机制。但并不能排除在血清中有其他蛋白质能与UO22+特异性结合而且配合物还具有高稳定性。鉴于锕系阳离子趋向于与酸性氨基酸配位,Jeanson等[43]还研究了四价锕系阳离子Th(Ⅳ)、Pu(Ⅳ)和Np(Ⅳ)等与模型肽Ac-Asp-Asp-Pro-Asp-Asp-NH2的相互作用。研究发现,pH在生理条件下,以上四价锕系阳离子均可以直接与多肽络合,而不至于产生水解。该模型多肽分子为设计在生理pH条件下能防止UO22+水解并具有较高结合常数的多肽序列提供了借鉴。
上述研究表明:多肽与UO22+的配位可通过多肽序列和磷酸基团的精细调节,提高对UO22+的选择性。多肽本身为生物分子,具有一定的生理活性,将可提高其作用效率并降低其生理毒性。因此,多肽分子是未来理想的锕系促排药物。
1.3 蛋白质
随着人类在基因和蛋白质研究领域的巨大进步,越来越多的研究开始关注锕系阳离子与DNA和蛋白质的相互作用机理。蛋白质是生命体系中的重要分子,它们参与调节各种新陈代谢、信号转导和细胞周期等许多极其重要的生命过程。鉴于蛋白质可能在UO22+在体内转运、沉积、排泄中扮演重要角色,研究UO22+与蛋白质的相互作用机理无疑具有十分重要的意义。而UO22+与氨基酸和多肽相互作用研究则为研究UO22+与分子量更大、结构更复杂的蛋白质相互作用提供基础。
(1)血浆蛋白质
通常受污染的土壤和水源中的铀通过吸入、食入以及皮下渗入等方式进入人体细胞外的环境组织液,组织液中的铀通过体液交换进入血液循环。不管铀以哪种方式进入人体,只有以UO22+形式存在的可溶性铀才能够进入人体的血液循环,其在血浆中的质量浓度约为1 ng/L。进入生物体内后,UO22+的化学种态对其分布、代谢和排泄起着决定性的作用,也使其在不同组织器官上的作用机理和影响效果具有显著差异。UO22+能与很多生物小分子配体形成络合物,从而使铀的种态变得非常复杂,增加研究的困难。相关研究数据表明,在血浆当中UO22+主要与碳酸根(60%)和蛋白质(30%)形成络合物,而剩下的大多被吸附在红细胞上[44]。所以普遍认为UO22+与血浆中的一些蛋白质相结合、并通过血液循环进入到靶器官的细胞当中是一种铀在人体中转运比较合理的机制。因此在分子水平上UO22+与血浆中的蛋白质相互作用的研究具有重要的意义。在众多血浆蛋白质中,具有金属离子输运能力的转铁蛋白和含量最丰富的白蛋白是研究最多的两种蛋白。转铁蛋白(transferrin,Tf),又称运铁蛋白,是血浆中主要的含铁蛋白质。它是由670~700个氨基酸组成的单链糖基化蛋白,分子量为800 kDa左右。转铁蛋白最基本的生理功能为结合和运输三价铁离子,从而控制血液中铁离子含量。晶体结构显示转铁蛋白由两个结构相似的臂组成,分别称为N-臂(N-lobe)和C-臂(C-lobe),两臂之间由一条短肽链相连。每个臂都由两个大小相近的结构域组成,两个结构域相交处便是一个铁结合位点。N-臂和C-臂都有一个铁结合位点,两个铁结合位点的结构也非常相似。三价铁与来自两个酪氨酸的氧原子、一个天冬氨酸的氧原子、一个组氨酸的氮原子以及作为协同阴离子的碳酸根离子上的两个氧原子通过配位键形成八面体的几何构型[45]。每一个结构域移动位置便可使铁结合位点处于开放状态,铁就会被释放出来。转铁蛋白在构象上处于开放或闭合的过程也就是其吸收或释放铁离子的过程。结合两个三价铁离子的转铁蛋白能与转铁蛋白受体(transferrin receptor,TfR)形成稳定的复合物,通过内吞化作用形成内吞小体,内吞小体中的酸性环境使得转铁蛋白释放出铁。转铁蛋白通过其受体介导的胞吞作用是铁进入哺乳动物的主要途径,如图1所示。
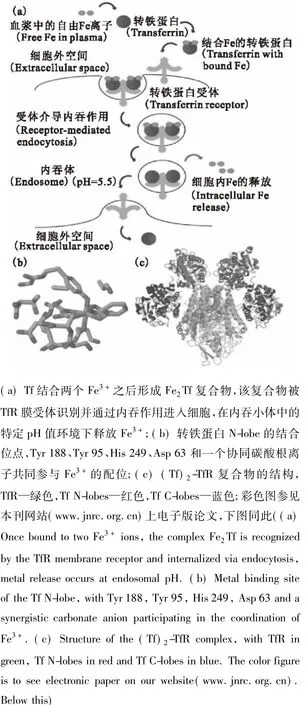
图1 TfR介导细胞内铁的吸收[46]Fig.1TfR-mediated intracellular iron uptake[46]
除了铁,其他的二价或三价金属离子也能结合到转铁蛋白的金属结合位点上。研究表明,锕系金属离子钚、镎、钍和锔都能与转铁蛋白相互作用,且具有较强的结合能力[46-47]。鉴于转铁蛋白可能在锕系阳离子进入人体组织细胞中扮演重要角色,在分子水平上研究UO22+与转铁蛋白之间的相互作用也非常重要。相关工作的早期研究主要关注UO22+与转铁蛋白配合物的稳定常数以及它们之间的化学计量数。Scapolan等[48]采用时间分辨荧光技术研究铀酰离子与转铁蛋白的相互作用。荧光滴定结果表明两者能够形成化学计量比(U/Tf)为2∶1的络合物,并且首次在低铀浓度c(UO22+)=1×10-6mol/L及生理pH条件下,采用非线性回归数学模型得到UO22+与转铁蛋白络合常数为lg K=16。Ansoborlo等[49]综合考虑金属离子的水解常数和转铁蛋白中存在的两个独立的金属结合位点,分别得到了C臂和N臂对UO22+的结合常数为lg K1=14.1和lg K2=12.6。Montavon等[50]则结合时间分辨荧光和紫外光谱发现在生理pH条件下转铁蛋白上两个金属结合位点对UO22+的结合能力并不相同,络合常数分别为lg K1=12.4,lg K2=11.4。在有碳酸根存在的条件下,UO22+会与两个或三个碳酸根形成络合物,然后与转铁蛋白或其它蛋白形成铀酰-转铁蛋白质-碳酸根多元络合物。随着研究技术的不断发展,研究人员更加关注转铁蛋白的结合位点是怎样调整构型以适应铀酰离子的进入、结合了铀酰离子后转铁蛋白结构上发生了哪些变化、蛋白质结构改变后还能不能被受体识别等问题。这些因素都将直接决定铀酰离子能不能像三价铁离子一样被转铁蛋白运输到人体细胞当中。Vidaud等[51]采用紫外可见光谱、红外光谱以及微量渗析的方法发现转铁蛋白金属结合位点中的两个酪氨酸都参与了配位,与三价铁离子不同的是组氨酸并没有参与配位,结构模型示于图2。通过圆二色谱和差示扫描量热技术发现Tf-UO22+络合物的整体结构稳定性弱于Tf-Fe3+。采用标记的方法则发现Tf-UO22+络合物并不能被转铁蛋白受体所识别。其主要原因可能是Tf-UO22+络合物并不像Tf-Fe3+络合物一样呈现闭合构象,而依然呈现开放式构象,从而无法进入细胞。Benavides-Garcia等[52]则采用密度泛函理论(DFT)计算的方法研究了UO22+与转铁蛋白的相互作用以及Tf-UO22
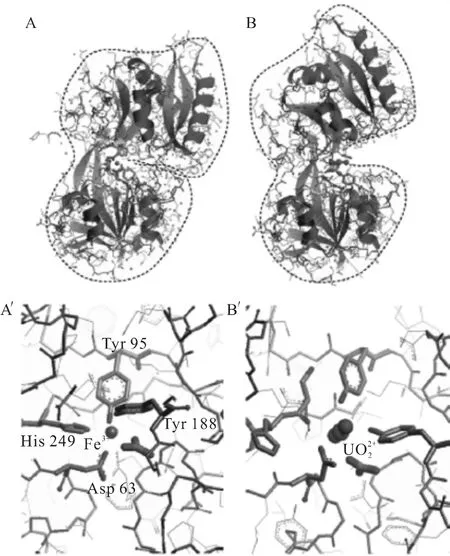
图2 转铁蛋白N-臂结合三价铁(A和A')和铀酰后(B和B')的结构模型[51]Fig.2Structural model of metal binding in Tf,Fe3+N-lobe of transferrin(A and A')and proposed model of uranyl-N-lobe(B and B')[51]
+络合物在结构上的特征。通过优化Tf-UO22+络合物的几何构型以及计算的红外图谱发现UO22+主要与转铁蛋白中结合位点处的两个酪氨酸(Tyr 95和Tyr 188)、一个天冬氨酸还有一个碳酸根离子配位,而组氨酸并未参与配位,这与文献[51]的实验结果相符。另外还发现天冬氨酸和一个酪氨酸之间形成非常强的氢键,该氢键在Tf-UO22+络合物的形成及维持络合物稳定上起到了非常重要的作用。计算得到的拉普拉斯电荷图谱则表明UO22+-转铁蛋白络合物可以同时充当亲核试剂和亲电试剂,可以与不同的受体进一步作用,这可能是铀顺利进入人体不同器官的原因。Mulliken电荷密度图以及3-D密度图则表明Tf-UO22+络合物的形成机制为供体-受体机制。
血清白蛋白是人体血液中含量最为丰富的蛋白质,其质量浓度约为30~50 g/L,约占整个血液中蛋白质的一半,其主要功能为运输脂肪酸。最早关于UO22+与血清白蛋白相互作用的研究始于1948年,Barron等[53]发现UO22+与血清白蛋白之间的相互作用是可逆的,同时会受到碳酸根及柠檬酸根等竞争性配体的影响。Chevari等[54]则采用Shubert-type方法算出在pH=6条件下UO22+与血清白蛋白络合物的稳定常数为lg K=10。采用微量热的方法得到了在pH=5.5条件下白蛋白中高亲和力位点和低亲和力位点分别与UO22+结合的稳定常数达到了K=1.6×107L/mol和K=2.8× 105L/mol[55]。Montavon等[50]同样证实在血浆中UO22+与白蛋白和转铁蛋白都会形成铀酰-蛋白质-碳酸根的多元络合物,同时Ca2+会和UO22+与白蛋白竞争性配位。根据建立的模型计算发现,尽管两种蛋白与UO22+结合能力相似,但与UO22+结合的血浆蛋白中80%是白蛋白,20%是转铁蛋白,其主要原因在于血浆中白蛋白的含量要比转铁蛋白高一个数量级。Yang等[56]则取与人血清白蛋白相似的牛血清白蛋白作为研究对象,采用荧光和全反射傅里叶红外光谱(ATR-FTIR)的方法不仅得到了牛血清白蛋白与UO22+的结合常数,而且发现结合UO22+后蛋白质构象也发生了显著变化。实验结果表明在溶液体系中随着UO22+浓度的增加,蛋白质二级结构中的α-螺旋(α-helix)结构成分不断减少,而β折叠(β-sheets)、翻转及无序缠绕等成分增多,因此可推测结构上的变化可能直接导致白蛋白在生理功能上的变化。
除了转铁蛋白和血清白蛋白外,血浆中是否还有其他蛋白质会与UO22+结合,而这些相互作用会不会更好解释铀在生物体内动力学及毒理学?为了更好地回答这些问题,Vidaud等[57]设计了一种结合时间分辨荧光和蛋白质组学分析的二维色层分析方法来筛选血浆中除了转铁蛋白和血清白蛋白外能与UO22+相互作用的蛋白质,并采用等离子质谱进行确认。结果表明血浆铜蓝蛋白、血色素结合蛋白和另外两种补体蛋白与UO22+结合的化学计量比大于1。然而这四种蛋白质都不是金属蛋白,说明UO22+能通过各种各样的结合位点及配位模式与很多蛋白质发生相互作用。Basset等[58]测得了13种血浆蛋白质与UO22+结合的解离常数,从中发现参与骨骼新陈代谢的胎球蛋白A (fetuin A)表现出对UO22+最强的结合能力。尽管其在血浆中含量较低,但结合了80%的UO22+。考虑到相对浓度,作者认为白蛋白和转铁蛋白都并非血浆中主要的UO22+输运者,而是胎球蛋白A。荧光分析表明胎球蛋白A具有三个UO22+结合位点,其中较强的结合位点的解离常数达到了10 μmol/L。圆二色谱结果显示胎球蛋白A结合UO22+后,其蛋白质二级结构并未发生变化,相应的生理功能也没有发生变化。该研究结果不仅改变了以往认为白蛋白和转铁蛋白是血浆中UO22+的主要输运者的认识,同时也提出了铀从血液到骨骼转运以及在骨骼中沉积的一种可能的新机制。
(2)其他蛋白质
除了血浆蛋白外,其它金属蛋白和磷酸化蛋白也是研究热点。UO22+与金属蛋白的结合与其他金属离子处于竞争关系,蛋白质与何种金属离子结合取决于形成配合物的稳定常数。Michon等[59]对比四种金属蛋白发现,与UO22+结合能力由强到弱依次为转铁蛋白、人血清白蛋白、金属硫蛋白和铁蛋白。Li等[60]采用红外光谱(ATRFTIR)的方法对高度磷酸化蛋白(卵黄高磷蛋白)结合UO22+的行为进行了研究,发现该蛋白对UO22+表现出非常强的结合能力。蛋白质中的磷酸基团对UO22+具有较高的亲和性。Brown等[61]亦发现UO22+可以选择性识别α-酪蛋白、卵白蛋白和β-酪蛋白的磷酸化位点,并且利用UO22+的光学特性对以上蛋白进行了光致切割。最值得关注的是: Wegner等[62]采用基因突变技术,针对UO22+赤道面的配位特性,对镍离子结合蛋白NikR进行了特殊改造。NikR是nikABCDE镍离子吸收系统的转录因子,如图3(a)所示。在该结合位点的基础上,将76位的组氨酸和96位的半胱氨酸突变为既能作为单齿配体又能作为双齿配体的天冬氨酸以满足UO22+赤道平面配位数的要求。同时将72位的缬氨酸变为丝氨酸,这样丝氨酸上的羟基有可能与UO22+上一个氧原子形成氢键,从而增强蛋白质与UO22+的结合能力(图3(b)所示)。突变后的蛋白质在和二甘醇酸与UO22+的竞争性络合实验表明,突变后的NikR’与UO22+的结合能力是二甘醇酸的50多倍,其解离常数为10-7.27±0.20mol/L。EXAFS结果表明两个组氨酸和两个天冬氨酸的残基都参与配位。实验结果也表明只有结合了UO22+的NikR’蛋白才能与DNA形成蛋白质-DNA的络合物,而其它二价金属Ni2+、Zn2+、Co2+、Cu2+、Gd2+、Mn2+和Fe2+与该蛋白结合后都不能被DNA识别。该现象表明突变后的NikR蛋白表现出对UO22+的特异性结合。基于对铀酰离子配位特性的了解,可以通过改变蛋白质骨架来选择性结合UO22+,为设计具有高效选择性结合锕系阳离子的蛋白质提供了重要的借鉴意义。基于该理念,Zhou等[63]发展了能在蛋白质数据库(protein data bank(PDB))中筛选出具有潜在UO22+结合位点蛋白质的程序(URANTEIN),并利用该程序发现了甲烷杆菌体内一个功能未知的蛋白质具有较强UO22+结合能力,并针对UO22+的配位特性对该蛋白进行改造从而得到了具备良好的热稳定性和超强UO22+结合能力的超级铀酰结合蛋白(super uranyl-binding protein(SUP))。SUP-UO22+配合物晶体结构如图4所示,研究发现,SUP对UO22+有优越的选择性,能提取模拟海水中30%~60%的UO22+并能反复使用。该研究对理解UO22+与蛋白的作用机制以及利用生物技术进行海水提铀均具有重要意义,为今后锕系元素结合蛋白的设计合成指明了方向。
图3 镍(Ⅱ)-响应转录因子(NikR)[62]Fig.3Nickel(Ⅱ)-responsive transcriptional regulator(NikR)[62]

图4 超级铀酰结合蛋白SUP的晶体结构[63]Fig.4Uranyl-SUP crystal structure[63]
2 结论与展望
核能的快速发展及公众对于核安全的日益重视,使得作为重要核材料的铀对于人体健康的影响倍受关注。在分子水平上对铀与生物分子的相互作用研究是铀在人体内的转运、沉积机制及毒理和解毒机制研究的基础,对锕系元素生物毒理学、锕系元素配位化学、锕系元素促排药物的研发以及核环境安全均具有重要的现实意义。
本文综述了在分子水平上定量分析UO22+与氨基酸、多肽和蛋白质相互作用的研究进展。主要结论如下:(1)由于氨基酸分子结构较为简单,其与UO22+相互作用的研究已较为系统,为研究多肽及蛋白质等大分子奠定了基础;(2)适当选取蛋白质金属结合位点处多肽片段能够较好地模拟蛋白质与UO22+的相互作用;合理地设计氨基酸序列和恰当引入磷酸基团能使模型多肽达到特异性结合UO22+的效果;(3)在众多血浆蛋白质中,转铁蛋白、白蛋白和胎球蛋白A均表现出对UO22+较强的结合能力,都是血液中可能的UO22+输运者;运用基因技术改造蛋白质金属结合位点同样能使其达到特异性结合UO22+的效果而不改变蛋白质生理功能。总的来说,在分子水平上定量研究铀与特定生物分子相互作用研究仍处于起步阶段,还有大量科学问题有待解决,而设计合成专门针对UO22+的多肽和蛋白质类的生物探针、促排药物及细胞内或体内UO22+与生物分子相互作用研究将是未来分子水平上生物分子与UO22+确称取一定量相互作用研究的发展方向。
[1]Taylor D M,Taylor S K.Environmental uranium and human health[J].Rev Environ Health,1997,12 (3):147-158.
[2]Brugge D,de Lemos J L,Oldmixon B.Exposure pathways and health effects associated with chemical and radiological toxicity of natural uranium[J].Rev Environ Health,2005,20(3):177-194.
[3]Eidson A F.The effect of solubility on inhaled uranium compound clearance[J].Health Phys,1994,67 (1):1-14.
[4]Kurttio P,Komulainen H,Leino A,et al.Bone as a possible target of chemical toxicity of natural uranium in drinking water[J].Environ Health Perspectives,2005,113(1):68-72.
[5]Vidaud C,Bourgeois D,Meyer D.Bone as target organ for metals:the case of f-elements[J].Chem Res Toxicol,2012,25(6):1161-1175.
[6]Kurttio P,Auvinen A,Salonen L,et al.Renal effects of uranium in drinking water[J].Environ Health Perspectives,2002,110(4):337-342.
[7]Durbin P,Kullgren B,Xu J,et al.Development of decorporation agents for the actinides[J].Radiat Prot Dosimetry,1998,79(1-4):433-443.
[8]Lagrange P,Schneider M,Lagrange J.Complexes of oxovanadium(Ⅳ),dioxovanadium(Ⅴ)and dioxouranium(Ⅵ)with aminoacids in aqueous solution[J].J Chim Phys Phys-Chim Biolog,1998,95(10):2280-2299.
[9]Keramidas A,Rikkou M,Drouza C,et al.Investigation on uranyl interaction with bioactive ligands:synthesis and structural studies of the uranyl complexes withglycineandN-(2-mercaptopropionyl) glycine[J].Radiochim Acta,2002,90(9-11/2002): 549-554.
[10]Gharib F,Shamel A,Lotfi F.Ionic strength dependence of formation constants,complexation of glycine with dioxouranium(Ⅵ)ion[J].Rev Inorg Chem,2005,25(4):361-372.
[11]Moll H,Bernhard G.Complex formation of curium(Ⅲ) with amino acids of different functionalities:L-threonine and O-phospho-L-threonine[J].J Coord Chem,2007,60(16):1795-1807.
[12]Günther A,Geipel G,Bernhard G.Complex formation of uranium(Ⅵ)with the amino acids L-glycine and L-cysteine:a fluorescence emission and UV-Vis absorption study[J].Polyhedron,2007,26(1):59-65.
[13]Cefola M,Taylor R C,Gentile P S,et al.Coordination compoundsⅢ:chelate compounds of the uranyl ion with hydroxy,mercapto,and amino acids[J].J Phys Chem,1962,66(5):790-791.
[14]Kiss T,Sovago I,Gergely A.Critical survey of stability constants of complexes of glycine[J].Pure Appl Chem,1991,63:597-638.
[15]Nourmand M,Meissami N.Complex formation between uranium(Ⅵ)ion and some[alpha]-aminoacids[J].Polyhedron,1982,1(6):537-539.
[16]Nourmand M,Meissami N.Complex formation between uranium(Ⅵ)and thorium(Ⅳ)ions with some[small alpha]-amino-acids[J].J Chem Soc Dalton Trans,1983(8):1529-1533.
[17]Sovago I,Kiss T,Gergely A.Critical survey of the stability constants of complexes of aliphatic amino acids[J].Pure Appl Chem,1993,65(5):1029-1080.
[18]Dongre V G,Dhuley D G.Polarographic study of uranyl-amino acids complexesⅠ:U(Ⅵ)in glycine DL-α and β-alanines and histidine[J].Curr Sci,1980,49(8):305-307.
[19]Bapna R,Vyas P C,Arora M,et al.Solution complexation of aminoacidate zwitter ion with uranyl(Ⅵ): electrophoresis and pH-metric studies[J].Asian J Chem,1997,9(4):592-897.
[20]Vyas P C,Arora M,Oza C K,et al.Paper electrophoretic investigations of diocouranium(Ⅵ)-amino acid complexes[J].J Electrochem,1988,4(5): 509-511.
[21]Bismondo A,Rizzo L,Di Bernardo P,et al.Uranyl(Ⅵ) complexes of 3-aminopropanoic acid and 4-aminobutanoic acid in aqueous solution:a potentiometric and calorimetric study[J].J Chem Soc Dalton Trans,1987(4):695-698.
[22]Bismondo A,Rizzo L.Thermodynamic properties of actinide complexes:uranyl(Ⅵ)-and thorium(Ⅳ)-aspartate systems[J].Polyhedron,1989,8(18): 2233-2236.
[23]Triverdi C P,Mathur P N,Sunar O P.Thermodynamics and stability constants of uranium-aspartic acid complex[J].J Indian Chem Soc,1971,48:270-272.
[24]Girdhar H L,Parveen S,Puri M K.Stability constants of glutamic acid complexes with some metal ions[J].Indian J Chem,1976,14A:1021-1022.
[25]Van Horn J D,Huang H.Uranium(Ⅵ)bio-coordination chemistry from biochemical,solution and protein structural data[J].Coord Chem Rev,2006,250: 765-775.
[26]Lagrange P,Schneider M,Lagrange J.Complexes of oxovanadium(Ⅳ),dioxovanadium(Ⅴ)and dioxouranium(Ⅵ)with aminoacids in aqueous solution[J].J Chim Phys,1998,95:2280-2299.
[27]Berthon G.Critical evaluation of the stability constants of metal complexes of amino acids with polar side chains[J].Pure Appl Chem,1995,67(7):1117-1240.
[28]Singh S,Gupta D,Yadava K L.Ionophoretic technique in the study of mixed complexes(M-nitrilotriacetate-histidinate systems)[J].Electrochim Acta,1985,30:223-227.
[29]Gharib F,Farajtabar A.Interaction of dioxouranium (Ⅵ)ion with serine at different ionic strengths[J].J Mol Liq,2007,135(1-3):27-31.
[30]Sharma U.Stepwise stability constants of uranyl(Ⅱ) and thorium(Ⅳ)complexes of L-lysine monohydrochloride[J].Thermochim Acta,1986,101:381-383.
[31]Yamauchi O,Odani A.Stability constants of metal complexes of amino acids with charged side chains partⅠ:positively charged side chains[J].Pure Appl Chem,1996,68(2):469-496.
[32]Ramanujam V V,Rengaraj K.Study on uranyl complexes PartⅢ:potentiometric investigation of uranylamino acid complexes[J].Indian J Chem,1980,19 (A):382-384.
[33]Sekhon B S,Chopra S L.Studies on the formation of complexes of glutamine with Y(Ⅲ),La(Ⅲ),Ce(Ⅲ)and U(Ⅵ)[J].Indian J Chem,1974,12: 1322-1325.
[34]Farooq O,Malik A U,Ahmad N,et al.Studies on the composition and stability of uranyl,vanadyl and titanous complexes with some aminoacids[J].J Electroanal Chem Interf Electrochem,1970,24(2-3):464-467.
[35]Le Clainche L,Vita C.Selective binding of uranyl cation by a novel calmodulin peptide[J].Environ Chem Lett,2006,4(1):45-49.
[36]Pible O,Guilbaud P,Pellequer J-L,et al.Structural insights into protein-uranyl interaction:towards an in silico detection method[J].Biochimie,2006,88 (11):1631-1638.
[37]Pible O,Vidaud C,Plantevin S,et al.Predicting the disruption by UO22+of a protein-ligand interaction[J].Protein Sci,2010,19(11):2219-2230.
[38]Sawicki M,Siaugue J M,Jacopin C,et al.Discovery of powerful uranyl ligands from efficient synthesis and screening[J].Chem-Eur J,2005,11(12):3689-3697.
[39]Merroun M L,Raff J,Rossberg A,et al.Complexation of uranium by cells and S-layer sheets of Bacillus sphaericus JG-A12[J].Appl Environ Microbiol,2005,71(9):5532-5543.
[40]Pardoux R,Sauge-Merle S,Lemaire D,et al.Modulating uranium binding affinity in engineered calmodulin EF-hand peptides:effect of phosphorylation[J].Plos One,2012,7(8):e41922.
[41]Safi S,Creff G,Jeanson A,et al.Osteopontin:a uranium phosphorylated binding-site characterization[J].Chem-Eur J,2013,19(34):11261-11269.
[42]Huang H,Chaudhary S,Van Horn J D.Uranyl-peptide interactions in carbonate solution with DAHK and derivatives[J].Inorg Chem,2005,44(4):813-815.
[43]Jeanson A,Berthon C,Coantic S,et al.The role of aspartyl-rich pentapeptides in comparative complexation of actinide(Ⅳ)and iron(Ⅲ):Part 1[J].New J Chem,2009,33(5):976-985.
[44]Stevens W,Bruenger F,Atherton D,et al.The distribution and retention of hexavalent233U in the beagle[J].Radiat Res,1980,83(1):109-126.
[45]Sun H,Li H,Sadler P J.Transferrin as a metal ion mediator[J].Chem Rev,1999,99(9):2817-2842.
[46]Sturzbecher-Hoehne M,Goujon C,Deblonde G J-P,et al.Sensitizing curium luminescence through an antenna protein to investigate biological actinide transport mechanisms[J].J Amer Chem Soc,2013,135(7): 2676-2683.
[47]Taylor D M.The bioinorganic chemistry of actinides in blood[J].J All Comp,1998,271:6-10.
[48]Scapolan S,Ansorborlo E,Moulin C,et al.Uranium (Ⅵ)-transferrin system studied by time-resolved laserinduced fluorescence[J].Radiat Prot Dos,1998,79 (1-4):505-508.
[49]Ansoborlo E,Prat O,Moisy P,et al.Actinide speciation in relation to biological processes[J].Biochim,2006,88(11):1605-1618.
[50]Montavon G,Apostolidis C,Bruchertseifer F,et al.Spectroscopic study of the interaction of U(Ⅵ)with transferrin and albumin for speciation of U(Ⅵ)under blood serum conditions[J].J Inorg Biochem,2009,103(12):1609-1616.
[51]Vidaud C,Gourion-Arsiquaud S,Rollin-Genetet F,et al.Structural consequences of binding of UO22+to apotransferrin:can this protein account for entry of uranium into human cells?[J].Biochem,2007,46(8): 2215-2226.
[52]Benavides-Garcia M G,Balasubramanian K.Structural insights into the binding of uranyl with human serum protein apotransferrin structure and spectra of proteinuranyl interactions[J].Chem Res Toxicol,2009,22 (9):1613-1621.
[53]Barron E G,Muntz J A,Gasvoda B.Regulatory mechanisms of cellular respiration I:the role of cell membranes:uranium inhibition of cellular respiration[J].J Gen Physiol,1948,32(2):163-178.
[54]Chevari S,Likhner D.Complex formation of natural uranium in blood[J].Med Radiol,1968,13(8):53-57.
[55]Duff M R,Kumar C V.Site-selective photocleavage of proteins by uranyl ions[J].Angew Chem,Int Ed,2006,45(1):137-139.
[56]Yang Y,Feng Y,Wang Y,et al.Interactions between U(Ⅵ)and bovine serum albumin[J].J Radioanal Nucl Chem,2013,298(2):903-908.
[57]Vidaud C,Dedieu A,Basset C,et al.Screening of human serum proteins for uranium binding[J].Chem Res Toxicol,2005,18(6):946-953.
[58]Basset C,Averseng O,Ferron P-J,et al.Revision of the biodistribution of uranyl in serum:is fetuin-A the major protein target?[J].Chem Res Toxicol,2013,26(5):645-653.
[59]Michon J,Frelon S,Garnier C,et al.Determinations of uranium(Ⅵ)binding properties with some metalloproteins(transferrin,albumin,metallothionein and ferritin)by fluorescence quenching[J].J Fluorescence,2010,20(2):581-590.
[60]Li B,Raff J,Barkleit A,et al.Complexation of U(Ⅵ)with highly phosphorylated protein,phosvitin: a vibrational spectroscopic approach[J].J Inorg Biochem,2010,104(7):718-725.
[61]Brown A K,Liu J,He Y,et al.Biochemical characterization of a uranyl ion-specific DNAzyme[J].Chem Bio Chem,2009,10(3):486-492.
[62]Wegner S V,Boyaci H,Chen H,et al.Engineering a uranyl-specific binding protein from NikR[J].Angew Chem,Int Ed,2009,48(13):2339-2341.
[63]Zhou L,Bosscher M,Zhang C,et al.A protein engineered to bind uranyl selectively and with femtomolar affinity[J].Nat Chem,2014,6(3):236-241.
Recent Research Progress of Interactions Between Uranyl Ions and Peptides/Proteins
LIU Yang1,2,XIAO Cheng-liang2,MEI Lei2,QU Guo-pu1,*,SHI Wei-qun2,*
1.School of Nuclear Science and Technology,University of South China,Hengyang 421001,China; 2.Key Lab of Nuclear Radiation and Nuclear Technology,Institute of High Energy Physics,Chinese Academy of Sciences,Beijing 100049,China
With the rapid development of nuclear energy industry,the bio-toxicities of actinides have drawn more and more attention with respect to their potential harmful effects on ecological environment and bio-organisms.Studying the interaction mechanisms of actinide cations with biomolecules,especially peptides or proteins,can provide useful information in molecular level for understanding the transportation,absorption and deposition pathways of actinides in vivo.Uranium,as a central actinide in nuclear fuel cycle,deserves more research endeavors.In this work,recent progresses about the interaction mechanisms between uranyl(UO22+)and amino acids,peptides and proteins are reviewed.The coordination modes,molecular structures and thermodynamic data of UO22+-peptide complexes are selectively highlighted.The possible roles of the plasma proteins playin UO22+transportation,absorption and deposition are discussed.In addition,the basic principles for designing UO22+specific binding peptides and proteins are presented.
uranyl;amino acid;peptide;protein;interactions;molecular level
Q506
A
0253-9950(2014)03-0129-11
10.7538/hhx.2014.36.03.0129
2013-12-06;
2014-04-01
国家自然科学基金资助项目(11275219)
刘洋(1989—),男,四川成都人,硕士研究生,辐射防护及环境保护专业
*通信联系人:屈国普(1964—),男,湖南衡阳人,教授,从事核辐射探测方法研究,E-mail:quguopu@usc.edu.cn石伟群(1976—),男,湖北黄梅人,博士,副研究员,从事核能放射化学研究,E-mail:shiwq@ihep.ac.cn

