羰基硫和醇胺溶液反应机理及反应动力学研究进展
柯 明,陈 冬,冯 琪,宋昭铮
[中国石油大学(北京) 重质油国家重点实验室,北京 102249]
1867年,人们第一次发现了羰基硫(COS),通常状态下是有臭鸡蛋气味的无色气体。结构与CS2和CO2类似,分子为直线型,1个碳原子以2个双键分别与氧原子和硫原子相连。COS不仅对人体有害,还会腐蚀工业生产设备,并且使催化剂中毒,在甲烷合成以及炼油尾气处理过程中这种情况尤其严重。CO2可以降低气相热值,H2S和COS会腐蚀管道,故天然气在运输前需要预先除去这些酸性气体。酸性气体脱除方法中化学反应吸收是优先选择的方法,吸收剂优先采用乙醇胺、二乙醇胺、甲基二乙醇胺以及哌嗪活化的甲基二乙醇胺[1]。
从含大量CO2的气体混合物中选择性吸收硫化物已经引起了学术界和化工行业的关注。H2S和伯胺仲胺叔胺溶液的反应均是瞬时反应,而CO2和COS与醇胺溶液的反应相对较慢。这其中CO2和醇胺反应的动力学已经得到广泛的研究,而COS和醇胺溶液的反应动力学研究并不多,也没得到汇总。作者综述了最近的科研成果,汇总了COS与醇胺的反应机理以及反应动力学相关研究,弥补了关于这方面的空白。
1 COS和醇胺溶液反应机理研究
1.1 两性离子反应机理
COS和CO2结构相近,各方面性质也类似,故COS与伯胺、仲胺的反应机理可以类比CO2的两性离子反应机理,其反应机理如下。
(1)
(2)
AmH为反应的伯仲胺;AmH+COS-为两性离子;B为B碱;k1为方程(1)的正向反应速率常数,m3/kmol·s;k-1为方程的逆向反应速率,s-1;kB为方程(2)的速率常数,m3/kmol·s。
方程(1)代表两性离子的生成,两性离子为中间产物。方程(2)代表的是两性离子去质子化反应。溶液中的所有B碱都可以使得两性离子发生去质子化反应生成硫代氨基甲酸盐。文献[2-5]都采用了这个机理来描述COS和伯仲胺的反应。
假设两性离子是一种中间产物,并且浓度极低可以迅速达到稳态值,则COS的反应速度可以用下式表示。
式中c(COS)为溶液中COS浓度;c(AmH)为溶液中醇胺的浓度。
kB(B)为两性离子被水、氢氧根离子或醇胺等碱液去质子化反应的速率常数,溶液中氢氧根离子浓度较低,其对两性离子去质子化反应的影响有限。
kB(B)=kAmHc(AmH)+kH2Oc(H2O)
总速率方程式变为如下形式。
1.2 三分子反应机理
COS水解过程如下。
(3)
文献[6-8]研究提出了CO2与液态醇胺反应的三分子机理,这个机理也可以用来解释硫代氨基甲酸盐的形成。机理假设醇胺同时与一分子的COS和碱反应,反应通过很多中间产物进行。该反应过程可以表述如下。
(4)
这个复杂的反应形成了反应物分子,同时小部分的反应物与第二个醇胺分子或一个水分子接着反应从而形成离子形态的产物。kobs值通过下式给出。
kobs=[kH2Oc(H2O)+kAmHc(AmH)]c(AmH)
总的反应速率可以表示如下。
r=kobsc(COS)
1.3 碱催化水解反应机理
叔胺和COS的反应通过碱催化水解反应机理来描述[9]。这个机理表明了叔胺对COS水解的影响。反应过程可以表述如下。

(5)
这个反应机理与先前Donaldson和Nguyen[10]提出的CO2与COS反应机理类似。除此之外,通过Littel的研究[11],产物会继续发生如下的反应。

(6)
2 COS和醇胺溶液反应动力学研究
2.1 伯胺的反应动力学相关研究
早期装置都以单乙醇胺(MEA)做溶剂,其化学反应活性好,能同时脱掉H2S和CO2,但选择性较差,再生温度高,酸气负荷低,另MEA有很高的COS反应活性[12]。然而,COS与MEA的反应是不可逆的,会生成降解产物[2]。Littel[5]详细研究了COS与MEA的反应,并用两性离子反应机理很好的解释了COS与MEA反应的动力学特征。MEA与COS反应的反应级数在1和2之间。水和MEA对两性离子去质子化有非常重要的作用。MEA和水在常温下(10~60 ℃)的两性离子反应速率常数如下。
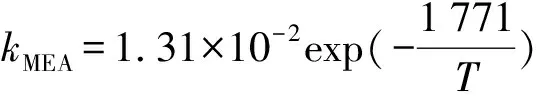

Lee[13]更深入的研究了COS-MEA系统反应动力学。总的反应速率对COS来说是一级的,对MEA来说是二级的,因而推断出两性离子去质子化反应是速率控制步骤。这个机理可用下式表示。
r=k3c(COS)c(MEA)2


Sharma[14]研究得到的MEA表观一级反应速率为16 s-1,所用的c(MEA)=1 kmol/ m3,温度为25 ℃,Lee[13]通过研究发现MEA的反应速率为15.1 s-1,和Sharma的研究结果类似。MEA反应级数取决于两性离子形成和去质子化反应哪个是速率控制步骤。
二甘醇胺(DGA)是一种伯胺,其脱除COS的效果也得到了广泛的研究。钟寿仁[15]提出了DGA使用上的几大优点:吸收能力强、蒸汽压较低、处理气体气相损失小、凝固点较低适用于严寒地区、DGA与H2S和CO2反应热高,循环量和流量要求较低。
Singh和Bullin[16]通过研究发现,反应中DGA是一级反应,总反应级数为2。300 K时,二级反应速率常数达到了2.3 m3/kmol·s。Sharma[14]和Rahman[17]发表了COS-DGA反应的二级反应动力学,其得到的反应速率常数要大得多(166 m3/kmol·s)。Littel[5]发表的速率常数为分数(1和2之间)。学者一致结论是两性离子去质子化反应为速率控制步骤。对于去质子化过程,DGA和水的速率常数如下(283~333 K)。
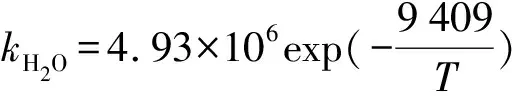
Moore经研究提出了DGA与COS的反应过程如下。
(7)
反应的中间物BHEEU通过水解能够重新生成DGA,使得DGA得到再生。再生过程发生的反应如下。

(8)
2.2 仲胺的相关动力学研究
工业中酸气处理常用的仲胺主要包括二异丙醇胺(DIPA)和二乙醇胺(DEA)。Shell的Sulfinol工艺过程中DIPA被用作物理溶剂[1]。DIPA的优点是再生容易无腐蚀性。Littel[5]研究了COS-DIPA和COS-DEA反应的动力学(283~333 K)。研究发现,醇胺的反应级数为2,总反应级数为3。DEA和水对去质子化反应速率的影响如下:
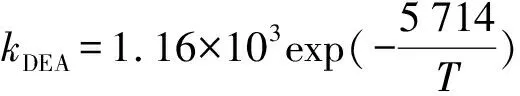
DEA和DIPA的一级表观反应速率常数分别为7.6和3.5 s-1(243 K,1 kmol/m3)。Rahman[17]发现MEA、DEA和DIPA在298 K温度下反应的二级反应速率常数分别为16、11和6 m3/kmol·s。
Hinderaker和Sandall[18]用一氧化二氮模拟COS分子在醇胺溶液中的溶解和扩散情况,通过相关实验研究了DEA水溶液(质量分数5%~25%)中COS的动力学特征,并用两性离子机理解释了其动力学数据。两性离子去质子化过程认为是速率控制步骤。通过进一步的研究发现,去质子化反应中DEA的反应级数为2。COS-DEA体系的反应速率常数比CO2-DEA低2个数量级。反应速率方程如下。
r=k3c(COS)c(DEA)2
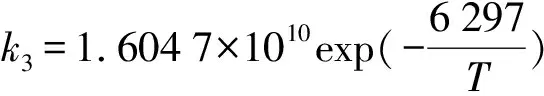
Amararene和Bouallou[19]研究了COS-DEA反应体系在313~353 K温度下DEA质量分数在5%~40%范围内的动力学特征。k3由下式决定:

Amararene和Bouallou[19]通过研究发现该反应的活化能为48.1 kJ/mol,Hinderaker和Sandall[18]对该反应的活化能同样进行了相关的研究,实验结果为52.35 kJ/mol。去质子化反应速率常数如下。
N-甲基单乙醇胺(MMEA)也是一种仲胺,Littel[5]报道的MMEA反应级数为1.8。由于其MMEA的碱性较强,故MMEA溶液和COS反应的总的反应速率比MEA、DGA、DEA和DIPA溶液都高。
2.3 叔胺的相关动力学研究
20世纪80年代以来,甲基二乙醇胺(MDEA)才逐渐进入工业应用,往MDEA水溶液添加某些醇胺类、物理类添加剂,可以提高有机硫的脱除率,最高达61%,但w(总硫)要降至(90~135)×10-6则较困难。
Al-Ghawas[20]研究了叔胺MDEA和COS的反应动力学。COS在MDEA溶液的反应速率低于CO2的。文献中提及的温度为298K下二级速率常数为0.90 m3/mol·s。MDEA溶液浓度控制为1.26~2.6 kmol/m3,反应温度控制为293~313 K反应条件下的反应速率常数如下。
但是Alper[21]通过实验得到的kobs比Al-Ghawas报道的要低10倍。
Littel[11]通过实验得到的COS-MDEA反应速率常数比Al-Ghawas报道的要小30倍[9]。Littel[11]通过实验(298~348 K)得到的速率常数方程式如下。

Amerarene和Bouallou[19]研究了313K~353K温度下,MDEA质量分数在5%~50%的COS-MDEA反应动力学。他们报道的反应活化能和Littel报道的一致。近期,Rivera-Tinoco和Bouallou[22]提出了液相MDEA溶液中COS反应的动力学模型,经研究得到的速率常数与Littel研究得到的相近[11]。
3 结束语
COS和醇胺溶液反应特点为:相对其它类型的醇胺溶液,伯胺和COS反应要快得多,但会发生不可逆的降解,仲胺溶液脱除COS的效果没有那么明显,但是降解较少[12],MDEA对COS的反应活性很低。对于传统的伯胺和仲胺来说,COS选择性脱除可以通过使用更高浓度的醇胺溶液或者更高的反应温度来实现[5]。通过其它种类醇胺的相关研究发现MMEA和AEEA比MEA、DGA、DEA和DIPA的反应活性高,是潜在的COS选择性脱除剂,然而MMEA也许和COS形成降解产物。因而,需要更多的实验去研究这些COS吸收剂的效果。另外一方面的研究集中到了混合醇胺溶液,叔胺本身反应速率低,但叔胺和伯仲胺混合可以提升COS的脱除效率并减少降解,相关方向的研究将很有前景。
[ 参 考 文 献 ]
[1] A Kohl,R Nielsen.Gas purification[R].Houston:Gulf Publishing Company,1997:58-64.
[2] S P Ewing,D Lockshon,W P Jencks.Mechanism of cleavage of carbamate anions[J].Journal of the American Chemical Society,1980,102(3):3072-3078.
[3] R J Millican,M Angelopoulos,A Bose.Uncatalyzed and general acid catalyzed decomposition of alkyl xanthates and monothiocarbonates in aqueous solutions[J].Journal of the American Chemical Society,1983,105(6):421-433.
[4] E Alper,M Al-Roweih,W Bouhamra.Reaction kinetics of COS with primary and secondary amines in alcoholic solutions[J].The Chemical Engineering Journal,1994,55(2):53-59.
[5] R J Littel,G F Versteeg,W P M van Swaaij.Kinetics of COS with primary and secondary amines in aqueous solutions[J].AIChE JOURNAL,1992,38(2):244-249.
[6] H W Thompson,C F Kearton,S A Lamb.The kinetics of the reaction between carbonyl sulfide and water[J].Journal of Chemical Society,1935,31:1033-1039.
[7] P V Danckwerts,M M Sharma.The absorption of carbon dioxide into solutions of alkalis and amines[J].Chemical Engineering Journal,1966,31(12):124-132.
[8] J E Crooks,J P Donnellan.Kinetics and mechanism of the reaction between carbon dioxide and amines in aqueous solution[J].Journal of Chemical Society,1989,2(4):331-342.
[9] H A Al-Ghawas,G Ruiz-Ibanez,O C Sandall.Absorption of carbonyl sulfide in aqueous methyldiethanolamine[J].Chemical Engineering Journal,1989,44(5):631-639.
[10] T L Donaldson,Y N Nguyen.Carbon dioxide reaction kinetics and transport in aqueous amine membranes[J].Industrial and Engineering Chemistry Research Fundamentals,1980,19(3):260-269.
[11] R J Littel,G F Versteeg,W P M van Swaaij.Kinetic study of COS with tertiary alkanolamine solutions[J].Industrial and Engineering Chemistry Research,1992,31:1262-1268.
[12] J Seagraves.Sulfur removal in amine plants[J].Hydrocarbon Engnieering,2001,12(4):47-52.
[13] S C Lee,M J Snodgrass,M K Park,et al.Kinetics of removal of carbonyl sulfide by aqueous monoethanolamine[J].Environmental Science and Technology,2001,35:2352-2367.
[14] M M Sharma.Kinetics of reactions of carbonyl sulphide and carbon dioxide with amines and catalysis by bronsted bases of the hydrolysis of COS[J].Journal of the Chemical Society,Faraday Transactions,1965,61:681-695.
[15] 钟寿仁.二甘醇胺法脱除气体中的硫化氢和羰基硫[J].石油炼制,1981(5):49-55。
[16] M Singh,J A Bullin.Determination of rate constants for the reaction between diglycolamine and carbonyl sulphide[J].Gas Separation and Purification,1988,2(6):131-144.
[17] M A Rahman,R N Maddox,G J Mains.Reactions of carbonyl sulfide and methyl mercaptan with ethanolamines[J].Industrial and Engineering Chemistry Research,1989,28:470-482.
[18] G Hinderaker,O C Sandall.Absorption of carbonyl sulfide in aqueous diethanolamine[J].Chemical Engineering Journal,2000,55:5813-5822.
[19] F Amararene,C Bouallou.Kinetics of carbonyl sulfide (COS) absorption with aqueous solutions of diethanolamine and methyldiethanolamine[J].Industrial and Engineering Chemistry Research,2004,43:6136-6141.
[20] H A Al-Ghawas,G Ruiz-Ibanez,O C Sandall.Absorption of carbonyl sulfide in aqueous methyldiethanolamine[J].Chemical Engineering Journal,1989,44:631-638.
[21] E Alper.Comments on kinetics of reaction of carbonyl sulphide with aqueous MDEA[J].Chemical Engineering Journal,1993,48:1179-1182.
[22] R Rivera-Tinoco,C Bouallou.Kinetic study of carbonyl sulfide (COS) absorption by methyldiethanolamine aqueous solutions from 415 mol/ m3to 4 250 mol/ m3and 313 K to 353 K[J].Industrial and Engineering Chemistry Research,2007,46:6430-6438.

