尺寸可控的固相萃取吸附剂Ni/Al LDH的制备
栾玲玉,程传格,尹西翔,王利红,李剑,孙德军
(1.山东省分析测试中心,山东 济南 250014;2.济南市环境监测中心站,山东 济南 250012;3.山东大学胶体与界面化学教育部重点实验室,山东 济南 250100)
尺寸可控的固相萃取吸附剂Ni/Al LDH的制备
栾玲玉1,程传格1,尹西翔2,王利红1,李剑1,孙德军3
(1.山东省分析测试中心,山东 济南 250014;2.济南市环境监测中心站,山东 济南 250012;3.山东大学胶体与界面化学教育部重点实验室,山东 济南 250100)
采用非稳态共沉淀方法制备了无定形的Ni/Al LDH纳米粒子,水热处理过程促进了无定形沉淀的结晶,从而得到稳定的六边片状Ni/Al LDH纳米粒子胶体分散体系。通过调整胶溶温度和胶溶时间控制Ni/Al LDH纳米粒子的形貌和尺寸,对比不同胶溶温度和胶溶时间下得到的样品,得出制备Ni/Al LDH纳米粒子的最佳条件为胶溶温度130℃,胶溶时间24 h。由于Ni/Al LDH纳米粒子独特的带电及结构性质,具有较好的吸附性能,可将其制作成固相萃取柱,实现纳米材料与样品前处理技术的有机结合,优化样品前处理技术。
固相萃取吸附剂;层状双氢氧化物;非稳态共沉淀;胶溶
固相萃取(Solid-Phase Extraction,SPE)是近年出现的一种样品前处理技术,由液固萃取和柱液相色谱技术相结合发展而来,主要用于样品的分离、纯化和浓缩。该方法的优点是可以提高分析物的回收率,更可以有效地将分析物与干扰组分分离,减少样品预处理过程。该方法有机溶剂消耗量少,操作简单、省时、省力。在固相萃取中最常用的方法是将固体吸附剂装在一个针筒状柱子里,使样品溶液通过吸附剂床,样品中的化合物或通过吸附剂或保留在吸附剂上(依靠吸附剂对溶剂的相对吸附),因此吸附剂的容量和选择性成为解决传统固相萃取技术中吸附剂易堵塞、容量小和穿透体积小等缺点的关键因素。赵汝松等[1-3]采用竹炭作为吸附剂,已经成功建立了全氟辛酸和酞酸酯类化合物固相萃取富集及其分析测定的新方法,但是以竹炭作为吸附剂存在进程量少、再生困难等缺陷。因此,高效优质、安全经济的新型吸附材料的研制开发及其吸附特性研究,具有重要的应用价值。
与竹炭的结构类似,层状双氢氧化物(layered double hydroxides,LDHs)是一类由二价和三价金属离子组成的具有水滑石层状晶体结构的混合金属氢氧化物(图1)[4],其表面带有结构正电荷,具有较强的离子交换能力,热稳定性好,且比表面积大,因此具有较好的吸附性能,可以用作固相萃取柱,解决样品前处理技术中存在的问题。

图1 类水滑石的晶体结构示意图Fig.1 Illustration of hydrotalcite-like crystal structure
1 Ni/Al LDH样品的制备
共沉淀法是制备LDH的常用方法。图2为采用该方法制备的Mg2Al LDH[5-12]纳米粒子的TEM照片。可以看出,大多数的Mg2Al LDH粒子具有规则的六边形,其平均直径约为120 nm,且表面带正电荷,Zeta电位约为+39.5 mV。
基于对Mg2Al LDH胶体分散体系的制备经验以及Ni/Al LDH胶体分散体系分散性较差[13]的特点,采用快速沉淀及水热处理两步法制备Ni/Al LDH胶体分散体系。先将固体NiCl2·6H2O和AlCl·6H2O按照Ni与Al摩尔比1:1溶解,而后边搅拌边向该混合盐溶液中快速加入稀氨水,得到Ni和Al的氢氧化物共沉淀。将得到的混合氢氧化物在室温下陈化,抽滤洗涤至pH值约为8~9。将得到的沉淀分散至水中并装入老化罐中,而后将老化罐放入恒温烘箱,通过调整温度和放置时间,即得到不同胶溶条件下制备的Ni/Al LDH胶体分散体系。

图2 Mg2Al LDH粒子的TEM照片Fig.2 A TEM photo ofMg2Al LDH particles
2 结果与分析
2.1 不同胶溶温度下制备的Ni/Al LDH晶体结构分析
图3为在不同胶溶温度下胶溶24 h得到的Ni/Al LDH样品的X射线衍射图。3个尖锐的衍射峰说明得到的样品具有良好的结晶度,对应的晶面分别为(003)、(006)和(009),相应的晶面间距分别为7.6、3.8和2.6Å,即d(003)=2d(006)=3d(009),这是层状结构典型的衍射特征,即得到的Ni/Al LDH样品具有类水滑石的层状结构。衍射峰强度随着胶溶温度的升高而增强,这表明样品的结晶度随着胶溶温度的增加而提高,并且胶溶温度的变化对其没有影响。

图3 不同温度下胶溶24 h得到的Ni/Al LDH样品的干燥粉末X射线衍射图Fig.3 XRD pattern of dry powder of Ni/Al LDH suspensions peptized at different temperatures for 24 h
2.2 不同胶溶温度制备的Ni/Al LDH纳米粒子的形貌与粒径
透射电镜(TEM)依据样品粒子对入射电子的散射作用成像,是观察晶体结构和微观粒子基本形貌最直接的方法。图4给出了不同温度下胶溶24 h得到的Ni/Al LDH纳米粒子的TEM照片。可以看出,当胶溶温度为80℃时(图4a),得到的样品呈聚集状态且纳米粒子的粒径较小(10~30 nm)。当胶溶温度升高到100℃时(图4b),纳米粒子粒径增加但纳米粒子大小不一,即样品的多分散度较高。当胶溶温度升高到130℃时(图4c),得到六边片状、大小均一(15~30 nm)的纳米粒子,这说明胶溶温度的升高降低了Ni/Al LDH体系的多分散度,使得到的纳米粒子形貌更规则,粒径更均一。但是,胶溶温度升高至150℃时(图4d),纳米粒子的形貌由六边形转变为椭圆形,且纳米粒子大小不一,即体系的多分散度增加。由此可见,制备粒径均一的Ni/Al LDH纳米粒子的最佳胶溶温度为130℃。
2.3 不同胶溶时间制备的Ni/Al LDH纳米粒子形貌与粒径
将胶溶温度控制在130℃,考察了胶溶时间对Ni/Al LDH纳米粒子性质的影响。图5a是胶溶时间为12 h时得到的Ni/Al LDH纳米粒子的TEM照片,可以看出,得到的纳米粒子部分呈规则的六边形,但粒径不均,即体系的多分散度较高。当胶溶时间延长到24 h时(图5b),得到完全分散的溶胶,所有的纳米粒子都呈规则的六边片状,且大小均一。这说明胶溶时间的增加降低了Ni/Al LDH分散体系的多分散度,使得纳米粒子具有更规则的形貌和尺寸。但当胶溶时间延长到48 h时(图5c),部分纳米粒子的六边形的形貌特征被破坏,体系中形成不规则的纳米粒子聚集体。

图4 不同温度下胶溶24 h得到的Ni/Al LDH纳米粒子的TEM照片:Fig.4 TEM photos of Ni/Al LDH nanoparticles peptized at different temperatures for 24 h
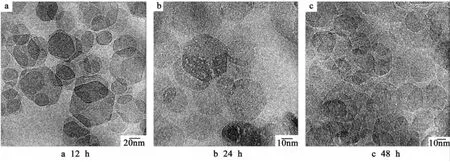
图5 130℃下胶溶不同时间得到的Ni/Al LDH粒子的TEM照片Fig.5 TEM photos of Ni/Al LDH nanoparticles peptized at130℃and different time
为了进一步考察胶溶温度与胶溶时间对Ni/Al LDH纳米粒子性质的影响,我们测定了样品的粒度分布。图6给出了不同胶溶温度下胶溶时间为24 h得到的Ni/Al LDH纳米粒子的粒度分布,可以看出,胶溶温度为100℃时,样品的粒度分布曲线表现为单一的宽峰,这说明样品中可能存在部分未胶溶的沉淀,或是存在由于纳米粒子之间的粘连效应(glue effect)产生的聚集体,从而导致纳米粒子大小不均一。升高胶溶温度至130℃,粒度分布曲线表现为单一的窄峰,即样品多分散度降低,纳米粒子的粒径趋于一致。继续升高胶溶温度至150℃,粒度分布曲线表现为2个宽峰,这说明过高的胶溶温度反而导致体系多分散度增加,即纳米粒子的粒径不均一。从胶溶温度对Ni/Al LDH纳米粒子尺寸的影响来看,粒度分布测定结果与TEM观察结果基本一致。
另一方面,我们测定了胶溶温度为130℃时胶溶不同时间得到的Ni/Al LDH纳米粒子的粒度分布(图7)。可以看出,当胶溶时间由12 h增加到24 h时,样品的粒度分布曲线由2个尖峰转变为一个窄峰,这说明延长胶溶时间,降低了样品的多分散度,使得纳米粒子的粒径更加均一。将胶溶时间延长至48 h,粒度分布曲线表现为单一的宽峰,这说明过长的胶溶时间使得样品的多分散度增加,即得到的纳米粒子粒径不均一。对比不同胶溶条件下得到的Ni/Al LDH分散体系中纳米粒子的尺寸、形貌及多分散性,得出制备Ni/Al LDH纳米粒子的最佳条件为胶溶温度130℃,胶溶时间24 h。
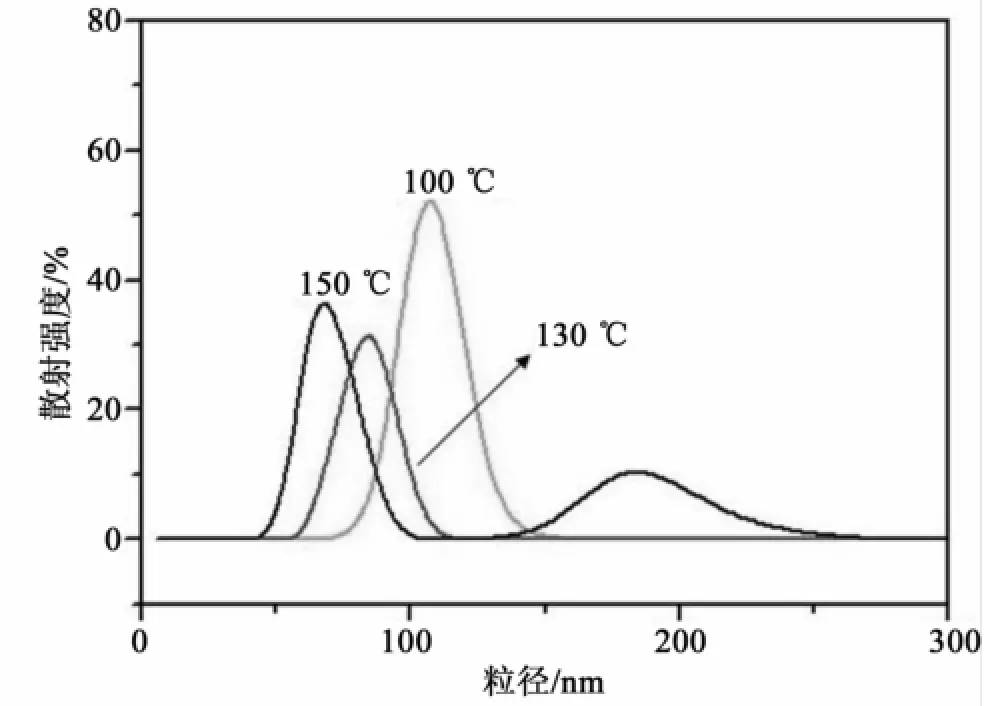
图6 不同温度下胶溶24 h得到的Ni/Al LDH纳米粒子的粒度分布Fig.6 Size distribution curves of Ni/Al LDH nanoparticles peptized at different temperatures for 24 h

图7 130℃下胶溶不同时间得到的Ni/Al LDH纳米粒子的粒度分布Fig.7 Size distribution curves of Ni/Al LDH nanoparticles peptized at 130℃and different time
2.4 Ni/Al LDH样品的化学组成与Zeta电位
对胶溶时间130℃,胶溶温度24 h时得到的Ni/Al LDH样品进行元素分析,得到其化学组成为Ni0.50Al0.47(OH)2Cl0.47·0.71H2O,其中Ni元素与Al元素的物质的量之比接近最初的投料比。测定130℃下胶溶24 h得到的Ni/Al LDH纳米粒子的Zeta电位随pH值的变化可知,粒子的Zeta电位在pH值4~6范围内时基本保持不变,约为+60 mV,即Ni/Al LDH纳米粒子由于同晶置换而带正电荷。
3 Ni/Al LDH纳米粒子生长机理
对Mg/Al LDH体系来说,胶溶温度80℃,胶溶时间24 h即可得到纳米粒子尺寸均一、外貌规则的完全分散的胶体分散体系[5-12],而对于Ni/Al LDH来说,如此低的胶溶温度只能得到絮凝状的凝胶样品,因此,深入探讨Ni/Al LDH纳米粒子分散体系的最佳制备条件以及分析体系中纳米粒子的生长机理,对于进一步研究Ni/Al LDH纳米粒子的吸附性能,并制备出真正适用作固相萃取柱的LDHs纳米材料具有重要意义。
一般来说,在水热处理条件下,纳米粒子的生长遵循奥氏熟化(Ostwald ripening,OR),即在溶液中,纳米粒子的生长基于一个溶解-重结晶(dissolution and recrystallization)过程,由于溶液中粒子的粒径不同,大尺寸粒子的表面自由能较高,因此较小的粒子优先在溶液中溶解,即较小的纳米粒子优先生长,也就是说,OR生长是一个小粒子溶解形成大粒子的过程。对于Ni/Al LDH胶体分散体系来说,一方面,较短的胶溶时间(12、16 h)或较低的胶溶温度(80、100℃),降低了最初的无定形粒子的溶解度,因此得到的Ni/Al LDH纳米粒子粒径较小。另一方面,纳米粒子间较强的引力作用以及无定形粒子之间的粘连效应导致分散体系中聚集体的形成,因此得到的Ni/Al LDH分散体系并未完全分散,且纳米粒子大小不一。而相对较长的胶溶时间(48 h)或较高的胶溶温度(150℃),尽管增大了Ni/Al LDH纳米粒子的粒径,但较大粒子之间的边-面作用同样导致了样品中聚集体的形成[15]。也就是说,在这两种极端条件下得到的Ni/Al LDH纳米粒子尺寸不均一且分散性较差,若用作吸附剂,不利于离子交换的进行,从而影响最终的吸附效率。相对来说,适中的胶溶时间(24 h)和胶溶温度(130℃),促进了最初无定形粒子溶解与重结晶过程,从而得到大小均一规则的Ni/Al LDH纳米粒子,有利于其作为吸附剂开展相关研究。
综上所述,在用非稳态共沉淀方法及随后的水热处理制备Ni/Al LDH纳米粒子时,首先是无定形粒子的溶解,而后经由OR生长开始单个Ni/Al LDH纳米粒子的形成。与此同时,胶溶温度的升高加剧了纳米粒子的布朗运动,当布朗运动引起纳米粒子间的碰撞力大于它们之间的引力作用时,聚集体表面的粒子优先从其表面挣脱,这些纳米粒子由于静电斥力作用而稳定存在。这两种可能存在的相互作用使得胶溶温度80℃,胶溶时间24 h仅能使得部分无定形沉淀分散而得到絮凝状样品。由前面实验可知,胶溶温度达到100℃时,最初的无定形沉淀基本完全分散,Ni/Al LDH纳米粒子经由OR生长并同时伴随溶解-扩散-沉积[16-17]3个过程。即较小粒子溶解,并在较大粒子上沉积,同时Ni2+和Al3+在LDH层间扩散以减少晶格缺陷,形成结晶良好的规则的六边片状Ni/Al LDH纳米粒子。然而,在足够高的胶溶温度和足够长的胶溶时间里,粒子的连续生长使得大粒子生长的更大,那么,这些足够大的粒子间的边-面作用大于它们之间的静电斥力作用使得它们重新聚集成难以分散的聚集体。这是胶溶温度150℃,胶溶时间24 h条件下Ni/Al LDH纳米粒子的形状由六边形变为椭圆形可能原因。
4 结语
由实验结果可知制备形貌规则、大小均一且分散性好的Ni/Al LDH纳米粒子分散体系的最佳条件是胶溶温度130℃,胶溶时间24 h。近年来,以类水滑石化合物或层状双金属氢氧化物作为高效吸附剂,结合固相萃取技术,实现水环境中有机污染物快速富集、分析和检测的研究逐渐成为热点。从文献报道来看,以层间阴离子为Cl-的Mg/Al-Cl-LDHs和Ni/Al-Cl-LDHs为前驱体,并利用体积较小的Cl-易与其他阴离子或有机阴离子交换的特征,以LDHs及其纳米复合材料作为吸附剂来分离和富集水体中无机污染物、重金属污染物以及有机污染物的报道很少,我们将在今后的工作中开展这方面的研究,以期获得新性能的吸附材料,并实现纳米材料与固相萃取技术的结合,创新样品前处理技术。
[1]ZHAO R S,WANG X,WANG X,et al.Using bamboo charcoal as solid-phase extraction adsorbent for the ultratrace-level determ ination of perfluorooctanoic acid in water samples by high-performance liquid chromatography-mass spectrometry[J],Anal Bioanal Chem,2008,390(6):1671-1676.
[2]ZHAO R S,YUAN JP,JIANG T,et al.Application of bamboo charcoal as solid-phase extraction adsorbent for the determination of atrazine and simazine in environmental water samples by high-performance liquid chromatography-ultraviolet detector[J].Talanta,2008,76(4):956-959.
[3]ZHAO R S,WANG X,YUAN JP,et al.Investigation of feasibility of bamboo charcoal as solid phase extraction adsorbent for the enrichment and determination of four phthalate esters in environmentalwater samples[J].JChromatogr A,2008,1183(1/2):15-20.
[4]RIVESV.Layered double hydroxides:present and future[M].Hauppauge:Nova Science Publishers,2001.
[5]ZHANG SY,LAN Q,LIUQ,et al.Aqueous foams stabilized by Laponite and CTAB[J].Colloids Surf A-Physicochemical and Engineering Aspects,2008,317(1/3):406-413.
[6]ZHANG SY,SUN D J,DONG X Q,etal.Aqueous foams stabilized with particles and nonionic surfactants[J].Colloids Surf APhysicochemical and Engineering Aspects,2008,324(1/2/3):1-8.
[7]ZHANG J,LUAN L Y,ZHU W X,et al.Phase behavior of aqueous suspensions of Mg2Al layered double hydroxide:The competition among nematic ordering,sedimentation and gelation[J].Langmuir,2007,23(10):5331-5337.
[8]LIU SY,ZHANG J,WANGN,et al.Liquid-Crystalline phases of colloidal dispersions of layered double hydroxides[J].Chem of Mater,2003,15(17):3240-3241.
[9]WANG N,LIU S Y,ZHANG J,et al.Lamellar phase in colloidal suspensions of positively charged LDHs platelets[J].Soft Matter,2005,1(6):428-430.
[10]ZHU W X,SUN D J,LIU S Y,et al.Multiphase coexistence in colloidal dispersions of positively charged layered double hydroxides[J].Colloids and Surfaces A-Physicochemical and Engineering Aspects,2007,301(1/3):106-112.
[11]LUAN L Y,LIW,LIU SY,et al.The phase behavior ofmixtures of positively charged colloidal platelets and nonadsorbing polymer[J].Langmuir,2009,25(11):6349-6356.
[12]LUAN L Y,LIU SY,SUN D J.Dispersion control and nematic ordering of Ni/Al layered double hydroxide suspensions[J].J Solid State Chem,2009,182(6):1462-1467.
[13]MICHOT L J,GHANBAJA J,TIRTAATMADJA V,et al.Sol-Gel transitions in aqueous suspensions of synthetic takovites:the role of hydration properties and anisotropy[J].Langmuir.2001,17(7):2100-2105.
[14]GURSKY J A,BLOUGH S D,LUNA C,et al.Particle-particle interactions between layered double hydroxide nanoparticles[J].JAm Chem Soc.2006,128(26):8376-8377.
[15]XU ZP,STEVENSONG S,etal.Dispersion and size control of layered double hydroxide nanoparticles in aqueoussolutions[J].JPhys Chem B,2006,110(34):16923-16929.
[16]XU Z P,LU G Q.Hydrothermal synthesis of layered double hydroxides(LDHs)from mixed MgO and Al2O3:LDH formation mechanism[J].Chem Mater,2005,17(5):1055-1062.
Preparation of size controlled solid phase extraction adsorbent Ni/Al LDH
LUAN Ling-yu1,CHENG Chuan-ge1,YIN Xi-xiang2,W ANG Li-hong1,LIJian1,SUN De-jun3
(1.Shandong Analysis and Test Center,Jinan 250014,China;2.Jinan Environment Monitoring Center,Jinan 250012,China;3.Key Laboratory for Colloid and Interface Chemistry of the Ministry of Education,Shandong University,Jinan 250100,China)
We prepared Ni/Al layered double hydroxide(LDH)nanoparticles by non-steady co-precipitation.Water heat treatment process accelerated the crystal of amorphous precipitation.We acquired stable hexagonal sheet Ni/Al LDH nanoparticle colloidal suspensions.We controlled the shape and size of Ni/Al LDH nanoparticles by adjusting peptization temperature and time.We further obtained the optimal peptization temperature of 130℃ and peptization time of 24 h for the preparation of Ni/Al LDH nanoparticles.Ni/Al LDH nanoparticles have better adsorption property because of their unique properties of net positive charge and structure and can be manufacured as a solid phase extraction adsorbent.This realizes the combination of nanocomposites with sample pretreatment technology and optimizes sample preprocessing technology.
solid phase extraction adsorbent;layered double hydroxides(LDHs);non-steady co-precipitation;peptization
TB383
A
1002-4026(2014)01-0045-06
10.3976/j.issn.1002-4026.2014.01.008
2013-08-18
山东省科学院博士基金(2012-12)
栾玲玉(1981-),女,工程师,研究方向为纳米材料制备及其分离富集环境污染物的研究。Email:sdlly916@126.com

