骨关节炎患者免疫球蛋白的变化及其相关因素分析
阮丽萍,刘健,万磊,程圆圆,叶文芳,王亚黎
(1.安徽中医药大学研究生部,合肥 230038;2.安徽中医药大学第一附属医院风湿科)
骨关节炎患者免疫球蛋白的变化及其相关因素分析
阮丽萍1,刘健2,万磊2,程圆圆1,叶文芳1,王亚黎1
(1.安徽中医药大学研究生部,合肥 230038;2.安徽中医药大学第一附属医院风湿科)
目的研究骨关节炎(OA)患者血清免疫球蛋白(Ig)的变化及其影响因素。方法收集214例OA住院患者资料为研究组,收集70名健康体检者作为健康对照组,观察其免疫球蛋白的变化,并分析其与总蛋白(TP)、前白蛋白(PA)、白蛋白(ALB)、红细胞沉降率(ESR)、抗溶血性链球菌O(ASO)、类风湿因子(RF)、超敏C反应蛋白(hs-CRP)关系。结果与健康对照组相比,研究组血清IgG水平升高(P<0.01),IgA、IgM升高,但差异无统计学意义(P>0.05);与免疫球蛋白正常参考值比较,研究组IgG异常40例(18.7%);IgA异常18例(8.4%),IgM异常9例(4.1%);相关性分析显示:IgG与TP、hs-CRP、ESR呈正相关,IgA与淋巴细胞(LYMPH)、TP、补体蛋白3(C3)、CRP、ESR、RF呈正相关,IgM与ASO呈正相关(P<0.01);IgG与中性粒细胞(NEUT)、PA、补体蛋白4(C4)呈负相关,IgA与ALB、NEUT呈负相关,IgM与PA呈负相关(P<0.05或P<0.01)。结论OA患者血清免疫球蛋白升高,以IgG最为显著,且与炎症反应指标呈正相关,免疫反应可能参与了OA发病。
骨关节炎;免疫球蛋白类;因果律
骨关节炎(OA)通常被认为是一种由生物力学改变和衰老而引起的退行性关节疾病[1-2]。OA患者往往出现包括受累关节疼痛、肿胀等一系列局部炎症相关性症状,对OA患者病变组织的组织病理学研究也证实免疫反应和滑膜炎在OA的发生发展过程中起到了关键的作用[3]。对于OA的早期诊断与治疗缺乏有效手段,本研究通过分析血清免疫球蛋白在OA患者中的变化及其影响因素,揭示免疫反应在OA发病过程中的作用,为免疫球蛋白作为OA病情活动性指标之一及探索新的治疗思路提供临床依据。
1 对象与方法
1.1 研究对象 214例骨关节炎患者均来自2008年10月至2012年12月安徽中医药大学第一附属医院风湿科住院患者,其中,女177例,男37例;年龄31~85岁,平均(58.7±12.3)岁;病程3个月~20年,平均病程(5.7±2.8)年。所选病例均符合2003年中华医学会风湿病学分会起草《骨关节炎诊疗指南》的诊断标准[4]。同时收集本院体检中心70例健康体检者作为健康对照组。
1.2 研究方法 将对照组和OA组人员的性别、年龄,病程、生化检查进行填表并建立数据库进行统计处理,对OA患者实验室指标进行分析,实验室指标包括:总蛋白(TP)、前白蛋白(PA)、白蛋白(ALB)、抗溶血性链球菌O(ASO)、类风湿因子(RF)、超敏C反应蛋白(hs-CRP)。补体C3、C4采用日立7600型全自动生化分析仪进行测定。ESR采用魏氏法。
1.3 统计学处理 采用SPSS17.0软件包对数据进行处理,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,相关性分析采用Spearman分析。
2 结果
2.1 骨关节炎患者免疫球蛋白变化 与健康对照组相比,OA组IgG升高(P<0.01),见表1。

表1 两组实验室指标比较(g/L)
2.2 OA患者免疫球蛋白异常情况 OA患者IgG值40例异常(3例偏高,6例偏低),总异常率为18.7%;IgM值9例异常(4例偏高,5例偏低),总异常率为4.1%;OA患者IgM值18例异常(15例偏高,3例偏低),总异常率为8.4%。
2.3 免疫球蛋白相关性分析 见表2。
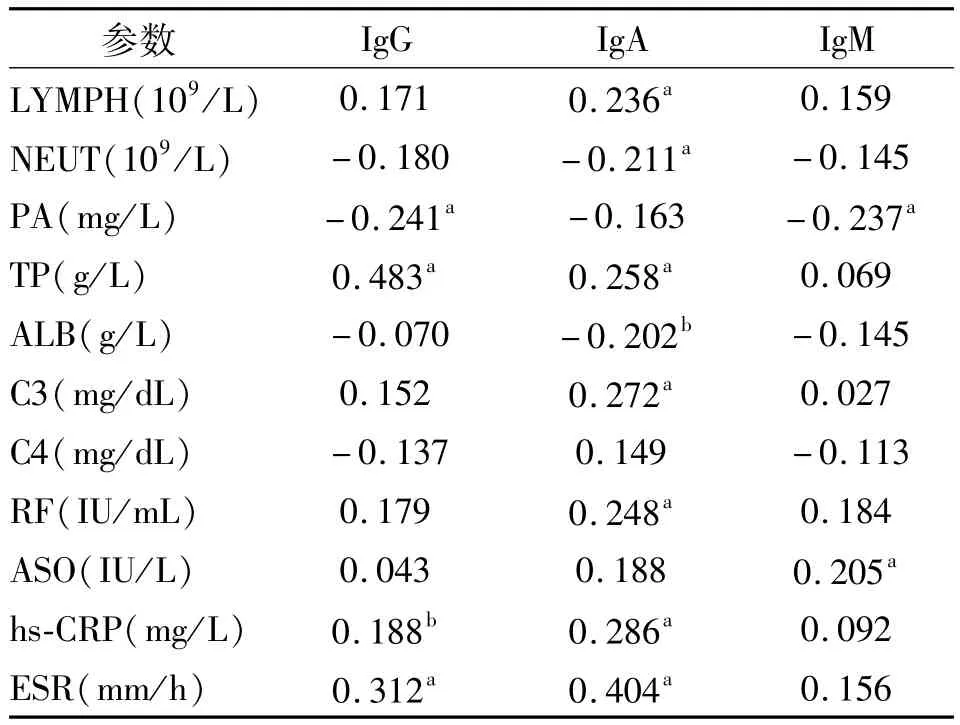
表2 OA患者实验室指标相关性分析
3 讨论
本次研究分析发现,OA患者中免疫球蛋白在实验室检查中的异常率较低,但仍有潜在变化的趋势,血清IgG水平显著高于健康对照组。同时,IgA和IgM也随之升高。说明OA的发生可能与免疫球蛋白(Ig)特征与功能有关。其中IgG在血清中所占比例最高,IgG的特点是产生迟、维持久。而IgM和IgA所占血清Ig比例较小,IgM的作用特点是产生早,消退快,IgA主要作用于黏膜,故在病程持久的OA中,IgG变化较其他系Ig显著。Ig变化也论证了在OA病理过程有Ig的参与。IgG与抗体结合形成免疫复合物,沉积于关节滑膜、软骨,刺激活化补体,促发一系列免疫反应,产生多种细胞因子破坏侵蚀关节软骨,刺激骨质的增生[5]。
本研究还发现,C3和IgA呈正相关,可能的原因是在OA的慢性炎症中,Ig所形成的复合物主要通过旁路途径激活补体系统。补体系统是体内非特异性免疫中的主要效应系统,没有抗体的存在,补体同样难以清除免疫复合物[6]。在风湿病的各个时期,可以出现补体的不同程度的降低,但由于补体代谢速度快变化大,在急性炎症期或有感染存在时,补体可出现代偿性的升高。在OA患者中,血清中C3的降低可能会导致对关节软骨中凋亡细胞及免疫碎片的的识别不足,从而不能顺利清除相关免疫复合物,导致关节软骨的破坏及骨质增生。
本研究初步阐述免疫球蛋白在OA的变化趋势,但对其机制仍不能详述。研究发现[7]在OA不同发病阶段和不同软骨退化区域,软骨细胞死亡可能同时包含了细胞凋亡和自噬的破坏机制。
[1] Goldring MB,Goldring SR.Osteoarthritis[J].Cell Physiol United States,2007,213(3):626-634.
[2] Hoeppner LH,Secreto FJ,Westendorf JJ.Wnt signaling as a therapeutic target for bone diseases[J].Expert Opin T-her Targets,2009,13(4):485-496.
[3] Pastoureau PC,Hunziker EB,Pelletier JP.Cartilage,bone and synovial histomorphometry in animalmodels of osteoarthritis[J].Osteoarthritis Cartilage,2010,18 suppl 3:106-112.
[4] 中华医学会风湿病学分会.骨关节炎诊治指南[J].中华风湿病学杂志,2003,7(11):702.
[5] Peixoto JG,Dias JM,Dias RC,et al.Relationships between measures of muscular performance,proprioceptive acuity,and aging in elderly women with knee osteoarthritis[J].Arch Gerontol Geriatr,2011,53(2):253-257.
[6] 王更银,陈兴,白云.自身免疫性疾病的补体损伤机制及研究进展[J].北京军区医药,2001,13(3):166-168.
[7] Almonte-BecerrilM,Navarro-Garcia F,Gonzalez-Roblesa.Cell death of chondrocytes is a combination between apoptosis and autophagy during the pathogenesis of Osteoarthritiswithin an exprimentalmodel[J].Apoptosis,2010,15(5):631-638.
R684.3
A
10.3969/J.issn.1672-6790.2014.02.003
2013-08-16)
国家自然科学基金(81173211);国家中医药重点学科中医痹病学建设项目(国中医药发[2009]30号);安徽省科技厅科研计划(09-020304046);安徽省卫生厅中医药科研项目(2009ZY05);安徽现代中医内科应用基础与开发研究省级实验室建设项目(科条[2008]150号);安徽中医学院科技创新团队项目(2010TD005)
阮丽萍,硕士在读,Email:daruanapple@163.com
刘健,主任医师,教授,博士生导师,Email:liujianahzy@126.com

