人乳头瘤病毒分型联合液基细胞学检测在宫颈病变筛查中的意义
朱园园,程志祥,李兵,赵婷婷,伍娇
(1.安徽医科大学附属省立医院、安徽省立医院分子实验室,合肥 230001;2.安徽省合肥市第二人民医院检验科)
人乳头瘤病毒分型联合液基细胞学检测在宫颈病变筛查中的意义
朱园园1,程志祥2,李兵1,赵婷婷1,伍娇1
(1.安徽医科大学附属省立医院、安徽省立医院分子实验室,合肥 230001;2.安徽省合肥市第二人民医院检验科)
目的探讨人乳头瘤病毒(HPV)分型联合细胞学检测在子宫颈病变筛查中的意义。方法收集疑似宫颈病变患者408例,分别进行细胞学和HPV基因芯片分型检测,了解各亚型HPV感染率及其与细胞学结果的相关性,判断HPV感染与年龄的关系,进行统计学分析。结果在高危型感染中居于前3位的分别是HPV 16、58、52。单一高危型HPV感染率随宫颈病变级别升高呈增加趋势,且差异有统计学意义(r= 0.879,P<0.05)。高危型HPV感染率在年龄分布上呈两端高的趋势(<25岁和>50岁),但各年龄组间差异无统计学意义。结论HPV分型检测宜联合细胞学应用于宫颈病变的筛查及临床治疗和随访。
宫颈疾病;α乳头状瘤病毒属;细胞学技术
宫颈癌是女性生殖系统最常见的恶性肿瘤,发病率仅次于乳腺癌而高居女性恶性肿瘤第二位。已有研究证实,子宫颈癌是由高危型人乳头瘤病毒(HR-HPV)持续感染引起的恶性肿瘤,是病因明确的肿瘤之一[1]。在HPV检测上早期应用较为广泛的是经美国FDA批准的二代杂交捕获(HC-2)试剂盒,它只能检测13种高危亚型的有无,不能判断具体型别。因此,本课题组采用新兴的HPV分型检测试剂盒,联合液基细胞学对宫颈疾病患者进行检测,分析本地区HPV亚型的感染情况以及感染率与宫颈病变程度的相关性,为临床上对于宫颈癌患病风险的评估和宫颈病变的诊断和治疗提供依据。
1 对象与方法
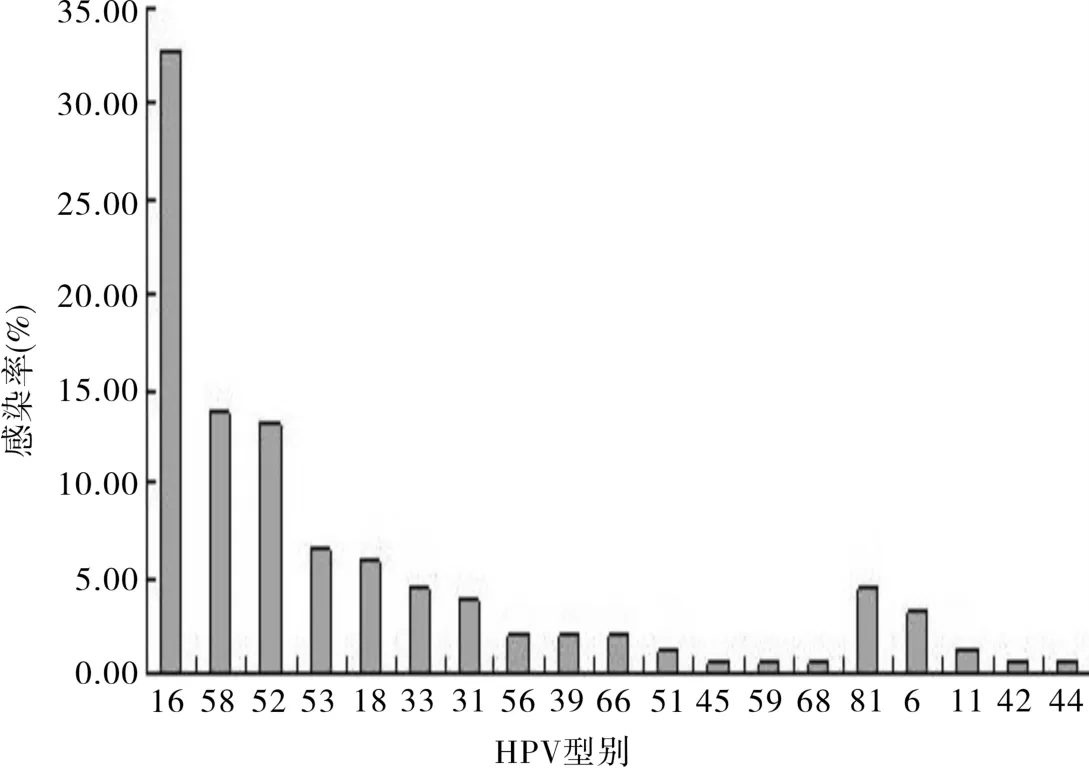
图1 HPV阳性患者各亚型分布
细胞因子诱导的杀伤细胞基本特险及抗月瘤效应研究

图1 体外培养的CIK细胞生长曲线(n=10)
图3 体外培养21 d后的CIK细胞对不同肿瘤细胞的杀伤活性
1.1 研究对象 选取安徽省立医院妇科门诊2012年8月至2012年11月收治宫颈疾病患者408例,年龄17~69岁,平均年龄(38.9±9.7)岁。排除孕妇及子宫切除术后患者。所有患者之前未进行宫颈疾病物理或手术治疗,取样前3天未进行阴道冲洗、塞药或性生活,避开月经期。
1.2 样本采集 由医生先采集宫颈液基细胞学样本,再采集病毒学样本。可在 4℃保存 2周或-20℃保存3个月,避免反复冻融。
1.3 研究方法 宫颈细胞学初诊采用国际癌症协会推荐的2001版TBS分类标准,分为:未见上皮内病变细胞或恶性细胞(NILM)、无明确诊断意义的不典型鳞状细胞(ASCUS)、鳞状上皮内低度病变(LSIL)、鳞状上皮内高度病变(HSIL)和鳞状细胞癌(SCC)。腺上皮不正常为意义不明的不典型腺细胞(AGUS)和腺癌。HPV分型检测试剂盒及导流杂交仪由广东潮州凯普生物有限公司提供,可在一张低密度基因芯片上一次性快速检出21种常见型别HPV的感染情况。包括15种高危型:HPV16,18,31,33,35,39,45,51,52,53,56,58,59,66,68和6种低危型:HPV6,11,42,43,44,CP8304(81)。
1.4 统计学处理 采用SPSS13.0软件对实验数据进行分析,计数资料的比较采用χ2检验,相关性分析采用Pearson检验。对于多重感染者(除说明外),各亚型的阳性率重复计算。
2 结果
2.1 不同细胞学分组中HPV阳性率比较 纳入试验共408例患者。单一HR-HPV感染率随宫颈病变级别升高呈增加趋势(r=0.879,P<0.05),各组间(除AGC组)均差异有统计学意义(P<0.05)。但是对于混合型感染,轻微病变组(ASCUS)感染率最高,达22.2%。而且混合感染22例仅有1例为低危+低危,其他21例均含有高危型感染,见表1。
2.2 HPV分型检测结果 408例患者有118例感染HR-HPV,阳性率为28.9%;10例感染LR-HPV,感染率为2.5%。其中有18例为双重感染,4例三重感染。未发现HPV 35高危亚型和HPV 43低危亚型。在高危型感染中居于前 3位的分别是HPV16、58、52,低危型感染中则以HPV 81和6多见,见图1。
2.3 各年龄组高危型HPV感染情况 各年龄段间感染率差异无统计学意义,见表2。

表1 不同细胞学分组中HPV的感染情况[例(%)]
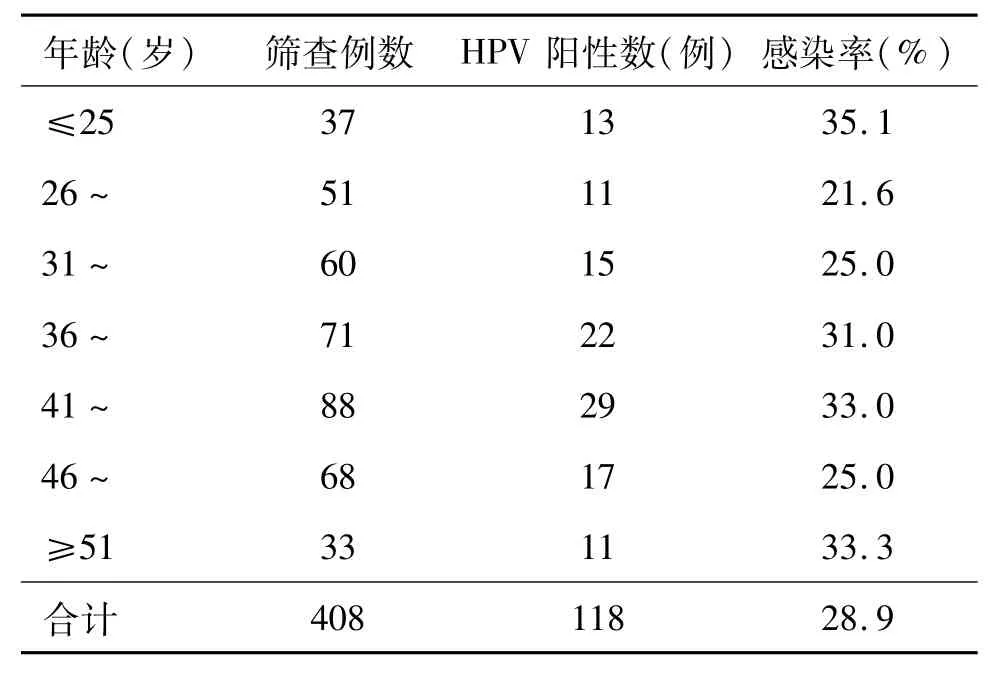
表2 408例患者各年龄组高危型HPV感染情况
3 讨论
3.1 高危型HPV感染率与宫颈病变程度相关高危型HPV的持续感染被认为是宫颈癌发生的主要病因[2-3]。本实验中ASCUS组有48.9%为单一高危型HPV感染,LSIL组检出率为75.7%,而HSIL组检出率为90%,说明宫颈细胞学异常女性的高危型HPV感染率明显高于正常女性,且随着病变级别的递增,感染率呈现增高趋势。但是对于混合型感染,反而是轻微病变组(ASCUS)感染率最高。这也说明病变级别越高,越表现为单一高危型感染,而混合感染并未加重病情。另外临床上对于ASCUS的治疗曾经存在争议,现在可以根据是否同时感染高危型HPV进行不同的处理,既避免了“放虎归山”又避免了过度治疗。因此,HPV分型检测对评估宫颈癌发生风险、提示宫颈病变转归,以便及早干预,降低宫颈癌的发病率及死亡率具有重大意义[4]。
3.2 HPV感染亚型的分布特点 世界范围内,HPV 16导致55%~60%的宫颈癌,HPV 18约占10%~15%,余下的25%~35%则由HPV 31、33、45、52和58等另外10种所引起[5-6]。亚洲及中国以16、58、31、33、52、18型为主[7]。在本实验中,送检宫颈疾病人群总体感染率为31.4%,其中高危型为23.8%,低危型为2.2%,混合型为5.4%。高危型中感染率居于前3位的是HPV 16、58、52,占高危型的66.4%,其次为53、18、33、31。与以往文献相比[8],主要感染型别基本类似,只是各地亚型的感染率高低有区别。另外本地检出中国常见高危亚型HPV 53、低危亚型HPV 81的感染率略高于其他地区,分别占高危型的第4位和低危型的第1位。这可能与样本来源及样本量有关。这对于本地区的流行病学调查和针对性疫苗的研发具有重要意义。
3.3 HPV感染年龄的分布特点 本研究中各年龄段间感染率差异无统计学意义,但是在两端(≤25岁和≥51岁)感染率偏高,与有关报道相符[9-10]。推测第1个感染高峰可能与年轻女性性生活早而频繁,免疫系统未能被致敏,易受HPV感染。大于50岁妇女出现的第2个感染高峰,也许是随着年龄增长其免疫力逐渐下降,容易导致HPV感染。但是近年来多数研究认为,宫颈癌发病年龄年轻化很可能与早期感染病毒有关。由于我国疆域广阔,且HPV感染受到多因素的影响(如过早性行为、性紊乱、早育、多产等),各地区HPV感染率及宫颈癌的发生率都有比较明显的差异。
综合本研究结果,认为HPV分型可以用于宫颈癌的风险评估,区分HPV的持续感染或一过性感染,避免过度治疗。而与细胞学联合进行宫颈癌筛查时,则可弥补细胞学易漏诊的不足,并对细胞学检测为ASCUS结果进行针对性处理,避免了重复细胞学检测和阴道镜下活检的创伤。在美国癌症协会发布的对宫颈癌进行预防和早期筛查的最新指南中,也明确指出了HPV检测这项新技术的必要性及适用范围,使得新的筛查方案更为简单,频次更低,避免了阴道镜滥用及潜在的风险。
(本文图1见插图3-1)
[1] Woodman CB,Collins SI,Young LS.The natural history of cervical HPV infection:unresolved issues[J].Nat Rev Cancer,2007,7(1):11-22.
[2] 卞美璐.WHO(2006年)宫颈癌综合防治实践指南简介[J].中国实用妇科与产科杂志,2007,23(7):557.
[3] 郑荣寿,张思维,吴良有,等.中国肿瘤登记地区2008年恶性肿瘤发病和死亡分析[J].中国肿瘤,2012,21(1):2-10.
[4] 朱莉,曹萍,葛松梅.宫颈鳞癌人乳头状瘤病毒16/18E6感染与脆性组氨酸三联体表达状态的研究[J].中国临床保健杂志,2011,14(2):182-184.
[5] Walboomers JM,Jacobs MV,Manos MM,et al.Human papillomavirus is a necessary cause of invasive cervical cancer worldwide[J].JPathol,1999,189(1):12-19.
[6] Saslow D,Solomon D,Lawson HW,et al.American Cancer Society,American Society for Colposcopy and Cervical Pathology and American Society for Clinical Pathology screening guidelines for the prevention and early detection of cervical cancer[J].Am JClin Pathol,2012,137(4):516-542.
[7] Chen W,Zhang X,Molijn A,et al.Human papillomavirus type-distribution in cervical cancer in China:the importance of HPV 16 and 18[J].Cancer Causes Control,2009,20(9):1705-1713.
[8] 侯萌,李娜,朱广霞,等.妇科门诊患者宫颈人乳头瘤病毒的感染情况分析[J].西安交通大学学报(医学版),2013,34(2):229-232,262.
[9] Herrero R,Castle PE,Sehiffman M,et al.Epidemiologic profile of type-specific human papillomavirus infection and cervical neoplasia in Guanacaste[J].J Infect Dis,2005,191(11):1796-1807.
[10]胡庆兰,刘永珠,朱伟艳,等.5000例宫颈细胞人乳头状瘤病毒感染筛查结果分析[J].现代医院,2012,12(2):136-138.
The combination of Liquid based cytology and human papilloma virus testing for screening cervical lesions
ZHU Yuanyuan*,CHENG Zhiχiang,LI Bing,ZHAO Tingting,WU Jiao
(*Laboratory of Molecular Medicine,Anhui Provincial Hospital Affiliated to Anhui Medical University,Hefei230001,China)
ObjectiveTo evaluate the Liquid based cytology and human papilloma virus test for screening cervical lesions.Methods408 suspected patientswith cervical lesion from our gynecological outpatient service were collected.The liquid-based cytology and human papilloma virus(HPV)testwere used,and the correlation of subtypes of HPV infection with cytology and age were observed.ResultsThe top three HR-HPV genotypes were 16,58,52.The high-risk HPV infection rate increased with lesion grade(r=0.879,P<0.05).Conclusions The combination of HPV with liquid-based cytology testing should be applied in the screening,treatment and follow-up of cervical lesions.
Uterine cervical diseases;Alphapapillomavirus;Cytological techniques
R711.74;R446
A
10.3969/J.issn.1672-6790.2014.03.007
2013-06-24)
中华医学会分子生物学临床应用研究专项资金(CAMB022010)
朱园园,主管技师,Email:zzyy82@yeah.net

