血管紧张素转化酶结构与功能的生物信息学分析
谢晓明邱芝青谢丽明雷 桅*
(1 广东医学院附属医院心血管内科,广东 湛江 524001;2 广东医学院附属医院药剂科,广东 湛江 524001)
血管紧张素转化酶结构与功能的生物信息学分析
谢晓明1邱芝青2谢丽明2雷 桅1*
(1 广东医学院附属医院心血管内科,广东 湛江 524001;2 广东医学院附属医院药剂科,广东 湛江 524001)
目的血管紧张素转化酶(angiotensin converting enzyme,ACE,EC 3.4.15.1)是人类血压控制系统的关键酶,其抑制剂也是广泛应用于临床的降压和心力衰竭治疗一线药物。方法本文采用Protparam等生物信息学方法和工具对ACE基因及其编码蛋白的序列特征、分子结构和理化性质等进行了预测分析。结果表明该基因的核苷酸序列全长2473 bp,包括3'-UTR、ORF和5'-UTR序列,其蛋白分子式C3752H5724N1020O1086S26,含732个氨基酸残基,以Leu含量最高,定位于分泌途径,含跨膜结构域,是一种含有21个碱基的质体转运肽和Glu Zincin功能域的疏水性不稳定蛋白质。其二级结构和三维模型解析完成,结果显示以随机卷曲和α-螺旋为主。结论本研究可为深入开展人ACE蛋白的酶学特性和血流动力学调节机制研究提供理论参考。
血管紧张素转化酶;生物信息学;核酸;蛋白
血管紧张素转化酶(angiotensin converting enzyme,ACE,EC 3.4.15.1)是一种哺乳动物组织中普遍存在的Zn2+依赖型羧二肽酶,为细胞膜上的整合单链糖蛋白,催化水解十肽血管紧张素Ⅰ羧基末端两个氨基酸,生成具有血管收缩作用的八肽血管紧张素Ⅱ或水解具有血管收缩功能的缓激肽生成苯苯-精二肽,是高血压、心肌梗死、心力衰竭等治疗药物筛选中的关键酶[1]。ACE在血压调节机制中发挥重要作用,通过肾素-血管紧张素系统RAS(rennin-angiotensin system)和激肽释放酶-激肽系统,对血压、电解质和体液平衡,以及心血管发育和结构重塑等起关键调节功能,而且其抑制剂已经作为高血压的一线治疗药物成功应用于临床,如Captoril、Enalapril、Lisinopril等[2-4]。
ACE基因多态性被认为与高血压、心室肥厚、心肌梗死、糖尿病肾病等有显著相关性,是多种心血管疾病的易感风险因子。该基因的多态性涉及3’端16号内含子中287 bp位Alu重复序列的插入/缺失(I/D),与循环系统中的血浆ACE浓度相关,DD基因型的ACE酶活是II基因型的2倍,因此ACE基因型ID/DD与心血管疾病的发生发展存在密切联系[5,6]。本研究拟对人ACE基因及其相应编码蛋白的序列结构、理化性质、系统进化关系和生化功能特征等进行生物信息学预测和分析,以期在生物化学和分子生物学水平上进一步研究人ACE蛋白的酶学特性和血压调控机制研究提供理论依据。见图1。
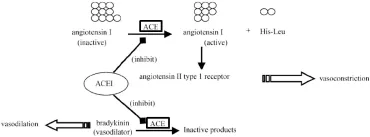
图1 血管紧张素转化酶及其抑制剂在RAS系统中的作用[7]
1 材料与方法
数据来源于NCBI核苷酸和蛋白质数据库(GenBank)中已登录的人ACE基因核苷酸序列及其对应的氨基酸序列:ACE(Accession:M26657)。
利用Protparam、Vector NTI Suit 8、MEGA4.1、SignalP等软件和www.ncbi.nlm.nih.gov、www.expasy.org等网站所提供的在线分析工具进行预测和分析。核苷酸及氨基酸序列的分子结构和理化性质分析使用Protparam完成;ACE编码核苷酸序列的开放阅读框(ORF)搜寻、翻译和同源性比对使用Vector NTI Suit 8软件;基于ACE及其他物种的ACE氨基酸序列和MEGA4.1工具,使用Neighbor-Joining(NJ)方法构建ACE蛋白的分子系统进化树;通过TargetP 1.1 Server在线工具完成ACE蛋白的亚细胞定位,并对其结果进行SignalP及ChloroP分析后得到ACE蛋白信号肽的相关信息;ACE蛋白的跨膜结构域和疏水性分析分别使用TMHMM和ProtScale完成;ACE蛋白的功能结构域和coiledcoil区分别用CDD和COLS分析;ACE蛋白的二级和三级结构预测与建模分别在GOR和SWISS-MODEL系统上计算获得。
2 结果与分析
2.1 人ACE基因的核苷酸及相应氨基酸序列的分子结构和理化性质分析。来自NCBI的人ACE核苷酸序列全长2473 bp,包括ORF(Open Reading Frame,开放阅读框)、3'-UTR(Untranslated Regions,非翻译区)和5'-UTR序列,其中ORF长2196 bp,起始密码子为ATG,终止密码子为TGA。基于Protparam分析所得的ACE编码蛋白的理化性质[8],该蛋白分子C3752H5724N1020O1086S26,相对分子质量为83.3304 kDa,摩尔消光系数为156230,理论等电点pI=6.13,脂肪系数81.19,半衰期为30 h,亲水性平均系数(Grand average of hydropathicity,GRAVY)为-0.380,推测该蛋白表现疏水性,不稳定系数为40.85,即属不稳定蛋白。人ACE编码蛋白所含的氨基酸残基数为732,其组成见表1,可知含Leu最多,且不含Pyl和Sec、Asx、Glx和Xaa。

表1 人ACE蛋白的氨基酸分布
2.2 人ACE蛋白的跨膜结构域与亚细胞定位分析。利用TMHMM Server v. 2.0系统对人ACE蛋白的氨基酸序列进行跨膜结构域预测[9],结果见图2,人ACE存在1个跨膜结构域,并且整条肽链横跨于膜内外,位于A682-A702。可见人ACE蛋白的催化功能不是在细胞质基质中进行,而是锚定于质体,后经过蛋白转运,将血管紧张素Ⅰ送至特定部位,完成血管紧张素Ⅱ的生物合成和血管压力的活性调节。
用TargetP 1.1 Server在线工具分析[10]显示,人ACE蛋白定位于分泌途径,属分泌型蛋白。该蛋白含有21个氨基酸的转运肽,预测可靠性等级为1。进一步采用SignalP 3.0 Sever解析人ACE蛋白的氨基酸序列中信号肽区段及其所在位置[11],发现其N端有21个氨基酸的信号肽,剪切位点在21~22(分值为0.816)(图3)。

图2 人ACE蛋白的跨膜结构域预测

图3 人ACE蛋白的信号肽预测
2.3 人ACE蛋白的保守功能域和coiled-coil结构分析。蛋白质由多个基序组成,且基序相应的氨基酸区段行使特异的生化功能,同时也蕴含着各自的遗传进化信息。利用CDD在线工具[12]分析人ACE氨基酸序列的功能结构域,即去掉信号肽,剩下的成熟肽氨基酸序列包含一个Glu Zincin功能域(图4)。表明人ACE编码蛋白属于Zn2+依赖酶超家族,而该基序则主要负责催化血管血压调节过程中关键步骤——血管紧张素Ⅱ的生成。

图4 人ACE蛋白的保守结构域分析
2.4 人ACE蛋白二、三级结构预测与分析。基于GOR4在线工具[13]预测人ACE氨基酸序列的二级结构,结果见图5。在人ACE多肽链中,随机卷曲占43.58%,α-螺旋占44.40%,延伸链占12.02%,可见随机卷曲和α-螺旋是ACE多肽链中的主要结构元件,延伸链散布于整个蛋白质中。基于同源性的三维建模,将这条人ACE氨基酸序列上传至SWISS-MODEL服务器中进行自动化模型生成,然后在ViewerLite 5.0软件中进行结构编辑[14,15],获得ACE的三级结构模型(图6)。
3 小 结
RAS系统在心脑血管系统的重要作用日益受到重视,其ACE的抑制剂也一直作为高血压和心力衰竭治疗的一线药物。随着人类对ACE结构和作用机制的深入研究,可能会产生新的更安全有效,且副作用更少和适应性更强的ACE抑制剂。生物信息学是基于生物医学临床和实验数据,并与先进计算技术和工具相结合的重要方法,已成为现代

图5 人ACE基因编码蛋白的二级结构预测

图6 人ACE基因编码蛋白的三维结构预测
医学研究的前沿领域。本文应用生物信息学方法对人ACE基因的核苷酸及其编码蛋白质序列进行了分析和建模,进而对其分子结构和生化性质进行了预测鉴定,结果表明人的ACE酶定位于分泌途径,存在跨膜结构域,是一种含有21个碱基的质体转运肽和Glu Zincin功能域的不稳定疏水性蛋白质,二级和三级结构解析完成,以随机卷曲和α-螺旋组分为主。本研究结果可为深入开展人ACE蛋白的酶学特性和血压控制的分子机制研究提供重要理论参考,必将推动ACE抑制剂及其候选药物的研究开发和心血管医学的基因治疗。
[1] El-Sayedel SM,Abd-Ellah MF,Attia SM.Protective effect of captopril against Cisplatin-induced nephrotoxicity in rats [J].Pak J Pharm Sci,2008,21(3):255-261.
[2] Paul M,Poyan Mehr A,Kreutz R.Physiology of local reninangiotensin system[J].Physiol Rev,2006,86(3):747-803.
[3] Skidgel RA,Alhenc-Gelas F,Campbell WB.Relation of cardiovascular signaling by kinins and products of similar converning enzyme systems; prologue: kinins and related systems New life for old discoveries [J].Am J Physiol Heart Circ Physiol,2003,284(6):1886-1891.
[4] Vaidyanathan S,Jarugula V,Dieterich HA,et al.Clinical pharmacokinetics and pharmaco dynamics of aliskren [J].Clin Pharmacokinet,2008,47(8):515-531.
[5] Morshed M,Khan H,Akhteruzzaman S.Association between Angiotensin I-converting enzyme gene polymorphism and hypertension in selected individuals of the Bangladeshi population [J].J Biochem Mol Biol,2002,35(3):25-254.
[6] Agachan B,Isbir T,Yilmaz H,et al.Angiotensin converting enzyme I/D,Angiotensinogen T174M-M235T and angiotensin II type 1 receptor A1166C gene polymorphisms in Turkish hypertensive patients [J].Exp Mol Med,2003,35(6):545-549.
[7] 赵钰岚,许传莲.血管紧张素转换酶的结构功能及相关抑制剂[J].生物工程学报,2008,24(2):171-176.
[8] Gasteiger E,Hoogland C,Gattiker A,et al.Protein Identification and Analysis Tools on the ExPASy Server; (In) John M.Walker (ed):The Proteomics Protocols Handbook [M].Humana Press, 2005: 571-607.
[9] Ikeda M,Arai M,Lao DM.Transmembrane Topology Prediction Methods:A Reassessment and Improvement by a consensus method using a dataser of experimentally charaterized transmembrance topologies [J].In Silico Biol,2002,2(1):19-33.
[10] Emanuelsson O,Brunak S,von Heijne G,et al.Locating proteins in the cell using TargetP,SignalP and related tools [J].Nat Protoc ,2007,2(4):953-971.
[11] Petersen TN,Brunak S,von Heijne G,et al.SignalP 4.0: discriminating signal peptides from transmembrane regions [J]. Nat Methods,2011,8(10):785-786.
[12] Marchler-Bauer A,Bryant SH.CD-Search: protein domain annotations on the fly [J].Nucleic Acids Res,2004,32(Web Server issue):327-331.
[13] Combet C,Blanchet C,Geourjon C,et al.NPS@: Network Protein Sequence Analysis [J].Trends Biochem Sci,2000,25(3):147-150.
[14] Arnold K,Bordoli L,Kopp J,et al. The SWISS-MODEL Workspace: A web-based environment for protein structure homology modelling [J].Bioinformatics,2006,22(2):195-201.
[15] Kiefer F,Arnold K,Künzli M,et al.The SWISS-MODEL Repository and associated resources [J].Nucleic Acids Res,2009,37(Database issue):D387-D392.
Bioinformatics Analysis of Angiotensin Converting Enzyme (ACE) Structure and Function of Human
XIE Xiao-ming1, QIU Zhi-qing2, XIE Li-ming2, LEI Wei1*
(1 Department of Vasculocardiology, the Affiliated Hospital of Guangdong Medical College, Zhanjiang 524000, China; 2 Department of Pharmacy, the Affiliated Hospital of Guangdong Medical College, Zhanjiang 524000, China)
ObjectiveAngiotensin converting enzyme (ACE, EC 3.4.15.1) is the key enzyme in human blood press control system, and its inhibitor has been used widely as the clinic first-line drug of antihypertensive and heart-failure treatment.MethodThe sequence characteristics, molecular structure and physicochemical properties of ACE gene and its coding protein were predicted and analyzed by bioinformatic methods and tools like Protparam.ResultsThe length of nucleotide acid sequence was 2473 bp, including 3'-UTR, ORF and 5'-UTR; the molecular formula of the ACE protein was C3752H5724N1020O1086S26 containing 732 aa, and Leu was the most abundant amino acid; ACE was anchored in the secretory pathway, with transmembrane domain, it was an unstable protein with a 21 aa plastidial transit-peptide. At last, its secondary and 3-D modelling was successfully established and it contained mainly alpha helix and random coil.ConclusionThis study can provide the theory references for the enzymatic properties and hemodynamics regulation mechanism of human ACE protein.
Angiotensin converting enzyme; Bioinformatics; Nucleic acid; Protein
R972.4
B
1671-8194(2014)34-0003-03
国家自然科学基金(编号:81300035);广东省自然科学基金(编号:S2013040012115)
*通讯作者:E-mail: thdmast@gmail.com

