碳纳米管水悬浮液过冷度及非等温结晶过程
王 晓,候鉴峰,吴雨越,范利武,徐 旭,俞自涛,胡亚才
12作为一种能量缓冲手段,储能技术因可以解决能量供求在时间与空间上不匹配的矛盾,在能源日益紧张的形势下,受到越来越多研究者的关注。潜热储能(蓄热/蓄冷)利用材料发生相变时(通常是固液相变)吸收/释放大量潜热,是一种具有较高储能密度的储能方式[1]。但是,常用相变储能材料的导热系数通常较低(如用作蓄冷工质的水),成为储能系统吸/放热速率的制约因素。将高导热系数的纳米颗粒加入到传统蓄冷工质中形成悬浮液(即纳米复合相变材料)的方式为提高相变储能效率提供了一种有效的解决途径[2]。文献中以水和共晶盐水溶液为基液的纳米复合相变蓄冷材料作为研究对象,对其导热性和储能特性进行了较为全面的研究[3-5]。
相变蓄冷材料在实际应用中需要克服的另一个问题是过冷。凝固蓄冷过程中真实的凝固结晶温度低于相应压力下的相变饱和温度的现象称为过冷现象,二者之差称为过冷度,较高的过冷度将导致蓄冷系统效率下降[6]。在常见蓄冷工质中,水的过冷现象尤为严重[7]。采用添加微尺度成核剂促进结晶过程中的非均匀成核是降低过冷度的有效方法[8]。因此,纳米复合相变蓄冷材料中的纳米颗粒除了能够增强导热性外,同时还能起到成核剂的作用。目前,文献中对纳米复合相变蓄冷材料过冷度的研究主要集中在添加金属氧化物纳米颗粒上,研究方法则主要分为等温和非等温结晶两类[9-14]。
新兴的高导热碳纳米颗粒(包括碳纳米管、碳纳米纤维和石墨烯等)展现出了较高的导热系数,从而可以提升其性能[15-16]。其中,碳纳米管自1991年被发现以来[17],因其良好的力、电、热学性能以及纳米尺度效应,表现出了广泛的应用前景。实验测量表明,单根多壁碳纳米管的导热系数高达3000 W/m·K[18],远高于常规的良导热材料。Choi等[19]用多壁碳纳米管研究纳米悬浮液的导热系数,结果表明,加入 1%(体积分数)的情况下,悬浮液的导热系数比基液增长了160%。此外,有研究表明,在水中添加碳纳米管制成悬浮液可以较大程度地提升水的导热系数[20]。碳纳米管水悬浮液有望成为一种高效的纳米复合相变蓄冷材料,同时碳纳米管的存在还将对基液的固液相变行为产生一定的影响[21]。因此,本工作将采用非等温结晶方法,利用差示扫描量热仪(DSC)对碳纳米管水悬浮液的过冷度进行测量,并分析悬浮液浓度和降温速率对过冷度以及非等温结晶过程的影响。
1 实验材料和方法
1.1 实验材料与设备
实验中采用碳纳米管水悬浮液(以下简称碳纳米管悬浮液)为工质,购买自中国科学院成都有机化学有限公司。碳纳米管水悬浮液的原始浓度为3%(质量分数),其中碳纳米管的纯度>95%,外径>50 nm,内径为5~15 nm,长度为10~20 μm。
碳纳米管水悬浮液的相变温度通过差示扫描量热仪(Netzsch DSC 200 F3)进行测试。该仪器的测试温度为-170~600 ℃,灵敏度为0.1 μW,通过液氮冷却,升/降温速率可达100 ℃/min。本工作中所有的实验过程均在高纯氮气气氛下进行,吹扫气流量为20 mL/min,保护气流量为60 mL/min。测量所用坩埚为Netzsch的25 μL铝制坩埚。此外,实验中称量所用分析电子天平(OHAUS DV 215 CD)的精度为0.01 mg。
1.2 试样制备与测试过程
实验中所用的材料都是在购买状态下直接使用,没有经过进一步的化学提纯。采用添加一定量去离子水的方法对原始的碳纳米管水悬浮液(浓度为3%)进行稀释,得到了更低浓度的悬浮液试样,其浓度分别为1%、0.1%、0.01%、0.001%和0.0001%。为了表示方便,以下将各浓度的 6个试样从纯水(0%)到最高浓度的1%碳纳米管水悬浮液按浓度增长依次命名为试样A~F。对稀释后的各试样分别进行了2 h的超声波震荡(工作频率为40 kHz)以确保其稳定性。利用透射电子显微镜(TEM)对超声波震荡完成后的悬浮液试样中碳纳米管的分散形态和尺寸进行了微观表征。
试样的DSC测试过程:首先以5 ℃/min的速率将已密封的坩埚试样从室温升至30 ℃,并恒温8 min以消除热历史;然后分别以2、5和10 ℃/min的速率将样品从30 ℃降温到-35 ℃,并恒温8 min;最后,分别以相应的升温速率将样品再次升温到30℃,并恒温 8 min。为了在测量过程中达到较好的精度,在 DSC的温度程序设置中选择样品温度控制,使样品的升/降温速率严格地与程序设定值保持一致[13]。为了检验测试结果的可重复性,每一个浓度的试样均制备了3个坩埚样品进行DSC测试。
2 结果与讨论
2.1 分散性及稳定性表征
实验中所制备的碳纳米管悬浮液试样的分散性和稳定性的表征如图1所示。从图1(a)的TEM图中可以看出只有少部分碳纳米管团聚的存在,说明悬浮液中碳纳米管的分散较为均匀。
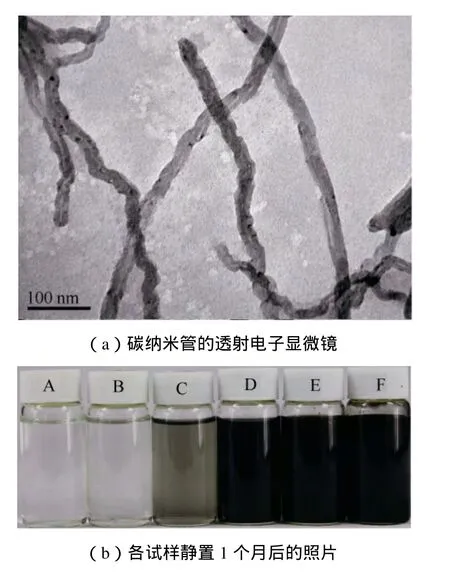
图1 碳纳米管悬浮液的分散性与稳定性表征Fig. 1 Characterization of the dispersion and stability of the carbon nanotubes
实验中对碳纳米管悬浮液的稳定性进行了长时间的静置观测。如图1(b)所示,所制备的悬浮液试样随着浓度的增大,颜色有明显的加深。在静置 1个月后,各试样中均未出现肉眼可见的明显沉降,说明其稳定性较为理想。
2.2 降温速率为2 /min℃时的过冷度分析
实验中对每个试样取3个样品进行测试,将得到的过冷度平均值作为分析对象,并取3个样品中最接近平均值的样品作DSC热分析曲线。根据DSC测试得到的碳纳米管水悬浮液的熔化和凝固结晶温度,可以将过冷度(ΔTSC)定义为

式中,Tm和Tf分别为悬浮液的熔化和凝固结晶过程的起始温度,℃。
当降温速率φ=2 ℃/min时,各浓度碳纳米管悬浮液试样升降温过程的DSC曲线如图2(a)所示。从图中可以看出,各试样熔化过程的DSC曲线几乎重合,熔化峰的起始点和峰宽都几乎相等,说明熔化的起始温度Tm几乎不受碳纳米管浓度的影响。各试样实际测量得到的熔化起始温度均在-0.6~-0.9 ℃,与文献中所观察的现象类似[11]。
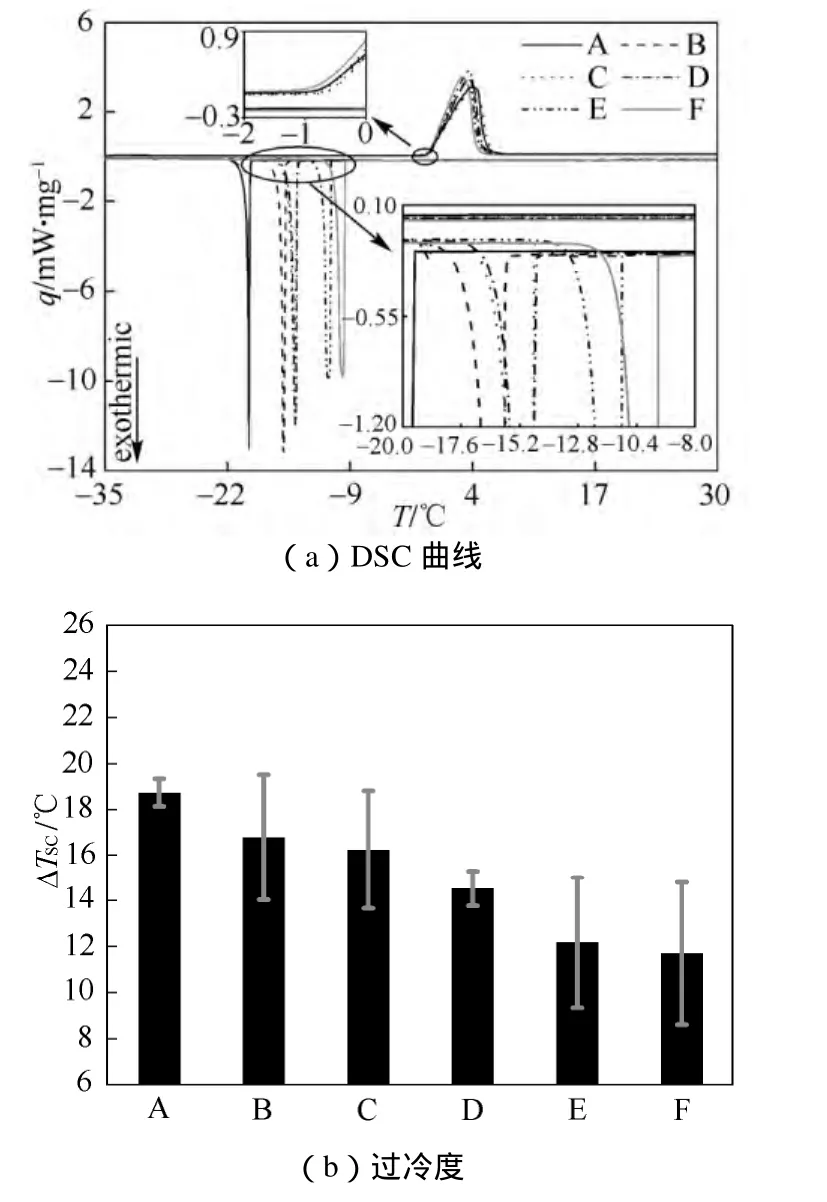
图2 降温速率为2 ℃/min时的DSC曲线和过冷度Fig. 2 DSC curves and supercooling degrees at the cooling rate of 2 ℃/min
与之相反,凝固过程则随着悬浮液浓度的变化有较明显的改变。如图 2(a)所示,凝固峰随着浓度的增大逐渐右移,即凝固结晶的起始温度Tf逐渐升高。纯水的凝固起始温度为-18.7 ℃,而最高浓度试样则为-12.2 ℃,相较于纯水提高了6.5 ℃。根据式(1),由于熔化起始温度几乎不变,故碳纳米管悬浮液的过冷度随着浓度的增长而减小,相较于纯水的最大减小幅度为6.6 ℃(试样F)。在该降温速率下测得的不同浓度碳纳米管悬浮液样品的过冷度如图2(b)所示。从图中可以看出悬浮液的过冷度随着浓度的增大而逐步下降,与图 2(a)所观察到的凝固峰的右移趋势相吻合。这一现象可以用非均匀成核理论来解释。非均匀成核所需要的能量涨落较小,可以在较低的过冷度下发生,比均匀成核要容易[2,5,8-10,21]。碳纳米管的比表面积较大,故水分子易于附着在其表面。因此,结晶过程中晶核会优先在碳纳米管表面上形成,达到非均匀成核的效果。较高浓度的碳纳米管悬浮液能够提供更多的非均匀成核点,其过冷度也会进一步降低。
同时可以注意到,同一试样3个样品的过冷度测量值之间存在较为明显的波动。虽然3次测量的平均值符合上述规律,但每次测量的不确定度却并未呈现明显的随浓度变化的趋势。在该降温速率下,试样F(浓度为1%)的3个过冷度测量值之间偏差最大,达到3.1 ℃,而纯水的3次测量值则较为接近,最大偏差仅为0.6 ℃。
2.3 降温速率为5 /min℃时的过冷度分析
当降温速率增大为5 ℃/min时的DSC曲线如图 3(a)所示。该降温速率下各条曲线的变化规律与2 ℃/min的降温速率曲线相似。熔化过程的起始温度也几乎不随悬浮液浓度变化,各试样的值均在-0.3~-0.6 ℃。凝固结晶峰则同样随着悬浮液浓度的增大而呈现右移趋势,但峰宽与2 ℃/min时的曲线相比有所增大。
如图3(b)所示,在较高的降温速率下,不同浓度碳纳米管水悬浮液的过冷度测量值依然具有随浓度增大而逐步下降的典型特征。在该降温速率下测得的纯水的过冷度为19.8 ℃,比2 ℃/min时过冷度为 18.7 ℃的测量值略高;最高浓度试样 F的过冷度则为 11.7 ℃,即过冷度下降了 7 ℃,与上一工况的结果相近。
从图3(b)中还可以看出,同一试样3个样品测量值之间的偏差具有一定的随机性。在这一工况下,试样B和C的过冷度的3次测量偏差是最小的,均为1.2 ℃左右,甚至小于纯水的对应值(1.5 ℃)。与上一工况相似,在该降温速率下,试样 F(浓度为 1%)的3个过冷度测量值之间偏差最大,同样也达到3.1 ℃。

图3 降温速率为5 ℃/min时的DSC曲线和过冷度Fig. 3 DSC curves and supercooling degrees at the cooling rate of 5 ℃/min
2.4 降温速率为10 /min℃时的过冷度分析
当降温速率进一步提高为10 ℃/min时,如图4(a)所示,不同浓度碳纳米管水悬浮液试样的熔化和凝固曲线的形状及其熔化起始温度的变化幅度均与降温速率为2 ℃/min和5 ℃/min时观察到的现象一致。随着降温速率的提高,凝固峰的峰宽继续增大。如图4(b)所示,该降温速率下过冷度随悬浮液浓度的变化规律与前两个工况非常相似,同样随浓度的增大而降低。纯水过冷度的平均测量值为20.1 ℃,最高浓度试样F的过冷度则为13 ℃,即过冷度下降了约7 ℃,该值与前两工况一致。这一工况下同一试样过冷度的3次测量值之间的偏差幅度与降温速率为5 ℃/min时无明显差别,较大偏差同样都在较高浓度下发生,最大偏差为4.1 ℃(试样E,浓度为0.1%)。综合3个降温速率下过冷度测试的重复性,可以得到在较高浓度下悬浮液的过冷度3次测试偏差幅度浓度较低的较大。这与高浓度悬浮液中碳纳米管的沉降有关,悬浮液的不均匀致使DSC测试样品取样不均匀,因此得到不同偏差程度的过冷度值。为了得到较为可靠的测试值,通常采用的方法是在悬浮液的上、中、下层分别进行DSC取样测试,然后取平均值,这样也使得 DSC测试值产生不同程度的偏差。
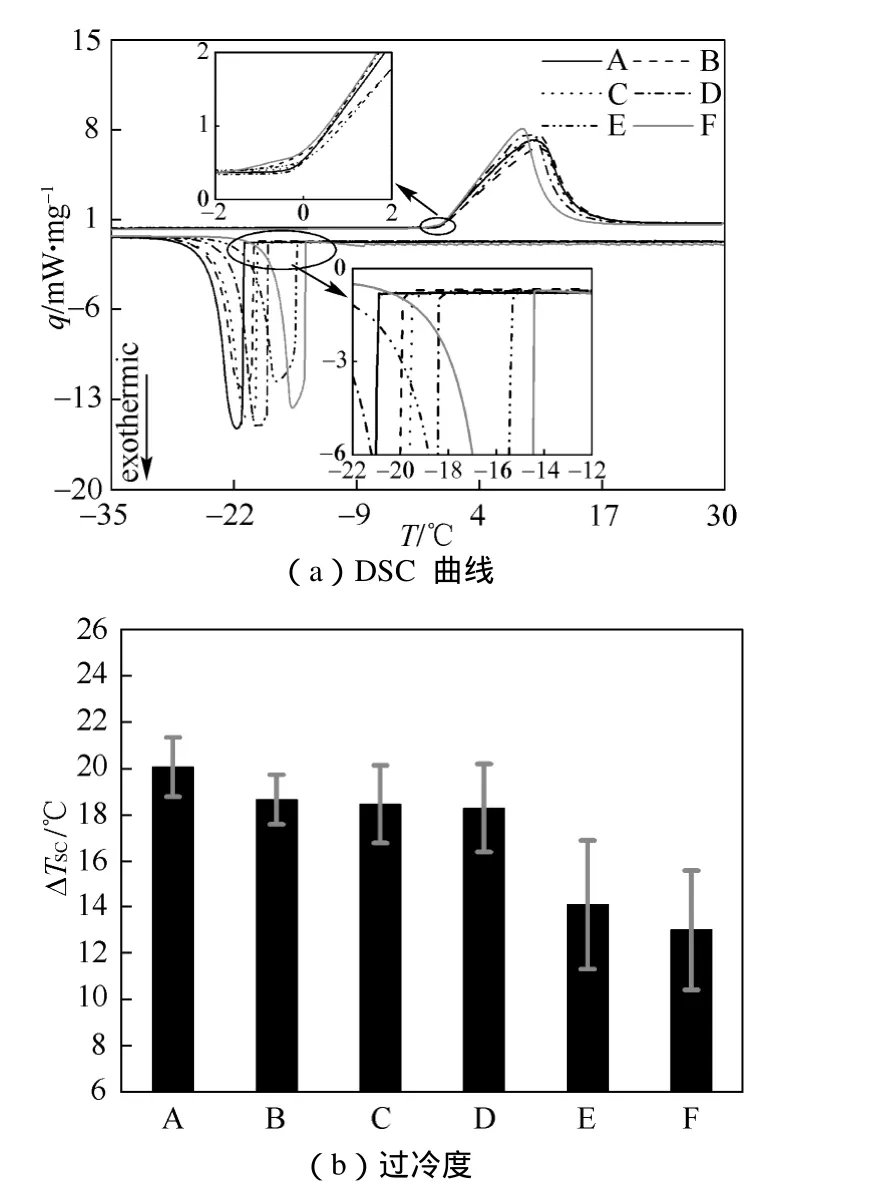
图4 降温速率为10 ℃/min时的DSC曲线和过冷度Fig. 4 DSC curves and supercooling degrees at the cooling rate of 10 ℃/min
2.5 过冷度的综合比较
不同浓度碳纳米管水悬浮液的过冷度随降温速率的变化如图5所示。从图中可以看出,碳纳米管水悬浮液的过冷度随着浓度的增大而减小,随着降温速率的升高而逐渐增大。
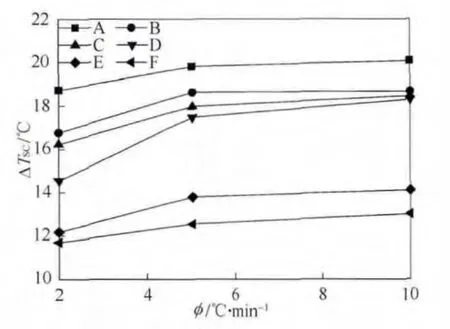
图5 不同浓度石墨烯悬浮液的过冷度随降温速率的变化Fig. 5 Cooling rate dependence of the supercooling degree of the various graphene suspensions
如上所述,在不同的降温速率下所观察到的最大过冷度变化均在 7 ℃左右(对应于最高浓度为1%的试样F)。同样采用DSC在2 ℃/min的降温速率下进行测量后发现,浓度为 5%的氧化钛水悬浮液(纳米流体)的过冷度降低幅度仅为 2.5 ℃[9],说明碳纳米管促进成核结晶的能力要强于一般的金属氧化物纳米颗粒。
2.6 非等温结晶过程分析
为进一步分析碳纳米管水悬浮液非等温结晶过程的变化规律,通过DSC曲线计算了所测悬浮液试样的相对结晶度X,其定义如下[21]式中,dH/dT表示结晶焓随温度的变化函数,
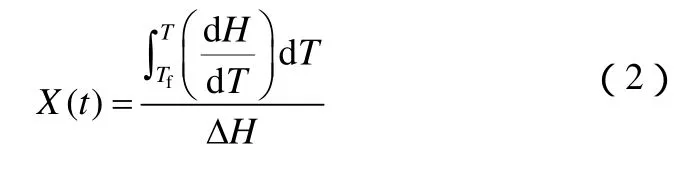
ΔH则表示特定降温速率下结晶过程的总结晶焓,
时间t可由式(3)换算得到

根据式(2)、式(3)可得到不同浓度碳纳米管水悬浮液的相对结晶度随时间的变化关系(图6)。显然,随着降温速率的提高,试样完成非等温结晶过程所需的时间明显变短。然而在固定的降温速率下,在非等温结晶过程的初始阶段其结晶速率随着悬浮液浓度的提高有下降的趋势。这是由于低浓度悬浮液的过冷度较大,所对应的结晶温度较低,从而导致其前期的结晶速率较大,即过冷度较低的高浓度悬浮液初期结晶反而较慢。在结晶过程的后期,由于较多碳纳米管的存在,高浓度悬浮液则体现了结晶速率加速的效果。在浓度较低时,相对结晶度的时间变化曲线与纯水(即试样A)的差别较小,但最高浓度的试样F(浓度为1%)初期结晶速率下降程度较为明显,并且总结晶时间则几乎与悬浮液的浓度无关。
由此可以看出,虽然碳纳米管的存在提供了非均匀成核条件从而降低了水的非等温结晶过冷度,但在晶核成长阶段(尤其是凝固过程的早期),较小的过冷度(即较高的结晶温度)使得非等温结晶过程的速率有所下降;但是到了结晶阶段的后期,其影响又变成正面的。

图6 不同浓度碳纳米管悬浮液的相对结晶度随时间的变化Fig. 6 Time dependence of the degree of crystallinity of the various carbon nanotubes suspensions
3 结 论
本工作采用差示扫描量热仪对碳纳米管水悬浮液的过冷度及凝固过程进行了非等温表征,分析了悬浮液浓度和非等温过程的降温速率对过冷度的影响。实验结果表明,由于碳纳米管的存在,悬浮液的过冷度比纯水小。随着浓度的提高,悬浮液的过冷度呈逐步下降的趋势,纯水的过冷度比悬浮液最高浓度1%时高7 ℃,降低幅度大于普通的金属纳米颗粒。悬浮液的过冷度随着降温速率的增大略有升高,但降温速率对过冷度改变的最大幅度与悬浮液浓度的变化没有关联。此外,在非等温结晶的初期(即晶核形成阶段),结晶速率随着浓度的提高有减缓的趋势,到后期(即晶核成长阶段)则有加速的效果。
综上所述,添加碳纳米管所制备的水基纳米复合相变蓄冷材料不仅能通过碳纳米管的高导热性质提升其导热性能,而且能有效降低凝固结晶过程中的过冷度,这对水蓄冷的实际工程应用具有一定的指导意义,对于其综合性能应在后续研究中给予更多的关注。
[1]Zhang Renyuan(张仁元). Phase Change Material with Phase Change Energy Storage Technology(相变材料与相变储能技术)[M].Beijing:Science Press,2009.
[2]Zhu Dongsheng(朱冬生),Li Xinfang(李新芳),Wang Nan(汪南),et al. Fundamental properties and application prospect of the phase change nanofluid as a cold storage material[J].Materials Review(材料导报),2007,21(4):87-91.
[3]Liu Yudong(刘玉东),Li Kuining(刘夔宁),He Qinbo(何钦波),et al. Study on thermal properties of low temperature nanocomposites for phase change cool storage[J].Journal of Engineering Thermophysics(工程热物理学报),2008,29(1):105-107.
[4]Wu Shuying,Zhu Dongsheng,Li Xinfang,et al. Thermal energy storage behavior of Al2O3-H2O nanofluids[J].Thermochimica Acta,2009,483(1-2):73-77.
[5]Yang Shuo(杨硕),Zhu Dongsheng(朱冬生),Wu Shuying(吴淑英),et al. Study on phase-change cold storage characteristics of Al2O3-H2O nanofluids[J].Journal of Refrigeration(制冷学报),2010,31(1):23-26.
[6]Bigg E K. The supercooling of water[J].Proceedings of the Physical Society:Section B,1953,66(8):688-694.
[7]Angel C Z. Supercooled water[J].Annual Review of Physical Chemistry,1983,34:593-630.
[8]Hong Ronghua(洪荣华),Sun Zhijian(孙志坚),Wu Jie(吴杰),et al. Experimental study on reduce supercooling degree of ice storage solution using nucleation additive[J].Journal of Zhejiang University:Engineering Science(浙江大学学报:工学版),2004,39(11):1797-1800.
[9]Chen Ying,Jia Lisi,Mo Songping. Experimental investigation of crystallization process of nanofluid by DSC[J].Journal of South University:English Edition,2010,26(2):359-363.
[10]Jia Lisi(贾莉斯),Chen Ying(陈颖),Mo Songping(莫松平).Solid-liquid phase change property of titanium dioxide nanofluid[J].Journal of Engineering Thermophysics(工程热物理学报),2011,32(11):1913-1916.
[11]He Qinbo,Wang Shuangfeng,Tong Mingwei,et al. Experimental investigation on nucleation supercooling degree of TiO2-H2O nanofluids for cool storage[J].Energy Conversion and Management,2012,64:199-205.
[12]Gong Wei,Xiao Hongyi,Yang Zhen,et al. Study of the subcooling phenomenon of phase change material with different nanoparticlcle additives for energys storage[C]//Beijing :Proceedings of the 8th International Symposium on Heat Transfer,2012:1-6.
[13]Kousksou T,Rhafiki T,Mahdaoui M,et al. Crystallization of supercooled PCMs inside emulsions:DSC applications[J].Solar Energy Materials and Solar Cells,2012,107:28-36.
[14]Jia Lisi,Chen Ying,Mo Songping. Solid-liquid phase transition of nanofluids[J].International Journal of Heat and Mass Transfer,2013,59:29-34.
[15]Yu Zitao,Fang Xin,Fan Liwu,et al. Increased thermal conductivity of liquid paraffin-based suspensions in the presence of carbon nano-additives of various sizes and shapes[J].Carbon,2013,53:277-285.
[16]Wang Jifeng,Xie Huaqing,Xin Zhong. Thermal properties of paraffin based composites containing multi-walled carbon nanotubes[J].Thermochimica Acta,2009,488(1-2):39-42.
[17]Ijima S. Helical microtubules of graphitic carbon[J].Nature,1991,354:56-58.
[18]Kim P,Shi L,Majumdar A,et al. Thermal transport measurements of individual multiwalled nanotubes[J].Physical Review Letters,2001,87(21):215502.
[19]Choi S U S,Zhang Z G,Yu W,et al. Anomalous thermal conductivity enhancement in nanotube suspension[J].Applied Physics Letters,2001,79(14):2252-2254.
[20]Indhuja A,Suganthi K S,Manikandan S,et al. Viscosity and thermal conductivity of dispersions of gum arabic capped MWCNT in water:Inf l uence of MWCNT concentration and temperature[J].Journal of the Taiwan Institute of Chemical Engineers,2013,44(3):474-479.
[21]Shi Xiaomei,Wang Jingdai,Jiang Binbo,et al. Influence of nanofiller dimensionality on the crystallization behavior of HDPE/carbon nanocomposites[J].Journal of Applied Polymer Science,2013,128(6):3609-3618.

