加速溶剂提取/GC-MS同时测定动物组织中有机氯农药和多氯联苯
佟 玲,杨佳佳,阎 妮,吴淑琪
(1.国家地质实验测试中心,北京100037; 2.中国地质大学(北京)水资源与环境学院,北京100083)
加速溶剂提取/GC-MS同时测定动物组织中有机氯农药和多氯联苯
佟 玲1,杨佳佳1,阎 妮2,吴淑琪1
(1.国家地质实验测试中心,北京100037; 2.中国地质大学(北京)水资源与环境学院,北京100083)
动物组织样品油脂含量大、干扰杂质多,对其中低含量有机氯农药及多氯联苯的分析会造成较大程度的影响。针对动物组织样品基质复杂的特点,本文以二氯甲烷-丙酮(体积比为1∶1)的溶剂体系,采用加速溶剂萃取技术对样品进行提取,在提取过程中尽量减少脂肪的共提出,然后采用凝胶渗透色谱技术去除样品中的大部分油脂,再结合弗罗里硅土为填料的固相萃取方法对样品进一步净化,能够达到充分去除油脂和小分子杂质的目的。采用气相色谱-质谱分析17种有机氯农药及7种指示性多氯联苯,各化合物的回收率在81.6%~113.4%之间,检出限在1.02~3.59 ng/g之间,技术指标优于部分国家标准。本方法改进了动物样品的净化效果,建立了凝胶渗透色谱结合固相萃取技术的净化方法,达到了样品快速自动提取、溶剂用量少、基质净化彻底的目的,降低了方法检出限,能够满足快速、准确检测动物组织中低含量持久性有机污染物的要求。
动物组织;有机氯农药;多氯联苯;加速溶剂萃取;凝胶渗透色谱;固相萃取;气相色谱-质谱法

我国曾经大量生产和使用有机氯农药(如六六六、DDTs、六氯苯等),造成目前仍然在某些地区污染较为严重[1-3]。如文献[4]报道中国南方作为饲料用小杂鱼中的DDTs含量普遍较高。多氯联苯(PCBs)作为具有良好的化学惰性、耐热性、不可燃性以及低蒸气压和高介电常数等特点的一类化合物,曾广泛应用于如变压器、电容器等电子设备中,尽管在20世纪80年代已经禁用,但我国的河流、近海等地区都有中等水平的污染[5-6]。目前国内外的大量电子垃圾涌入中国局部地区,进行拆解和回收利用,造成PCBs污染较为严重。如浙江省某电子垃圾拆解地的鸡蛋和鲫鱼中多氯联苯总量为6511.71 pg/g、21204.43 pg/g[7],远高于非拆解区。通过食物链的传递,这些有机污染物最终会对人类造成威胁,如香港学者研究发现111名健康香港居民的血浆中p,p'-DDE和PCB 180的检出率高达100%[8]。因此调查研究环境动物中有机氯农药及多氯联苯等持久性有机污染物的残留水平是非常有意义的。
为了保证分析结果的准确可靠性,前处理方法是首要考虑的问题。动物组织类样品的提取方法种类较多,如国家标准GB/T 5009.19—2008采用振荡法或匀浆搅拌法,溶剂用量大而且批量样品提取时间长[9-11],近年来加速溶剂萃取技术应用越来越广泛[12-15]。样品净化方面,由于该类样品含有大量油脂,干扰组分复杂,净化不彻底会造成结果的不准确,甚至会影响分析仪器的使用寿命,因此对净化步骤的要求较高。浓硫酸净化和凝胶渗透色谱技术多用于动物类样品的净化[16-21],结合固相萃取、基质固相分散等技术也有文献报道[22-23]。如科威特研究人员采用加压液体萃取技术提取海洋动物样品中的有机氯农药和多氯联苯,样品净化采用配有硅胶小柱的全自动净化仪,洗脱溶剂为正己烷、正己烷与二氯甲烷的混合溶剂共130 mL。去除脂肪采用凝聚渗透色谱,方法的重复性精密度在69.2%~119%之间,鲜样的方法检出限在0.04~7.48 ng/g之间[24]。
本文选用加速溶剂萃取方法对冷冻干燥后的样品进行提取,建立了凝胶渗透色谱结合固相萃取技术的净化方法,达到了样品快速自动提取、溶剂用量少、净化彻底的目的。针对17种有机氯农药及7种指示性多氯联苯采用气相色谱-质谱进行定性定量分析,该方法能满足环境动物组织样品中痕量持久性有机污染物检测的需求。
1 实验部分
1.1 仪器设备
DIONEX ASE 200型加速溶剂萃取仪(美国戴安公司);T25基本型均质器,配有S25 N-18G分散刀头(德国IKA公司);ALPHA 2-4/LSC-16冷冻干燥机(德国Marin Christ公司);KL512/509J型12位恒温水浴氮吹仪(北京康林科技股份有限公司);旋转蒸发仪:Rotavapor R-210(BUCHI公司);电子天平MXX-212(最大称重210 g,精度0.01 g,北京赛多利斯仪器系统有限公司)。
自动凝胶渗透色谱仪(LabTech公司),色谱柱:内径20 mm,长度300 mm,色谱柱填料为Bio-Beads SX-3;12管防交叉污染固相萃取装置(美国Supelco公司)。
Varian 450GC-240MS气相色谱-质谱联用仪,配备离子阱质量分析器和8400自动进样器,DB-5MSUI毛细管色谱柱(30 m×0.25 mm×0.25 μm,J&W公司)。
1.2 主要试剂及材料
25种化合物(具体化合物见表1)标准溶液:浓度分别为10.0 μg/g(异辛烷相),购自中国计量科学研究院,使用前配制成1.0 μg/g混合标准溶液(换算成体积浓度为0.69 μg/mL),待用。
替代物(2,4,5,6-四氯间二甲苯、PCB 103和PCB 204)单个标准溶液浓度为10.0 μg/g(异辛烷相),用正己烷配制成1.00 μg/mL混合标准溶液,备用。
正己烷、丙酮、二氯甲烷均为色谱纯,无水硫酸镁(分析纯)。
固相萃取材料:SPE小柱 (CNWBOND FLORISIL SPE TUBES,2 g,6 mL,德国CNW公司)。吸附剂填料:弗罗里硅土(60~100目,国家Sigma-Aldrich公司)。
1.3 样品前处理方法
样品制备:动物组织样品采集后,取可食部分进行绞碎。在冷冻干燥器中冷冻干燥48 h后取出,保证样品不含水分,然后进行研磨粉碎,置于冰箱冷藏待用。
样品ASE提取:ASE萃取池中依次加入5 g弗罗里硅土,准确称取1.5 g冻干样品及相应替代物(浓度为40 ng/mL)。ASE提取的提取溶剂为二氯甲烷-丙酮(体积比1∶1)。系统压力10 MPa(约1500 psi),温度90℃,加热时间5 min,静态时间5 min,冲洗体积60%,循环2次。
样品净化:采用凝胶渗透色谱(GPC)结合固相萃取(SPE)的净化方式进行净化。①GPC净化:浓缩后的提取液用二氯甲烷定容至3 mL,GPC定量环为2.0 mL(最终浓缩上机时实际样品分析量为1 g干样),流速为4 mL/min,流动相为二氯甲烷。收集保留时间为14~21 min的淋洗液,氮吹浓缩过程中逐步加入正己烷,使浓缩液最终换为正己烷相,体积1~2 mL,待下一步净化。②SPE净化:选用弗罗里硅土小柱。SPE柱先分别用淋洗液和正己烷各10 mL预淋洗,然后上样净化,用9 mL正己烷-乙酸乙酯淋洗液(体积比9∶1)进行洗脱并收集,洗脱液浓缩后正己烷定容至1 mL。待上机分析。
1.4 气相色谱-质谱分析条件
1.4.1 气相色谱条件
气相载气为氦气,纯度99.999%;恒流模式,柱流量0.8 mL/min,进样口温度270℃,不分流进1.5 min,进样体积1 μL。升温程序:初始温度60℃,以20℃/min升至220℃,保持12 min,再以25℃/min升至 280℃,保持 4 min,再以 3.0℃/min升至300℃。总分析时间为37.07 min。
1.4.2 质谱条件
电离方式为电子轰击源(EI),传输线温度280℃,离子阱温度200℃,真空室温度40℃,灯丝电流10 μA,电子倍增器电压50 V,溶剂延迟时间10 min。
2 结果与讨论
2.1 样品制备
动物组织样品鲜样用四分法取样,在瓷盘中迅速切碎后放入高速组织捣碎机内,捣碎1~2 min。肉糜状样品在冷冻干燥器中冷冻干燥48 h后取出,进行研磨粉碎,置于冰箱中冷藏待测。选用猪肉、牛肉、鸡肉、鱼肉四类样品进行研究,冷冻干燥后采用称重法计算含水率在72%~76%之间。冷冻干燥后的样品便于ASE提取,省去了样品提取液的除水步骤,提高了样品的提取效率。干燥样品取样量为1.5 g时相当于鲜样6 g左右。
2.2 提取方法优化
本文比较了匀浆提取和ASE两种提取方法,同时优化ASE的提取条件。新鲜样品绞碎后采用匀浆提取,每个样品提取2次共用100 mL溶剂,每次1~2 min,合并提取液过滤除水、浓缩后上机分析,各化合物的回收率在71%~109%之间。可以看出,这两种提取方法均能对样品进行很好的提取,匀浆提取时间短,适用于新鲜样品的提取,但操作复杂需除水过滤、溶剂用量大。ASE提取技术能够实现自动化,同时提取时在萃取池中加入5 g弗罗里硅土能达到在线去除少量脂肪的目的。
ASE提取过程的主要影响因素是压力和温度[25]。提取温度的升高有利于克服基体效应,降低溶剂黏度,加速溶剂分子向基体中扩散,提高提取效率及速度。但温度过高时,有些沸点低的化合物容易挥发造成回收率降低[26-27]。在一定的压力下,升高温度有利于提高萃取效率[28],本研究根据选择提取溶剂的特点,在其他提取参数不变的情况下,分别考察了80℃、90℃、100℃和110℃四种温度对ASE提取效率的影响,结果如图1所示。采用二氯甲烷-丙酮混合溶剂(体积比1∶1)进行提取,动物组织中的脂肪提取效率较低。当温度为90℃时提取回收率相对较高,并结合二氯甲烷和丙酮的沸点等特性,最终ASE选取90℃作为动物组织样品的提取温度,循环2次作为提取次数,此时回收率能达到很好的结果。
2.3 净化方法
由于动物组织样品含有大量的油脂,对于样品分析及仪器系统会造成很大干扰,采用GPC净化能够去除大部分油脂。流动相为二氯甲烷,流速为4 mL/min,目标化合物流出时间为14~21 min,收集该时间段的流出液,浓缩后上机。加标回收率在85.3%~116.2%之间,满足分析的要求。从图2可以看出,鱼肉、牛肉、鸡肉、猪肉等动物组织样品提取液与标准品在保留时间上的差别,经过GPC净化大部分脂肪能被除去。
以基质较为复杂的牛肉样品为例进行研究,经过GPC净化的样品提取液浓缩挥干后仍然能看到少量油脂的存在。当采用2 g弗罗里硅土SPE小柱净化后,能进一步除去样品中的油脂。采用样品提取液浓缩后称量脂肪含量的方法比较了不同净化方式的净化效果,从表1的数据可以看出样品采用GPC结合SPE的净化方式处理后含油脂量最少,对油脂类杂质的净化效果最好。

表1 采用不同净化方法时样品提取液的脂肪含量Table 1 The lipids content of the sample extracted by different clean-up methods

图1 ASE不同提取温度时各化合物的提取回收率Fig.1 The recoveries of extraction for 25 compounds by ASE at different temperatures
同时发现样品经GPC净化的浓缩液其全扫描色谱图中保留时间为29.7 min时有大干扰峰,经质谱分析其分子量为386.66,推测为胆固醇,通过GPC净化无法去除该类小分子化合物。SPE的净化能够有效减少胆固醇的含量,从图3可以明显看出样品经GPC结合SPE净化后胆固醇的含量明显降低,对于动物组样品净化效果较好。
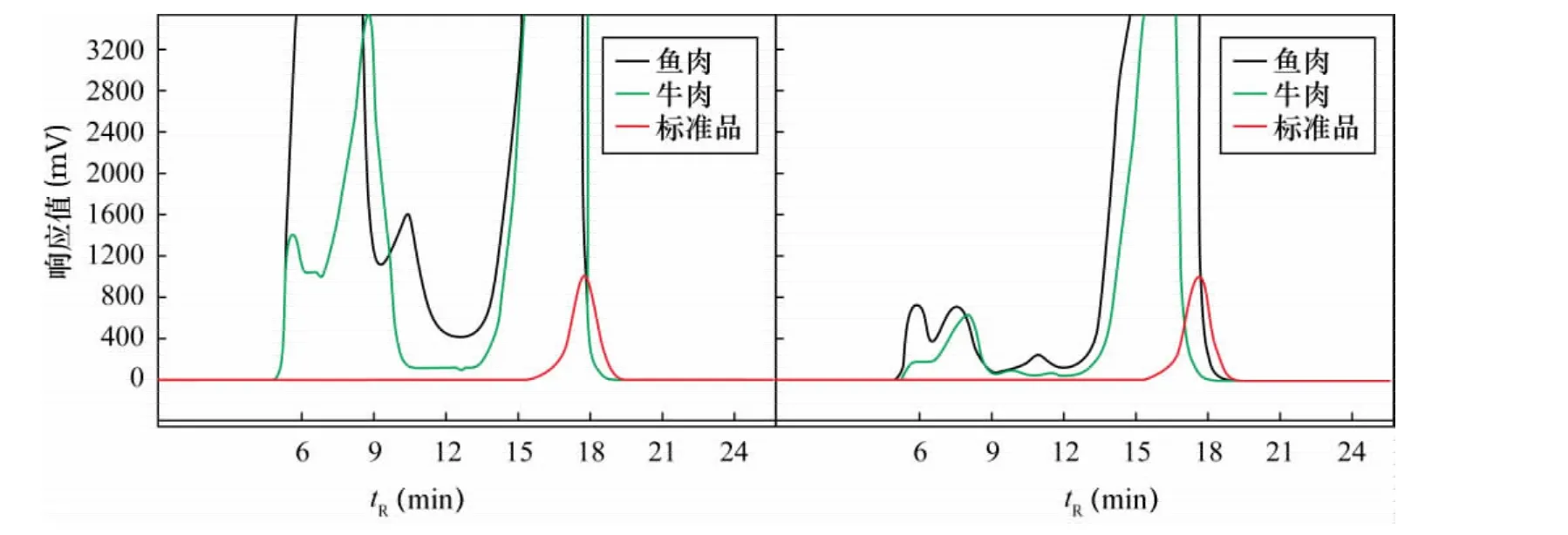
图2 鱼肉、牛肉、鸡肉、猪肉的GPC紫外色谱图Fig.2 The chromatograms of UV by GPC for fish,beef,chicken,pork
2.4 方法线性范围
混合标准溶液稀释配制成不同的浓度点以便绘制标准曲线,采用外标标准曲线法进行定量。根据仪器响应情况确定不同化合物的线性范围为:狄氏剂17.25~172.50 ng/mL,异狄氏剂13.8~345.00 ng/mL,其余有机氯农药3.45~172.50 ng/mL,多氯联苯分量1.725~86.25 ng/mL。标准曲线相关系数大于0.994。气相色谱-选择离子质谱(GC-SISMS)及标准曲线数据见表2。28种化合物的色谱图见图4。
2.5 方法检出限和回收率
选用超市购买的鸡肉样品作为空白样品(事先经过测定未含待测物)。准确称取冷冻干燥后的样品1.5 g,加入60 μL浓度为1.00 μg/mL的3种替代物混合标准溶液。低添加浓度水平中狄氏剂、异狄氏剂浓度为22.08 ng/g,其余有机氯农药为11.04 ng/g,多氯联苯分量5.52 ng/g;高浓度添加水平中狄氏剂、异狄氏剂浓度为55.2 ng/g,其余化合物为27.6 ng/g。按照上述前处理方法进行处理,重复添加分析7个样品,GC-SIS-MS检测,考察方法精密度。并根据低浓度添加回收数据按照EPA推荐方法,采用标准偏差计算得出方法检出限(MDL)。各个化合物的添加回收率及检出限数据见表3。
本方法采用冷冻法干燥样品后进行ASE提取结合在线柱净化,提取液经凝胶渗透色谱结合固相萃取柱二次净化,有效地除去了样品中干扰物质,25种目标化合物的平均回收率在81.61%~113.35%之间,精密度(RSD)在3.0%~14.3%之间,替代物的平均回收率在73.27%~104.9%之间。各化合物的方法检出限在1.02~3.59 ng/g之间,优于部分国家标准,如“GB/T 2795—2008”采用气相色谱质谱法测定冻兔肉中有机氯及拟除虫菊酯类农药(其中相关化合物的检出限为10~50 ng/g)。

图3 牛肉样品采用GPC及GPC结合SPE净化后的全扫描色谱图Fig.3 The full scan chromatograms of beef by clean-up method with GPC or GPC combined with SPE
2.6 样品检测
采用建立的方法对北京市场上购买的动物样品(鲤鱼、虾、牛肉、猪肉)进行检测,考察方法适用性。先对样品进行制备,均匀取样后冷冻干燥待检测,按照上述前处理步骤操作每份样品平行分析2次取平均检测结果。从分析数据(表4)看出,替代物回收率在73.0%~107.9%之间,符合残留分析技术的要求。实际样品
中有检出的目标物检测结果见表4,其余化合物均未检出,检出的浓度较低,符合相关食品标准的要求。

表2 25种化合物的GC-SIS-MS分析定性、定量离子及标准曲线相关系数Table 2 The quantitative ions and qualitative ions of GC-SIS-MS and correlation coefficient of standard work curve for 25 compounds

图4 28种化合物GC-SIS-MS的TIC色谱图Fig.4 The total ions chromatogram for 28 compounds by GC-SIS-MS

表3 精密度、准确度及方法检出限Table 3 The precision,accuracy and detection limits of the method

表4 实际样品检测结果Table 4 Analytical results of actual samples
3 结语
本文建立了动物组织类样品中17种有机氯农药及7种指示性多氯联苯的GC-SIS-MS分析方法,该方法的检出限在1.02~3.59 ng/g之间。主要针对动物组织样品含有大量脂肪的特点,采用ASE提取及在线净化,结合GPC与SPE的净化步骤,能够很好地去除动物组织样品中的大量干扰物质,对样品净化较为彻底,减少了对仪器系统的污染,提高了分析的准确度及灵敏度。同时ASE的自动提取也降低了对分析人员的危害,前处理过程的溶剂使用量也大大减少。
该方法能够应用于生态地球化学调查中,满足地质调查的需要。今后结合更高灵敏度的分析仪器如高分辨质谱等,可以朝着更快速、廉价的净化技术和更高分析灵敏度的方法进行研究。
[1] 席英玉.动物性食品中有机氯农药多残留检测方法的研究[J].福建水产,2006(2):38-43.
[2] 张海秀.农业环境中有机氯农药污染现状及危害[J].科技信息,2009(14):548-549.
[3] Liu X,Zhang G,Li J,Yu L L,Xu Y,Li X D,Kobara Y,Jones K C.Seasonal patterns and current sources of DDTs,chlordanes,hexachlorobenzene,and endosulfan in the atmosphere of 37 Chinese cities[J].Environmental Science&Technology,2009,43:1316-1321.
[4] Guo Y,Yu H Y,Zhang B Z,Zeng E Y.Persistent halogenated hydrocarbons in fish feeds manufactured in South China[J].Journal of Agricultural and Food Chemistry,2009,57:3674-3680.
[5] 王泰,张祖麟,黄俊,胡洪营,余刚,李发生.海河与渤海湾水体中溶解态多氯联苯和有机氯农药污染状况调查[J].环境科学,2007,28(4):730-735.
[6] 韩关根,徐盈,凌波,梁鹰,沈阿根.环境多氯联苯污染状况研究[J].卫生研究,2006,35(2):168-174.
[7] 宋杨,吴南翔,韩见龙,沈海涛,谭玉凤,丁刚强,项菊香,陶核,金顺亮.某电子垃圾拆解地鲫鱼和鸡蛋中二英和多氯联苯的污染状况研究[J].环境与健康,2011,28(4):328-331.
[8] Qin Y Y,Leung C K M,Lin C K,Leung A O W,Wang H S,Giesy J P,Wong M H.Halogenated POPs and PAHs in Blood Plasma of Hong Kong Residents[J].Environmental Science&Technology,2001,45:1630-1637.
[9] Moliner-Martinez Y,Campíns-Falcó P,Molins-Legua C,Segovia-Martínezb L,Seco-Torrecillasb A.Miniaturized matrix solid phase dispersion procedure and solid phase microextraction for the analysis of organochlorinated pesticides and polybrominated diphenylethers in biota samples by gas chromatography electron capture detection[J].Journal of Chromatography A,2009,1216: 6741-6745.
[10] Rezaeia F,Hosseini M R M.New method based on combining ultrasonic assisted miniaturized matrix solidphase dispersion and homogeneous liquid-liquid extraction for the determination ofsome organochlorinated pesticides in fish[J].Analytica Chimica Acta,2011,702:274-279.
[11] 李君君,李力军,徐惠诚,赵增强,高彬,刘琨.动物源性食品中农药多残留检测前处理技术研究进展[J].中国食品卫生杂志,2012,24(4):403-407.
[12] 吴刚,赵珊红,俞春燕,王华雄,叶庆富,吴慧明.加速溶剂萃取-GPC气相色谱(μ-ECD)快速分析动物源性食品中多种电负性农药残留量[J].中国食品学报,2009,9(2):162-170.
[13] Oukebdane K,Portet-Koltalo F N.Machoura,Dionnet F,Desbene P L.Comparison of hot Soxhlet and accelerated solventextractionswith microwave and supercritical fluid extractions for the determination of polycyclic aromatic hydrocarbons and nitrated derivatives strongly adsorbed on soot collected inside a diesel particulate filter[J].Talanta,2010,82:227-236.
[14] Chung S W C,Chen B L S.Determination of organochlorine pesticide residues in fatty foods:A critical review on the analytical methods and their testing capabilities[J].Journal of Chromatography A,2011,1218:5555-5567.
[15] Beck J,Totsche K U,Kögel-Knabner I.A rapid and efficient determination of natural estrogens in soils by pressurised liquid extraction and gas chromatographymassspectrometry[J].Chemosphere,2008,71: 954-960.
[16] Saito K,Sjodin A,Sandau C D,Davis M D,Nakazawa H,Matsuki Y,Patterson JD G.Developmentofa accelerated solventextraction and gelpermeation chromatography analytical method for measuring persistent organohalogen compounds in adipose and organ tissue analysis[J].Chemosphere,2004,57: 373-381.
[17] 潘娟,华贤辉,商军.毛细管气相色谱法测定动物性食品中六六六和滴滴涕的残留量[J].中国兽药杂志,2009,43(3):46-49.
[18] 周萍萍,陈惠京,赵云峰,吴永宁,荫士安.动物性食品中持久性有机氯农药的残留分析[J].中国食品卫生杂志,2010,22(3):193-198.
[19] 佟玲,杨佳佳,吴淑琪,张玲金.沉积物样品中干扰物的去除及多种持久性有机污染物气相色谱分析[J].岩矿测试,2011,30(5):601-605.
[20] 曹忠波,高岩,贾宏新.凝胶渗透色谱和固相萃取净化气相色谱-质谱法检测动物性食品中26种有机氯农药残留[J].中国卫生检验杂志,2012,22(7): 1550-1555.
[21] 纪欣欣,石志红,曹彦忠,石利利,王娜,庞国芳.凝胶渗透色谱净化/液相色谱-串联质谱法对动物脂肪中111种农药残留量的同时测定[J].分析测试学报,2009,28(12):1433-1439.
[22] 吴刚,鲍晓霞,王华雄,俞春燕,吴慧明,叶庆富.加速溶剂萃取-凝胶渗透色谱净化-气相色谱快速分析动物源性食品中残留的多种有机磷农药[J].色谱,2008,26(5):577-582.
[23] Wang H,Zhang J,Gao F,Yang Y,Duan H,Wu Y,Berset J D,Shao B.Simultaneous analysis of synthetic musks and triclosan in human breast milk by gas chromatography tandem mass spectrometry[J].Journal of Chromatography B,2011,879:1861-1869.
[24] Helaleh M I H,Al-Rashdan A,Ibtisam A.Simultaneous analysis of organochlorinated pesticides(OCPs)and polychlorinated biphenyls(PCBs)from marine samples using automated pressurized liquid extraction(PLE) and Power PrepTMclean-up[J].Talanta,2012,94: 44-49.
[25] Richter B E,Jones B A,Ezzell J L,Porter N L.Accelerated solvent extraction:A technique for sample preparation[J].AnalyticalChemistry,1996,68: 1033-1039.
[26] Wu G,Bao X,Zhao S,Wu J,Han A,Ye Q.Analysis of multi-pesticide residues in the foods of animal origin by GC-MS coupled with accelerated solvent extraction and gel permeation chromatography cleanup[J].Food Chemistry,2011,126:646-654.
[27] 程悦,贾倩楠,邹晓莉.加速溶剂萃取在农药检测中的应用[J].现代预防医学,2012,39(14): 3627-3631.
[28] Lang Y H,Cao Z M,Nie X H.Extraction of organochlorine pesticides in sediments using Soxhlet,ultrasonic and accelerated solvent extraction techniques[J].Journal of Ocean University of China,2005,4(2):173-176.
Simultaneous Analysis of Organochlorinated Pesticides and Polychlorinated Biphenyls from AnimalTissue using Gas Chromatography-Mass Spectrometry Combined with Accelerated Solvent Extraction
TONG Ling1,YANG Jia-jia1,YAN Ni2,WU Shu-qi1
(1.National Research Center for Geoanalysis,Beijing 100037,China; 2.School of Water Resources&Environment,China University of Geosciences(Beijing),Beijing 100083,China)
The majority of fat and impurities in animal tissues influence the analysis result for low concentration organic compounds.To overcome this issue,the animal sample was extracted by accelerated solvent extraction (ASE)with methylene chloride/acetone(V∶V=1∶1),which reduced the co-extraction lipids during the extraction process.Gel Permeation Chromatography(GPC)combined with solid phase extraction(SPE)was applied to remove lipids from the sample solution.The GPC can remove most of the macromolecular lipids in samples,and the SPE with florisil can sufficiently reduce fat and small molecule impurity.The accuracy and sensitivity of the method can be improved by this pretreatment process.The compounds,including 17 organochlorinated pesticides and 7 indicator polychlorinated biphenyls in animal tissue,can be simultaneously analysed by Gas Chromatography Mass Spectrometry.The recoveries of 25 of the target compounds were in the range of 81.6%-113.4%and the method detection limits for dry samples were 1.02-3.59 ng/g.These results were superior to those of the national standard.This method improved the purification effect of animal samples,reduced the method detection limit,and enhanced the accuracy.It can be used to quickly and accurately determine the low content of persistent organic pollutants in animals.
animal tissue;organochlorine pesticides;polychlorinated biphenyls;accelerated solvent extraction; Gel Permeation Chromatography;solid phase extraction;Gas Chromatography-Mass Spectrometry
S482.32;O625.21;O657.63
A
0254-5357(2014)02-0262-08
2013-07-17;接受日期:2013-08-13
中国地质调查局地质调查工作项目(1212010816028);国土资源公益性行业科研专项(200911044-02-2)
佟玲,副研究员,主要从事环境有机污染物分析工作。E-mail:winter_tl@sina.com。

