特异性小干扰RNA沉默Itch基因增强小鼠T细胞对MFC胃癌细胞的免疫杀伤作用
湖北民族学院附属民大医院急诊科,湖北 恩施 445000
特异性小干扰RNA沉默Itch基因增强小鼠T细胞对MFC胃癌细胞的免疫杀伤作用
粟英 兰亚明 卢义琼 田国红 胡烈献
湖北民族学院附属民大医院急诊科,湖北 恩施 445000
背景与目的:Itch蛋白是一种具有调节T细胞免疫应答起始的关键分子,属于E3泛素转移酶家族,广泛参与细胞内多种信号蛋白如ZAP70、P85、VAV、PLC-γ和PKC-θ等的泛素化修饰过程,在肿瘤诱导机体免疫耐受中起着重要作用。Itch通过调节T细胞表面受体活性及转移生长因子-β信号通路来介导T细胞免疫无反应性,诱导外周组织Treg细胞增殖。因此,通过改变Itch蛋白表达活性有望成为一种治疗自体免疫性疾病和肿瘤的有效途径。我们利用特异性小干扰RNA(small interfering RNA,siRNA)沉默T细胞Itch基因的表达,观察转染T细胞对小鼠MFC胃癌细胞的体外免疫杀伤作用。方法:分离615小鼠脾脏T细胞,筛选高效特异性沉默Itch基因的siRNA序列转染T细胞,蛋白质印迹法检测各分组Itch蛋白的表达水平;转染72 h后,利用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测细胞因子IL-2、INF-γ分泌情况,比较空白组、空转组及转染组T细胞与小鼠MFC胃癌细胞混合培养肿瘤杀伤率。结果:转染48 h后,与对照组相比,转染T细胞Itch蛋白表达率降低至16%;转染72 h后,检测转染组、空转组、空白组细胞因子IL-2分泌水平分别为(1 891.96±141.91)pg/mL,(1 241.69±91.67)pg/mL,(1 175.03±89.14)pg/mL(P<0.001),转染组、空转组、空白组细胞因子INF-γ分泌水平分别为(958.33±75.46)pg/mL,(683.33±66.67)pg/mL,(691.72±68.72)pg/mL(P<0.05)。在体外实验中,与空白组及空转组T细胞相比,转染组T细胞能更高效地杀伤小鼠MFC胃癌细胞,最高杀瘤率达到(54.18±2.96)%。结论:利用特异性siRNA技术沉默Itch基因能够促进小鼠T细胞因子IL-2、INF-γ分泌,增强T细胞对小鼠MFC胃癌细胞的体外免疫杀伤作用。
Itch;基因沉默;T淋巴细胞;胃肿瘤;免疫疗法
胃癌是全球最常见的恶性肿瘤之一,全球超过40%的胃癌患者发生在中国,死亡率居全部恶性肿瘤第2位[1]。对于大多数胃癌患者,外科手术是目前最主要的治疗手段,但术后5年生存率不超过20%[2]。对于晚期转移性胃癌,因丧失手术切除时机,对放化疗敏感性不高,易产生化疗耐药现象,难以获得持久缓解,预后较差。肿瘤免疫治疗通过激发或调动机体的免疫系统,增强肿瘤微环境抗肿瘤免疫力,从而控制和杀伤肿瘤细胞,通过增强T细胞抗肿瘤免疫可望成为一种治疗晚期胃癌的有效途径。Itch蛋白是一种与T细胞活化和耐受直接相关的E3泛素链接酶,其通过泛素化T细胞信号转导通路中PLC-1、PKC-θ、JunB、notch等底物蛋白以负性调节受体信号和诱导免疫耐受[3]。有实验研究表明Itch-/-T淋巴细胞明显活化,能直接通过MHC-TCR/CD3相互作用激活T细胞,诱导TH2细胞增殖分化,促进细胞因子IL-4、IL-5分泌,提高血清IgE水平,增强机体抗肿瘤免疫[4]。在本实验中,我们体外观察Itch基因沉默的转染T细胞对于615小鼠MFC胃癌细胞的免疫杀伤作用,为以Itch基因为靶向免疫治疗胃癌做出一定探索。
1 材料和方法
1.1 实验动物和细胞株
615小鼠购于上海中国科学院,SPF级,6周龄,体质量约15~20 g。利用美天尼免疫磁珠分离615小鼠脾脏T细胞,T细胞纯度达94.2%,培养基配置:90%1640培养基、10%胎牛血清、0.197 g NaHC03、0.000 5 g ConA(5 μg/mL)。小鼠MFC胃癌细胞源自615小鼠前胃鳞癌移植瘤FC瘤组织,小块法培养得到,购自上海中国科学院细胞库,培养基配置:90%1640培养基、10%胎牛血清、0.197 g NaHC03、青霉素(100 IU/mL)、链霉素(l00 μg/mL)。
1.2 Itch siRNA设计合成
根据pubmed GENE信息查询615小鼠ItchmRNA序列,打开Ambion公司在线设计软件确定针对小鼠Itch基因的siRNA靶序列,根据siRNA设计原则进行筛选得出4条符合条件的siRNA。序列如下:siRNA-1:正义链5’-CCACAACACUCGGAUUACUTT-3’,反义链 5’-AGUAAUCCGAGUGUUGUGGTT-3’;siRNA-2:正义链 5’-GCAAGCAGAUCAUGUGG UUTT-3’,反义链5’-GCAAGCAGAUCAU GUGGUUTT-3’;siRNA-3:正义链 5’-CACCUUAGUUACAUUUCAUTT-3’,反义链 5’-AUGAAAUGUAACUAAGGUGTT-3’;siRNA-4:正义链5’-GUAAUCCAACACCUUAGU UTT-3’,反义链5’-AACUAAGGUGUUGGAUUA CTT-3’。所有siRNA序列均由上海吉凯基因技术有限公司合成。
1.3 T淋巴细胞转染
T细胞在6孔板中培养至细胞80%~90%融合时,用PBS缓冲液洗涤细胞3次,用Opti-MEM培养基稀释吹打成单细胞悬液,按浓度1×105个/mL接种96孔板,每孔100 μL。按转染内容和目的不同,设转染组、空转组和空白组共3组,转染组将LipofectamineTM2000脂质体和4条siRNA、阴性对照分别溶于5 μL opti-MEM培养基中,LipofectamineTM2000脂质体和siRNA含量各为0.5、1.5 μL(siRNA终浓度为200 nmol/L),室温放置5 min。轻轻混匀上述2管液体,室温温育20 min。将转染混合物加入96孔板中,混匀后,加入小鼠CD3功能性抗体15 μL。37 ℃温育6 h,加入20 μL胎牛血清。空转组中每孔加入等量阴性对照siRNA序列和LipofectamineTM2000脂质体,空白组则仅加入等量opti-MEM培养基,其余处理同转染组。另外利用荧光标记的siRNA(FAM-siRNA)检测转染效率,方法同上,转染6 h后荧光显微镜下观察转染效果,流式细胞仪检测转染效率。
1.4 Western blot检测蛋白表达
T细胞转染后继续培养48 h,1 000 r/min离心5 min,PBS缓冲液洗1遍,全蛋白提取试剂盒提取T淋巴细胞蛋白,Lowry法测定蛋白浓度,取蛋白样品对目的蛋白Itch的表达水平进行检测,转PVDF膜80 V 2 h后,TBST稀释的BSA(浓度1%)封闭l h,剪膜,加入一抗(1∶1 000稀释) 4 ℃过夜温育,加入HRP标记二抗(l∶1 500稀释)室温温育45 min,ECL显色系统定影显色,观察杂交条带。
1.5 ELISA检测细胞因子IL-2,INF-γ分泌变化
参照凯基ELISA试剂盒说明要求,转染48 h后,取细胞培养上清液,把标准品、稀释液和待测样品分别加入酶标板中,每孔0.1 mL。37 ℃反应120 min后,加入0.1 mL生物素抗小鼠细胞因子IL-2、INF-γ抗体工作液,37 ℃反应60 min。加入亲和素过氧化物酶复合物的工作液0.1 mL,37 ℃反应30 min。每孔依次加入TMB显色液,37 ℃避光反应30 min,加入0.1 mL终止液,酶联免疫监测仪450 nm测定A值。
1.6 肿瘤杀伤率测定
转染T细胞24 h后,将转染T细胞、阴性对照T细胞及单纯T细胞分别与MFC胃癌细胞按照效靶比40∶1、20∶1、10∶1接种于96孔板,每组3个复孔,体积各为100 μL。同时设单纯T细胞和单纯肿瘤细胞作为效应细胞组和靶细胞组,每孔100 μL。共同培养72 h后,CCK-8试剂盒测定各组T细胞对小鼠MFC胃癌细胞的肿瘤杀伤作用。肿瘤杀伤率计算公式如下[5]:
肿瘤细胞杀伤率(%)=[(AE+AT)- AE+T]/AT×100%
AE+T=效应细胞+靶细胞孔A值
AE=相应浓度单独效应细胞的A值
AT=相应浓度单独靶细胞的A值
1.7 统计学处理
2 结 果
2.1 T淋巴细胞转染率测定及Itch蛋白表达
LipofectamineTM2000脂质体转染T淋巴细胞6 h后,流式细胞仪检测T淋巴细胞转染率达81.39%(图1),荧光镜下观察视野中绿色荧光亮点(图2)。Western blot检测各组蛋白表达,可见4条siRNA抑制率分别是52%、24%、18%和84%,阴性对照组与空白组差异不大,siRNA-1抑制率最高,达84%,表明siRNA-1序列能高效特异性抑制615小鼠脾脏T细胞Itch蛋白表达(图3)。
2.2 沉默Itch基因能增加T细胞因子IL-2,INF-γ分泌水平
转染48 h后,ELISA检测各分组T细胞上清液中细胞因子IL-2、INF-γ分泌水平变化,测定结果表明转染组、空转组、空白组细胞因子IL-2分泌水平分别为(1 891.96±141.91) pg/mL、(1 241.69±91.67)pg/mL和(1 175.03± 89.14)pg/mL,转染组IL-2水平较空转组和空白组均明显升高(P<0.001);转染组、空转组、空白组细胞因子INF-γ分泌水平分别为(958.33±75.46)pg/mL、(683.33±66.67)pg/mL和(691.72±68.72)pg/mL,转染组INF-γ水平较空转组和空白组有所增加(P<0.05,图4)。

图1 FAM-siRNA转染T淋巴细胞效率Fig. 1 Transfection ef fi ciency of FAM-siRNA for T lymphocyte

图2 T淋巴细胞荧光转染图Fig. 2 T lymphocyte fl uorescence transfection picture(×100)

图3 Itch蛋白表达Fig. 3 The expression of The Itch protein

图4 转染48 h后细胞因子IL-2、INF-γ分泌水平Fig. 4 The secretion level of IL-2, INF-γ after 48 hours of transfection
2.3 沉默Itch基因能增强小鼠T细胞对MFC胃癌细胞免疫杀伤
转染T细胞与MFC胃癌细胞共同培养72 h后,在各个不同效靶比水平转染组T淋巴细胞均较空转组及空白组T细胞杀瘤活性增强(P<0.05),随着靶效比升高,T细胞对于MFC胃癌细胞杀伤率亦逐渐增加,当效靶比为40∶1时,转染组T细胞杀伤肿瘤细胞活性最高,达到(54.18±2.96)%(图5)。
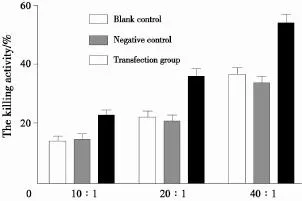
图5 共同培养72 h后后肿瘤杀伤率测定Fig. 5 The killing activity measurement after co-cultured 48 h
3 讨 论
目前认为诱导抗肿瘤免疫应答较其他肿瘤治疗方法具有明显优势,表现在一方面刺激活化的特异性T淋巴细胞不断地增殖活化并在体内游走,能清除体内一切表达有特异性肿瘤免疫原性的肿瘤细胞;另一方面,免疫系统会产生对肿瘤细胞的记忆和监视能力从而有效防止肿瘤复发[6]。胃癌发生、发展与机体免疫密切相关,有学者证实胃癌患者血液中能够分离出针对癌细胞的肿瘤特异性T淋巴细胞,而肿瘤特异性T细胞在肿瘤组织中的大量增殖浸润可明显改善患者预后[7-8]。而胃癌患者肿瘤组织中髓源性抑制细胞和Treg细胞增殖可明显抑制抗肿瘤免疫应答,减少细胞毒性T细胞的产生,此类患者通常预后较差[9]。目前应用于胃癌免疫疗法研究主要包括非特异性免疫刺激剂、肿瘤疫苗和单克隆抗体及过继免疫治疗等,并取得一定进展。已有Ⅲ期临床实验结果表明胃癌患者接受CTLA-4单克隆抗体治疗,其总体生存期和无进展生存期均优于安慰剂组,且副作用小,机体耐受良好[10]。而Bazas等[11]研究结果也表明,在应用了自体肿瘤细胞疫苗的86例胃癌患者中,超过30%的Ⅲ期胃癌患者和14%的Ⅳ期胃癌患者3年生存率有一定程度提高。T细胞通过介导细胞免疫直接杀伤肿瘤细胞,在机体抗肿瘤免疫过程中扮演关键作用,而Itch蛋白在T淋巴细胞活化增殖及分化诱导过程中起着重要的负性调节作用。T淋巴细胞活化是一系列复杂的级联反应,需要多种活性蛋白酶的参与和调节[12],而肿瘤从启动到效应整个阶段中均伴随着CD4+CD25+FOX3+调节性T细胞增殖,后者有利于肿瘤免疫耐受微环境形成[13]。E3泛素连接酶Itch蛋白通过泛素化T淋巴细胞活化信号通路的酪氨酸激酶及其下游重要信号蛋白分子来负性调节受体信号和诱导免疫无反应性,以达到精细调节抗原受体信号和免疫应答[14]。研究表明Itch 基因缺失的人[15]或小鼠[16]均发生严重的自身免疫和炎性反应疾病,表现为肝脾肿大,广泛的多器官(肺、肝脏、肠等)自体免疫性疾病,病理活检示:肝、脾、肺等脏器淋巴细胞和巨噬细胞大量增殖与广泛浸润。因此,Itch蛋白的负性免疫调控作用为以Itch基因为靶向激活T细胞免疫治疗胃癌提供了可能。
本实验首先选取验证有效的特异性Itch siRNA序列,通过脂质体转染615小鼠脾脏T细胞以高效抑制Itch蛋白表达。细胞因子通过影响免疫细胞增殖分化,广泛参与机体免疫应答,具有抗肿瘤、免疫调节等多种生物活性。我们的实验结果表明,转染48 h后,转染组细胞因子IL-2、INF-γ分泌水平明显升高,表明沉默Itch基因能诱导T淋巴细胞活化。我们进一步体外观察siRNA沉默Itch基因能否提高T淋巴细胞对于MFC胃癌细胞的体外免疫杀伤作用。T细胞通过识别肿瘤细胞表面的肿瘤抗原肽-MHCⅠ类分子复合物,进而增殖分化,并通过FasL/Fas、颗粒酶等多种途径杀伤肿瘤细胞。T细胞与靶细胞混合培养72 h,在不同靶效比情况下,转染组T细胞均较空转组及空白组具有更强的杀瘤活性。当效靶比为40∶1时,肿瘤杀伤力最强,达到(54.18±2.96)%,这提示通过siRNA技术沉默T细胞Itch基因以增强其对于MFC胃癌细胞的细胞毒作用是可能的。当然,这种肿瘤抑制作用还需要进一步验证,必要时需要进行相关动物实验研究。总之,我们的体外实验证实利用特异性小干扰RNA技术沉默Itch基因能够一定程度地增强T淋巴细胞对MFC胃癌细胞的免疫杀伤作用。
[1] JEMAL A, BRAY F, CENTER M M, et a1. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90.
[2] PAOLETTI X, OBA K, BURZYKOWSKI T, et al. Benefit of adjuvant chemotherapy for resectable gastric cancer: a metaanalysis[J]. JAMA, 2010, 303(17): 1729-1737.
[3] LIU Y C. The E3 ubiquitin ligase Itch in T cell activation, differentiation, and tolerance[J]. Semin Immunol, 2007, 19(3): 197-205.
[4] VENUPRASAD K. Cbl-b and itch: key regulators of peripheral T-cell tolerance[J]. Cancer Res, 2010, 70(8): 3009-3012.
[5] XU H S, WU Y W, XU S F, et al. Antitumor and immunomodulatory activity of polysaccharides from the roots of Actinidia eriantha[J]. J Ethnopharmacol, 2009, 125: 310-317.
[6] DISIS M L, BERNHARD H, JAFFEE E M. Use of tumourresponsive T cells as cancer treatment[J]. Lancet, 2009, 373 (9664): 673-683.
[7] Gooden M J, DE BOCK G H, LEFFERS N, et al. The prognostic influence of tumour-infiltrating lymphocytes in cancer: a systematic review with metaanalysis[J]. Br JCancer, 2011, 105(1): 93-103.
[8] NOSHO K, BABA Y, TANAKA N, et al. Tumour-infiltrating T-cell subsets, molecular changes in colorectal cancer, and prognosis: cohort study and literature review[J]. J Pathol, 2010, 222(4): 350-366.
[9] GABITASS R F, ANNELS N E, STOCKEN D D, et al. Elevated myeloid-derived suppressor cells in pancreatic, esophageal and gastric cancer are an independent prognostic factor and are associated with significant elevation of the Th2 cytokine interleukin-13[J]. Cancer Immunol Immunother, 2011, 60(10): 1419-1430.
[10] OHTSU A, SHAH M A, VAN CUTSEM E, et al. Bevacizumab in combination with chemotherapy as first-line therapy in advanced gastric cancer: a randomized, double-blind, placebo-controlled phase Ⅲ study[J]. J Clin Oncol, 2011, 29(30): 3968-3976.
[11] BAZAS V M, LUKYANOVA N Y, LISOVENKO G S, et al. Postoperative auto-vaccinotherapy for patients with gastric cancer and expression of some proteins in tumor tissue[J]. Exp Oncol, 2009, 31(3): 182-184.
[12] 范冬梅, 李崴, 杨铭, 等. 双功能抗体抗CD3/抗CD19介导T细胞对靶细胞的杀伤作用[J]. 中国癌症杂志, 2011, 21(1): 6-11.
[13] 高强, 邱双健, 樊嘉, 等. CD4+CD25+FOXP3+调节性T细胞在肿瘤免疫逃逸中的作用研究进展[J]. 中国癌症杂志, 2007, 17(8): 657-662.
[14] LIU Y C. Regulation of T cell differentiation and allergic responses by the E3 ubiquitinligase itch[J]. Ernst Sch erring Found Symp Proc, 2008, 1: 137-152.
[15] LOHR N J, Molleston J P, Strauss K A, et al. Human ITCH E3 ubiquitin ligase deficiency causes syndromic multisystem autoimmune disease[J]. Am J Hum Genet, 2010, 86: 447-453.
[16] MATESIC L E, COPELAND N G, JENKINS N A, et al. Itchy mice: the identification of a new pathway for the development of autoimmunity[J]. Curr Top Microbiol Immunol, 2008, 321: 185-200.
Silencing itch by small speci fi c interfering RNA enhance immune activity of mouse T lymphocyte to kill MFC stomach neoplasms cells in vitro
SU Ying, LAN Ya-ming, LU Yi-qiong, TIAN Guo-hong, HU
Lie-xian
(Emergency Department, the Affiliated MinDa Hospital of Hubei University for Nationalities, EnShi Hubei 445000, China)
SU-Ying E-mail: fl y100_inthesky@163.com
Background and purpose: Itch protein is an established regulator of T cell immune response thresholds, belong to a class of E3 ubiquitin-transferring enzymes, widely involve in the ubiquitination of several key signaling molecules, such as ZAP70, P85, VAV, PLC-γ, PKC-θ, etc, plays a critical role in tumor induced immunosuppression. Itch ligase activity regulate T-cell anergy and development of regulatory T cells in the periphery by modulating key components of T-cell receptor and transforming growth factor-β signaling. Therefore, manipulation of Itch activities may provide the opportunities to develop future therapies for immune disorders such as autoimmunity and cancer. speci fi c small interfering RNA(siRNA) was utilized to silence the expression of Itch gene of T-lymphocytes and investigate the cytotoxicity activity of transfected T lymphocytes against MFC stomach neoplasms cells in vitro. Methods: T lymphocytes were isolated from the spleen of 615 mice and transfected by speci fi c siRNA to silence the expression of Itch gene, The expression of Itch protein were examined by Western bolt in each group; 72 hours aftertransfection, The secretion level of IL-2, INF-γ were measured by enzyme-linked immunosorbent assay (ELISA). At the end, the cytotoxicity activity changes against MFC stomach neoplasms cells was compared between transfected T lymphocytes, negative control and blank control in vitro. Results: Compared with control group, the expression rate of Itch protein of transfected T-lymphocytes was decreased to 16% after transfection 48 hours; 72 hours after transfection, the secretion level of IL-2 in transfection group, negative control and blank control respectively were (1 891.96±141.91)pg/ mL, (1 241.69±91.67)pg/mL and (1 175.03±89.14)pg/mL (P<0.001), the secretion level of INF-γ in transfection group, negative control and blank control respectively were (958.33±75.46)pg/mL, (683.33±66.67)pg/mL and (691.72±68.72) pg/mL (P<0.05). Transfected T lymphocyte also showed more ef fi cient killing ability against MFC stomach neoplasms cells than negative control and blank control in vitro, the highest killing rate has reached (54.18±2.96)%. Conclusion: Silencing Itch gene can signi fi cantly promoted the secretion level of IL-2, INF-γ of mice T lymphocyte, enhanced the cytotoxicity activity of T lymphocyte against MFC stomach neoplasms cells in vitro.
Itch; Gene silencing; T-lymphocytes; Stomach neoplasms; Adoptive immunotherapy
10.3969/j.issn.1007-3969.2014.10.011
R73-36;R735.2
A
1007-3639(2014)10-0777-06
2014-07-11
2014-08-25)
粟英 E-mail: fl y100_inthesky@163.com

