NFAT蛋白各亚型在食管鳞癌组织中的表达与临床病理因素间的关系
赵宏 王琦 王昌华 赵守华
1.济宁医学院附属滕州市中心人民医院胸心外科,山东 滕州 277500;
2.山东省枣庄市薛城区周营镇中心卫生院外科,山东 枣庄 277000
NFAT蛋白各亚型在食管鳞癌组织中的表达与临床病理因素间的关系
赵宏1 王琦2 王昌华1 赵守华1
1.济宁医学院附属滕州市中心人民医院胸心外科,山东 滕州 277500;
2.山东省枣庄市薛城区周营镇中心卫生院外科,山东 枣庄 277000
背景与目的:研究发现,活化T细胞核因子(nuclear factor of activated T cells,NFAT)与多种恶性肿瘤关系密切,食管鳞癌是我国最常见的恶性肿瘤之一。本研究探讨食管鳞癌组织NFAT各亚型的表达及其与食管鳞癌各临床病理因素的关系。方法:采用免疫组化法检测104例食管鳞癌组织和癌旁食管黏膜组织中NFAT各亚型的表达情况。结果:NFAT1~4在食管鳞癌组织中阳性表达率分别为53.8%、10.6%、26.9%和45.2%,与在癌旁食管黏膜组织中的表达差异有统计学意义(P<0.001)。NFAT1的表达与饮酒史(62.3% vs 37.1%,P=0.01)、淋巴结转移(68.4% vs 5.5%,P=0.002)及较晚的分期(58.7% vs 36.2%,P=0.02)密切相关,多因素分析提示NFAT1过表达仅与淋巴结转移相关。淋巴结转移者的NFAT3表达率(39.4%)明显高于无淋巴结转移者(19.7%)。结论:NFAT蛋白在食管鳞癌组织中过表达,NFAT1与NFAT3的表达率与淋巴结转移密切相关,可能在肿瘤的发生、发展中起一定作用。
食管癌;活化T细胞核因子;转移
食管癌是我国最常见的恶性肿瘤之一,其中90%是食管鳞状细胞癌[1],尽管近年来其诊治水平有了很大进步,但食管癌患者的5年生存率仍然不高,因此发现具有诊断和治疗意义的分子靶点对于改善这一疾病的预后有着极为重要的作用。活化T细胞核因子(nuclear factor of activated Tcells,NFAT)最初作为在活化T细胞IL-2启动子上结合的转录因子而被发现[2],后来研究发现NFAT家族作为细胞内多信号转导通路的基础分子,在调节多种肿瘤细胞转化和生长、肿瘤血管生成、肿瘤转移等方面也发挥着重要的作用,与肿瘤形成和浸润转移密切相关[3]。目前鲜见NFAT与食管鳞癌关系的研究报道,本研究旨在观察NFAT蛋白各亚型在食管鳞癌组织中的表达情况。
1 材料和方法
1.1 临床资料
回顾性收集2007年1月—2007年12月间在我院接受手术治疗的原发性食管鳞癌患者104例,术前均未接受放化疗。所有患者均具有详细的临床病理资料。其中男性73例,女性31例;高分化8例,中分化77例,低分化19例;Ⅰ期和Ⅱ期58例,Ⅲ期46例(表1)。
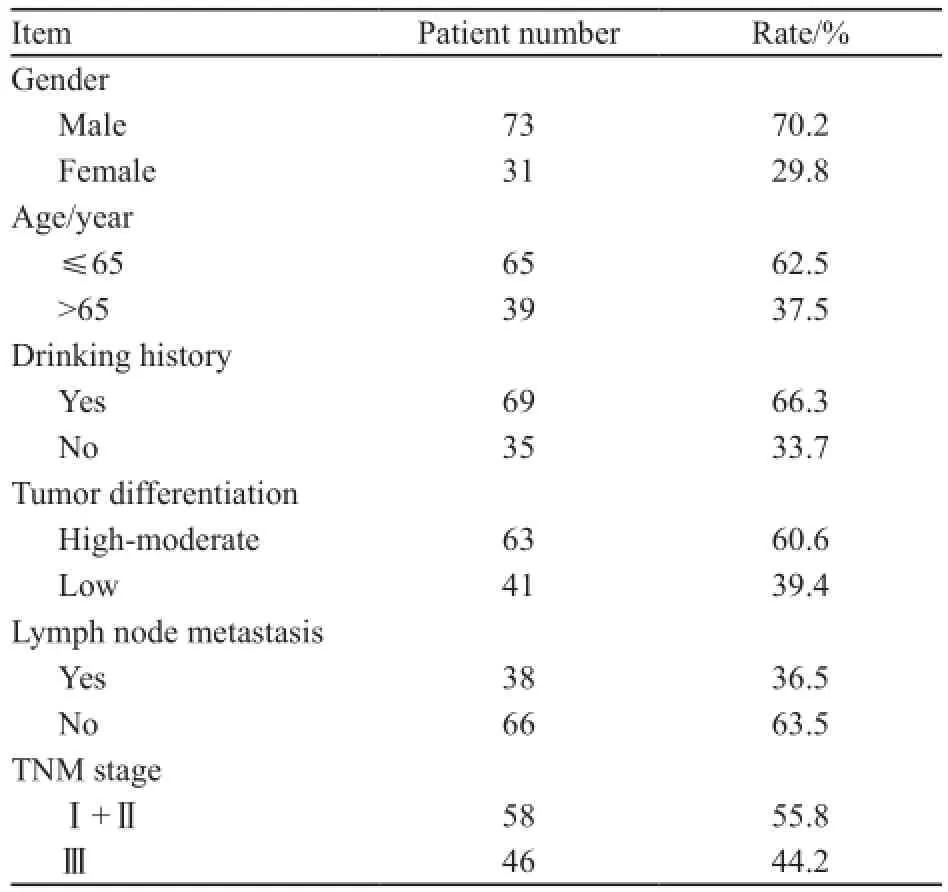
表1 临床病理资料Tab. 1 The clinical pathological data
1.2 试剂与方法
所有石蜡标本的HE染色切片均经病理医师阅片确诊,每例患者分别标记2个食管癌组织点以及2个距癌5 cm远的正常食管组织点,制备组织芯片。组织芯片上,每个组织点直径1 mm,每个患者包括4个点。连续切片厚度4 μm。兔抗人NFAT的抗体购自英国Abcam公司(编号依次为ab2722、ab25916、ab3447及ab83832,工作浓度分别为NFAT1 1∶100,NFAT2 1∶10,NFAT3 1∶50,NFAT4 1∶10)。PV9000及DAB显色液购自北京中杉金桥生物技术有限公司。切片经二甲苯脱蜡,梯度乙醇水化。微波炉中高火5 min、中低火15 min进行抗原热修复,3%双氧水、80%甲醇室温30 min消除内源性过氧化酶活性。一抗4 ℃温育过夜,PBS漂洗,PV9000室温温育,DAB显色,苏木素复染,1%盐酸、75%乙醇分化,1%氨水返蓝,过梯度乙醇脱水,封片。PBS代替一抗为阴性对照。
1.3 免疫组化结果判断
结果由济宁医学院附属滕州市中心人民医院2位病理医师分别独立读片。NFAT核、浆染色均计为阳性。免疫组化结果均根据细胞染色强度评分0、1、2、3和4;根据阳性细胞的百分数评分0(≤5%)、1(>5%~25%)、2(>25%~50%)、3(>51%~75%)、4(>75%~100%)。计算芯片上每个组织点染色强度和阳性细胞数评分的乘积;根据得分判断0为阴性,≤4分为弱阳性,>4分为强阳性。
1.4 统计学处理
采用SPSS 19.0软件进行统计分析。以χ2检验比较NFAT阳性组和阴性组之间的性别、年龄、饮酒史、肿瘤分化、淋巴结转移、病理分期的差异。对有差异的进行多因素Logistic回归分析,确定独立因素。所用统计检验均为双侧检验。P<0.05为差异具有统计学意义。
2 结 果
2.1 NFAT蛋白各亚型在食管癌组织中的表达
全组组织芯片染色成功率100%,无脱片。图1示NFAT蛋白染色阳性,定位于细胞质或核内。结果显示:肿瘤组织中NFAT1~4表达阳性率分别为53.8%(56/104),10.6%(11/104),26.9%(28/104),45.2%(47/104);正常组织NFAT1~4表达阳性率27.9%(29/104),1.9%(2/104),11.5%(12/104),20.2%(21/104,表2)。各亚型在食管鳞癌组织和癌旁食管组织中的表达均有显著差异(P<0.001)。
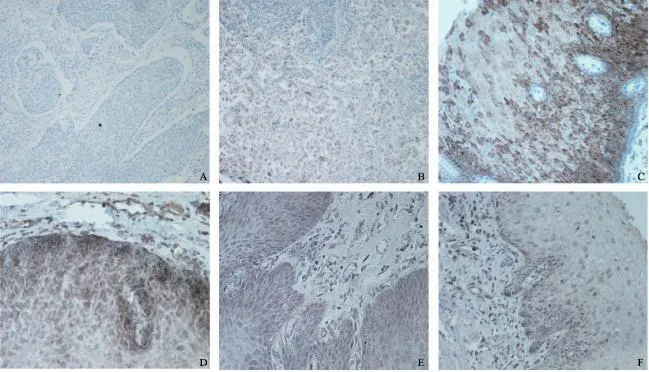
图1 NFAT蛋白在食管鳞癌组织中的表达(IHC 200×)Fig. 1 The expression of NFAT proteins in ESCC tissues (IHC 200×)
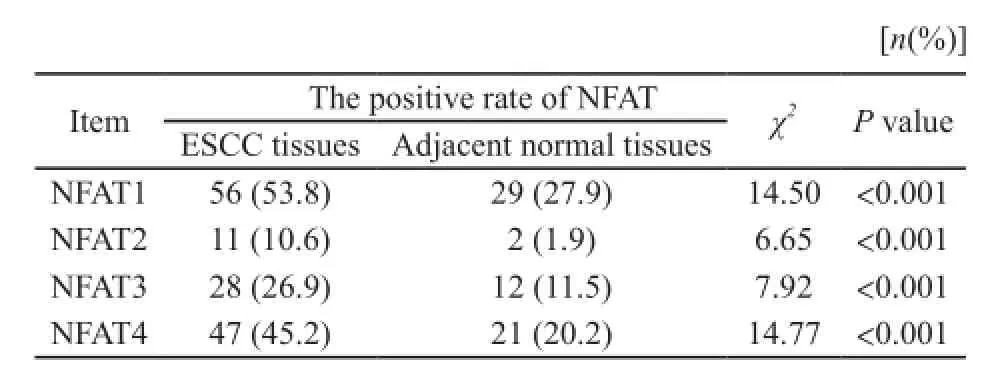
表2 NFAT蛋白在食管鳞癌组织和癌旁正常组织中的表达情况Tab. 2 The expression of NFATs in ESCC tissues and adjacent normal tissues
2.2 食管癌组织中NFAT蛋白表达与临床病理的关系
在104例食管鳞癌组织中,NFAT1蛋白表达率为53.8%(56/104),与患者的年龄、性别、肿瘤分化程度等临床病理因素无相关性,但在有饮酒史者表达高于无饮酒史者(62.3% vs 37.1 %,P=0.01),并且与淋巴结转移者(P=0.002)及分期(P=0.02)有相关性,而Logistic回归证实NFAT1过表达只与淋巴结转移密切相关(P=0.031)。NFAT2蛋白表达与患者的年龄、性别、饮酒史、肿瘤分化程度、淋巴结转移及临床分期等临床病理因素均未见相关性,但在Ⅰ、Ⅱ期患者中的NFAT2蛋白表达率(15.5%)高于Ⅲ期(4.3%),但差异无统计学意义(P=0.07) (表3)。NFAT3蛋白表达仅在淋巴结转移患者(39.4%)与非转移患者(19.7%)间差异有统计学意义(P=0.03),而与患者的年龄、性别、饮酒史、肿瘤分化程度及临床分期等临床病理因素均无相关性。NFAT4蛋白表达在食管鳞癌组织中的表达率较高,为45.2%,但在各临床病理因素间的表达未见明显差异(表4)。
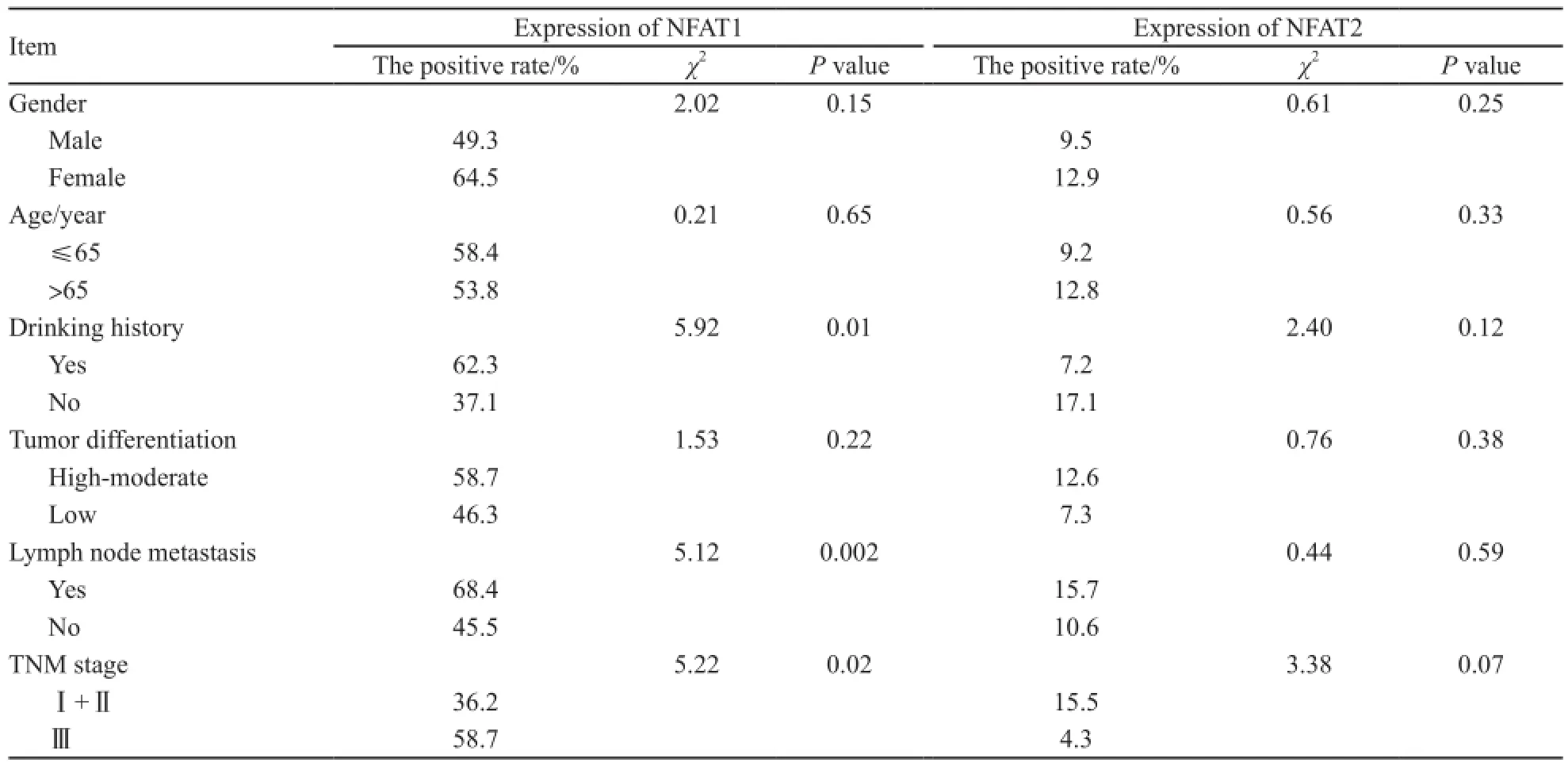
表3 NFAT1、NFAT2在食管鳞癌组织中的表达与临床病理因素之间的关系Tab. 3 Association between NFAT1 and NFAT2 expression and the clinicopathological features in ESCC

表4 NFAT3、NFAT4在食管鳞癌组织中的表达与临床病理因素之间的关系Tab. 4 Association between NFAT3 and NFAT4 expression and the clinicopathological features in ESCC
3 讨 论
转录因子NFAT蛋白最初是在淋巴细胞分化和分化中被发现的,目前发现NFAT家族有5个成员,分别是NFAT1(又称NFATp或NFATc2)、NFAT2 (又称NFATc或NFATc1)、NFAT3(又称NFATc4)、NFAT4(又称NFATx或NFATc3)和NFAT5(TonE-BP[4])。尽管被命名为NFAT,但它们不仅仅在T细胞中表达,在其他免疫细胞和非免疫细胞中也有表达。近年研究还发现NFAT蛋白在神经细胞和中枢神经组织[5]、内皮细胞、骨骼肌细胞、心肌细胞、软骨细胞、小肠细胞[6]、角化细胞和脂肪细胞等非免疫细胞和组织中也有不同程度的表达。NFAT以高度磷酸化无活性状态存在于细胞质中,通过刺激物激活磷脂酶Cγ,促使细胞内Ca2+水平升高,激活CaN及其他钙调素依赖的磷酸酶,使NFAT调节区的去磷酸化,原本被掩盖的核定位序列(nuclear localization sequences,NLS)暴露出来并被受体识别,在其作用下转运入核[7],并与NFAT靶基因上的位点结合并共同调节靶基因的转录表达。近年发现NFAT蛋白在细胞活化、分化及组织发育中有重要作用,可促进细胞恶性转化,在胰腺、乳腺和结肠等多种肿瘤细胞和组织中表达增高,被认为是促癌因素[8-9]。
研究表明,在恶性黑素瘤细胞中,NFAT1被BRAF-MEK-ERK通路活化后可直接激活COX-2[10]。在子宫内膜腺癌中,NFAT可介导前列腺素诱导的趋化因子CXCL8和细胞因子白介素11的表达[11]。以黑素瘤细胞接种NFAT1基因缺失的小鼠后发生肺内肿瘤的机会要比野生型少[12]。从以上研究表明,NFAT基因通过其下游因子COX-2、某些趋化因子及细胞因子等为肿瘤的生长提供微环境,从而促进肿瘤的发生、发展。本研究采用免疫组化的方法观察NFAT各亚型在食管鳞癌及癌旁正常食管组织中的表达情况。结果显示NFAT蛋白各亚型在食管鳞癌组织中的表达率均高于正常食管组织,这与既往其他肿瘤中的研究一致,表明NFAT蛋白在食管鳞癌中可能起一定作用。我们的研究还发现NFAT1与患者的饮酒史有关系,这可能说明NFAT1在肿瘤的发生阶段起一定作用,NFAT1、NFAT2和NFAT3在肿瘤中的表达与淋巴结转移关系密切,可能表明三者在肿瘤的发展过程中作用更大。
我们的研究还表明,各亚型在食管鳞癌组织中的表达情况不尽相同。NFAT1、NFAT4在食管鳞癌中的表达率较其他2种亚型为高,这表明各亚型在食管鳞癌的发生、发展中可能起不同的作用。目前研究认为NFAT2作为癌基因促进细胞转化,NFAT1在成纤维细胞、T淋巴细胞中诱导细胞周期阻滞促进细胞凋亡而起到抑癌基因的作用[13]。但有人在胰腺癌的研究中发现,NFAT1与WNT5A相互作用可以抑制细胞凋亡,使癌细胞出现化疗药耐受[14]。在SL3-3病毒诱导小鼠T淋巴瘤的研究中发现,与野生型小鼠相比,NFAT4基因缺失小鼠的淋巴瘤发生率明显增加,潜伏期明显缩短。该研究提示,NFAT4可能作为抑癌基因在起作用。在乳腺癌细胞中,NFAT1抑制依赖Stat5的基因表达,抑制肿瘤细胞的进展[15]。目前尚不清楚NFAT在什么情况下表现为抑癌基因。可能是不同的下游靶点决定了NFAT是促进生长还是分化,也可能是不同的细胞内外环境决定。
NFAT作为细胞信号转导中一种重要的中间因子,调节肿瘤细胞侵袭转移的过程,共同参与促进肿瘤新生血管的形成。我们的结果表明,NFAT在食管鳞癌的形成和进展中可能起到一定作用。进一步探讨NFAT在肿瘤中表达及其作用的靶基因有助于食管鳞癌生长行为特点的确定,NFAT有望成为食管鳞癌分子诊断中的1个重要的生物标志及其基因治疗中的潜在靶点。
[1] 罗君, 凌志强, 彭兵锋, 等. MicroRNA-31在食管鳞状细胞癌中的表达及其与预后的关系[J]. 中国癌症杂志, 2013, 23(7): 487-492.
[2] SHAW J P, UTZ P J, DURAND D B, et al. Identification of a putative regulator of early T cell activation genes[J]. Science, 1988, 241(4862): 202-205.
[3] FOLDYNOVÁ-TRANTÍRKOVÁ S, SEKYROVÁ P, TMEJOVÁ K, et al. Breast cancer-specific mutations in CK1 epsilon inhibit Wnt/beta-catenin and activate the Wnt/ Rac1/JNK and NFAT pathways to decrease cell adhesion and promote cell migration[J].Breast Cancer Res, 2010, 12(3): R30.
[4] OH-HORA M, RAO A. The calcium/NFAT pathway: Role in development and function of regulatory T cells[J]. Microbes Infect, 2009, 11(5):612-619.
[5] NERIA F, DEL CARMEN SERRANO-PEREZ M, VELASCO P, et al. NFATc3 promotes Ca2+-dependent MMP3 expression in astroglial cells[J]. Glia, 2013, 61(7):1052-1066.
[6] WANG Q, ZHOU Y, RYCHAHOU P, et al. NFAT5 represses canonical Wnt signaling via inhibition of β-catenin acetylation and participates in regulating intestinal cell differentiation[J]. Cell Death Dis, 2013, 13(4):e671.
[7] CAHALAN M D. Stimulating store-operated Ca(2+) entry[J]. Nat Cell Biol, 2009, 11(6):669-677.
[8] KÖENIG A, LINHART T, SCHLENGEMANN K, et al. NFAT-induced histone acetylation relay switch promotes c-Myc-dependent growth in pancreatic cancer cells[J].Gastroenterol, 2010, 138(3): 1189-1199.
[9] YIU G K, KAUNISTO A, CHIN Y, et al. NFAT promotes carcinoma invasive migration through glypican-6[J]. Biochem J, 2011, 440(1): 157-166.
[10] FLOCKHART R J, ARMSTRONG J L, REYNOLDS N J, et al. NFAT signalling is a novel target of oncogenic BRAF in metastatic melanoma[J]. Br J Cancer, 2009, 101(8): 1448-1455.
[11] SALES K J, GRANT V, COOK I H, et al. Interleukin-11 in endometrial adenocarcinoma is regulated by prostaglandin F2alpha-F-prostanoid receptor interaction via the calciumcalcineurin-nuclear factor of activated T cells pathway and negatively regulated by the regulator of calcineurin-1[J]. Am J Pathol, 2010, 176 (1): 435-445.
[12] WERNECK M B, VIEIRA-DE-ABREU A, CHAMMAS R, et al. NFAT1 transcription factor is central in the regulation of tissue microenvironment for tumor metastasis [J]. Cancer Immunol Immunother, 2011, 60(4): 537-546.
[13] ROBBS B K, LUCENA P I, VIOLA J P. The transcription factor NFAT1 induces apoptosis through cooperation with Ras/Raf/MEK/ERK pathway and upregulation of TNF-α expression [J]. Biochem Biophys Acta, 2013, 1833(8): 2016-2028.
[14] GRIESMANN H, RIPKA S, PRALLE M, et al. WNT5ANFAT signaling mediates resistance to apoptosis in pancreatic cancer [J]. Neoplasia, 2013, 15(1):11-22.
[15] ZHENG J, FANG F, ZENG X, et al. Negative cross talk between NFAT1 and Stat5 signaling in breast cancer[J]. Mol Endocrinol, 2011, 25(12): 2054-2064.
Expression and clinical significance of NFAT isoforms in squamous cell carcinoma of esophagus
ZHAO Hong1, WANG Qi2, WANG Chang-hua1, ZHAO Shou-hua1
(1.Department of Thoracic Surgery, The Central People’s Hospital of Tengzhou City, Jining Medical College, Tengzhou Shandong 277500, China; 2.Department of Surgery, The Central Hospital of Zhou-ying Town, Zaozhuang Shandong 277000, China)
ZHAO Shou-hua E-mail: zsh75@163.com
Background and purpose: It was reported that nuclear factor of activated T cells (NFAT) is closely related with carcinomas. Esophageal squamous cell carcinoma (ESCC) is one of the most common carcinomas in China. The present study investigated the expression and clinical significance of NFAT isoforms in ESCC. Methods: The expression of NFAT isoforms and the differences in different pathological levels of ESCC were detected in 104 specimens of human ESCC tissues and normal esophageal tissues by immunohistochemistry. Results: This study found that the positive rates of NFAT1 (53.8%), NFAT2 (10.6%), NFAT3 (26.9%), NFAT4 (45.2%) expression were significantly higher in tumor tissues than in adjacent normal esophageal tissues (P<0.001), respectively. The positive rate of NFAT1 expression was significantly higher in drinkers (62.3%) than nondrinkers (37.1%, P=0.01), and also higher in patients with lymph node metastasis (68.4% vs 5.5%, P=0.002) and with late stage (58.7% vs 36.2%, P=0.02). Multivariate analysis showed that NFAT1 expression was correlated with lymph node metastasis. The positive rate of NFAT3 was significantly higher in patients with lymph node metastasis (39.4%) than in those without lymph node metastasis (19.7%, P=0.03). Conclusion: These results suggest that the overexpression of NFAT1 and NFAT3 is associated with lymph node metastasis in ESCC.
Esophagueal neoplasm; Nuclear factor of activated T cells; Metastasis
10.3969/j.issn.1007-3969.2014.10.012
R735.1
A
1007-3639(2014)10-0783-06
2014-06-22
2014-08-26)
山东省自然科学基金资助项目(NO: ZR2010HL049)。
赵守华 E-mail:zsh75@163.com

