干细胞标志物SOX-2、β-catenin表达与胃癌术后复发转移关系
郑州大学附属肿瘤医院内科,河南 郑州,450000
干细胞标志物SOX-2、β-catenin表达与胃癌术后复发转移关系
张燕平 李宁 邓文英 韩黎丽 田沛琦 许勇飞 杨姣 申威 魏辰 罗素霞
郑州大学附属肿瘤医院内科,河南 郑州,450000
背景与目的:胃癌术后复发转移严重影响患者生存情况,SOX基因是经典Wnt信号通路的调控因子,其在胃癌术后复发及转移过程中可能发挥重要作用。本研究旨在探讨胃癌术后复发、远处转移患者肿瘤组织中SOX-2、β-catenin表达情况,探讨两者在胃癌术后复发及转移的作用。方法:采用免疫组化方法检测71例经手术切除胃癌患者的肿瘤组织中SOX-2和β-catenin蛋白表达情况,并分析其与临床病理特征和无病生存时间(disease free survival,DFS)的关系。结果:SOX-2在胃癌中的表达与胃癌复发转移、淋巴结浸润及分化程度有关(P=0.011,P=0.036,P=0.034),与患者性别、年龄及T分期无关。β-catenin在胃癌中的表达与胃癌复发转移、淋巴结浸润及T分期有关(P=0.025,P=0.014,P=0.026),与分化程度、患者性别及年龄无关。且二者均呈阳性表达者其术后复发转移率高于任意单阳性者,复发转移率分别为84%(21/25)和66.7%(24/36),二者均阴性表达者其复发转移率为30%(3/10)。生存分析显示SOX-2和β-catenin的表达与患者DFS相关。结论:SOX-2、β-catenin表达可能是胃癌术后复发转移有效的预测因子,两者联合检测有利于预测胃癌患者术后复发转移。
胃癌;SOX-2;β-catenin;转移
胃癌是最常见的消化道恶性肿瘤之一,其发 病率和死亡率一直高居不下,虽然手术治疗可以达到根治目的,但术后的复发转移严重影响患者生存,随着近几年肿瘤干细胞理论的深入研究,越来越多学者认为,因肿瘤干细胞具有自我更新的能力,有可能是肿瘤复发转移的根源。
Wnt信号转导通路是近年被广泛关注的一条信号途径,其在不同肿瘤中被异常激活,表明其与肿瘤的发生、发展密切相关[1-2]。有研究表明β-catenin是一种多功能的细胞质蛋白,高表达时可使Wnt通路处于活化状态(Wnt+),同时导致细胞间黏附性下降,影响了细胞接触性生长抑制等信号的传导,从而参与细胞的恶性转化[3]。大量文献表明该通道在食管癌[4-5]、甲状腺癌[6]、结直肠癌[7-8]、胆囊癌[9]、非霍奇金淋巴瘤[10]等发生、发展及转移复发中起到了至关重要的促进作用,亦有研究[11]证实胃癌的发生也与该途径活化异常有关。但是,该蛋白表达同胃癌术后复发转移的具体机制尚不清楚。
SOX-2是一种干细胞转录因子,在胚胎干细胞全能性发育、器官形成及神经分化等方面起着重要的作用。人体内多种肿瘤的发生、发展与其异常表达相关,然而关于SOX-2在胃癌中的表达研究较少,本研究通过检测胃癌组织中SOX-2及β-catenin的表达情况,分析其与胃癌患者临床病理参数的关系,探讨其在胃癌术后复发及转移过程中可能发挥的作用,为胃癌干细胞研究提供一定的理论基础。
1 资料和方法
1.1 研究对象
研究对象来自2007年1月—2008年6月在河南省肿瘤医院手术切除胃癌标本71例,所有患者术前未行放化疗及生物治疗,术后组织病理切片经2位以上有经验的临床病理医师阅片并经病理诊断明确,患者的临床分期采用AJCC胃癌TNM分期,且所有的标本均经过病理科医师核对确认。71例患者,年龄28~78岁,平均62岁;其中男性54例,女性17例;≥60岁29例,<60岁42例;高、中分化腺癌27例,低分化腺癌44例;T1~T2期11例,T3~T4期60例;有淋巴结浸润46例,无淋巴结浸润25例;随访5年后复发转移48例,无转移23例。患者术后均按照FOLFOX4行辅助治疗,每3个月复查1次,若CT提示肝脏、肺部或局部淋巴结转移时行MRI、PET/CT或淋巴结穿刺活检,以CT发现转移时间为转移发生时间,记录每个患者无病生存时间(disease free suevival,DFS)。每3个月随访1次,中位随访时间为2.5年,失访率为3%。
1.2 方法
采用免疫组化SP方法,严格按照试剂盒说明书操作,检测SOX-2与β-catenin在肿瘤组织中的表达。一抗为福州迈新生物技术开发有限公司产品,由有经验的2位病理科医师独立双盲阅片,在10×40倍显微镜下观察记数,每张切片随机选择5个视野,每个视野计数100个细胞,根据阳性细胞数所占癌细胞数目的百分比及染色程度判定,病理阅片有异议时必须再次阅片。
SOX-2抗原阳性反应主要表现为细胞核内存在棕黄色颗粒,阳性表达程度判断根据电子显微镜下染色强度及阳性细胞数占肿瘤细胞总数的百分比综合分析。按染色强度分析:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;按阳性细胞数占肿瘤细胞总数百分比分析:<总数的5%为0分,5%~25%为1分,26%~50%为2分,>50%为3分,将染色强度得分与阳性细胞数得分相乘,0~1分为阴性表达,≥2分为阳性表达。
β-catenin在细胞膜、细胞质及细胞核中均有阳性表达。因此,其阳性结果的判定,从细胞膜、细胞质、细胞核3个方面进行结果判断,>70%细胞膜阳性表达为正常表达,反之为减弱表达;>10%细胞质或细胞核阳性表达为异位表达;细胞膜减弱表达,细胞质、细胞核异位表达均为阳性表达[12]。
1.3 统计学处理
采用SPSS 16.0统计软件包进行数据整理和统计分析。比较SOX-2、β-catenin与转移关系时采用χ2检验;比较表达情况对远处转移出现时间影响时采用Kaplan-Meier生存分析法。P<0.05为差异有统计学意义。
2 结 果
2.1 可评价患者临床特征
所有患者,均可评价肿瘤组织SOX2、β-catenin染色。随访率为97%,中位随访时间为2.5年。以复发转移是否发生将患者分为复发转移组和非复发转移组。共有48例患者确诊复发转移,其中21例为局部复发,27例为远处转移。
2.2 β-catenin表达与临床病理特征的关系
在转移组中共有28例患者β-catenin呈阳性表达,阳性表达率为58.3%(28/48)。而非转移组中共有7例患者阳性表达,阳性表达率为30.4%(7/23),两组差异有统计学意义(P=0.025)。淋巴结浸润患者中β-catenin阳性表达率为58.7%(27/46),非淋巴浸润患者β-catenin的阳性表达率为32.0%(8/25),差异有统计学意义(P<0.05)。T1~T2患者中其阳性表达率为18.2%(2/11),T3~T4患者中阳性表达率为55.0%(33/60),差异有统计学意义(P=0.026)。β-catenin表达与肿瘤分化程度、性别及年龄差异无统计学意义(表1)。β-catenin阳性患者中位DFS为12个月,阴性者为24个月,生存分析显示阳性表达者DFS明显短于阴性表达者,差异有统计学意义(P=0.009,图1)。
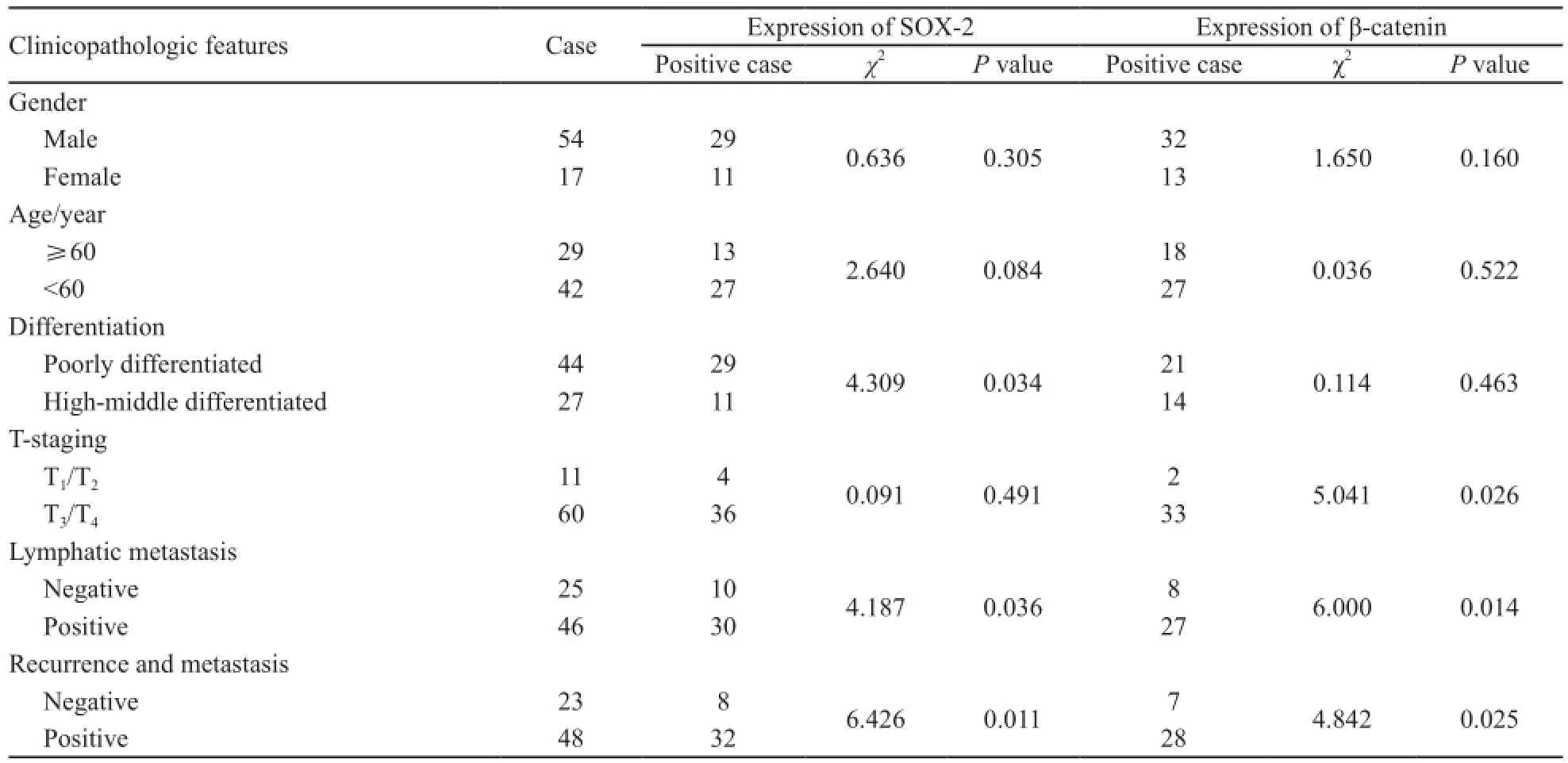
表1 SOX-2表达与胃癌临床病理特征的关系Tab. 1 Relationship between the expression of SOX-2 and clinicopathologic features of gastric cancer
图1 干细胞标志物SOX-2、β-catenin在胃癌组织中的表达Fig. 1 The expression of SOX-2 and β -catenin in gastric cancer
2.3 SOX-2表达与临床病理特征的关系
在转移组中S O X-2阳性表达率为66.7%(32/48),而非转移组中阳性表达率为34.8%(8/23),两组差异有统计学意义(P=0.011)。淋巴结浸润患者中SOX-2阳性表达率为65.2%(30/46),而非淋巴结浸润患者中SOX-2阳性表达率为40.0%(10/25),差异有统计学意义(P=0.036)。同时,不同原发灶分化程度SOX-2表达不同,低分化组和高、中分化组阳性率分别为65.9%(29/44)和40.7%(11/27),差异有统计学意义(P=0.034),不同T分期及性别中SOX-2表达阳性率之间差异无统计学意义(表1)。SOX-2阳性患者的中位DFS为13个月,阴性者为19个月,Kaplan-Meier生存分析显示阳性表达者DFS较阴性者短,差异有统计学意义(P=0.005,图1)。
2.4 β-catenin及SOX-2表达与临床病理特征的关系
入组71例胃癌患者,β-catenin及SOX-2均为阳性表达的患者为25例,其中21例发生远处转移;任一指标为阳性表达者为36例,有远处转移为24例;10例均为阴性表达,其中3例远处转移。β-catenin及SOX-2均阳性表达者转移发生率明显高于均阴性表达者,对β-catenin、SOX-2两指标联合分析发现,两者均为阳性表达的患者转移发生时间最早,明显高于均为阴性患者。两项指标的高表达属于不良预后因素,提示肿瘤复发转移的风险较高。

表2 β-catenin及SOX-2表达与临床病理特征的关系Tab. 2 Relationship between the expression of β-catenin and SOX-2 and clinicopathologic features of gastric cancer
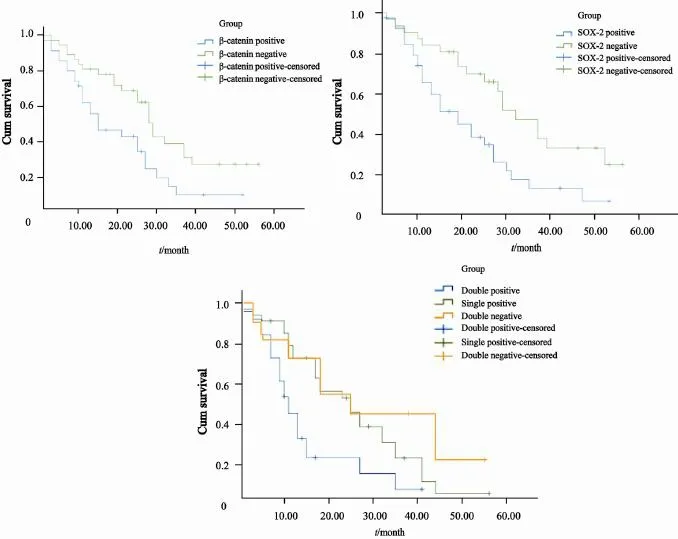
图2 胃癌中SOX-2、β-catenin表达与DFS的关系Fig. 2 Relationship between the expression of β-catenin and SOX-2 and DFS of gastric cancer
3 讨 论
Wnt/β-catenin信号通路参与了胚胎发育、细胞增殖、细胞分化等正常生理过程。SOX基因是经典Wnt信号通路的调控因子,人类SOX-2基因是SOX(SRY-related HMCH)基因家族的一员,在维持干细胞的多能性、增殖、保持不分化状态、细胞不均等分裂和决定细胞命运方面发挥重要作用,同时Wnt/β-catenin信号通路还能反作用于SOX基因[13]。SOX基因家族的共同特点是所编码的蛋白质中有一段含有79个氨基酸残基的序列,该序列具有DNA结合蛋白的特性,被命名为高迁移率族蛋白B1(high-mobility group box,HMG-box),它能够编码一些参与多种发育过程的调控,如决定性别、神经发育、多种血细胞生成等多种组织器官发育的转录因子。研究发现SOX-2参与了多种肿瘤的形成,如卵巢癌、肺癌、乳腺癌等[14-16]。SOX-2蛋白被认为是多能干细胞标志物,在诱导多潜能干细胞过程中起到关键作用。本研究发现SOX-2蛋白的阳性表达与胃癌分化程度(P=0.034)、复发转移(P=0.011)及淋巴结浸润和非淋巴结浸润有关(P=0.034),表明其阳性表达可提示肿瘤的侵袭性及远处转移率发生风险高。SOX-2阳性患者的中位DFS较阴性表达者短(13个月 vs 19个月),差异有统计学意义(P=0.005),提示SOX-2的高表达可能成为胃癌患者预后的不良因素。已阐明β-catenin和多种恶性肿瘤的发生、发展有着密不可分的关系,尤其与消化道肿瘤紧密相关[17]。既往分子生物学研究发现[18],Wnt/ β-catenin信号转导通路在细胞增殖、分化以及迁移等方面起着重要的调控作用。
本研究发现,β-catenin表达水平与T分期、淋巴结浸润有关,与患者性别、年龄及分化程度无关,表明随着胃黏膜癌细胞浸润加深及淋巴结转移增多,β-catenin的阳性表达率升高。在复发转移的患者中其阳性表达率明显高于无复发转移的患者,且阳性表达者复发转移发生时间早于阴性者,提示胃癌中β-catenin的阳性表达与肿瘤的复发转移相关,β-catenin有希望成为胃癌患者术后复发转移的预测指标。
本研究中,SOX-2、β-catenin阳性患者的中位DFS较阴性表达者短,差异有统计学意义(P=0.009,P=0.005),提示两者的高表达可能成为胃癌患者预后的不良因素。通过SOX-2、β-catenin联合分析发现,二者均阳性表达者术后复发转移率明显高于均阴性者(P=0.004),提示两者在胃癌术后复发中起到协同促进作用,而且综合预测作用较单因素分析更加客观,有研究表明,β-catenin与重编程因子KLF4、OCT4、SOX-2相互作用,进一步提高多能性基因表达,因而促进肿瘤进展[19]。
综上所述,β-catenin和SOX-2的表达与胃癌的浸润及复发转移有密切的关系。通过对两种因子的联合检测将更有助于预测胃癌患者的恶性程度,有可能为临床早期诊断和评估胃癌的侵袭、转移潜能以及指导治疗方案提供可靠的分子生物学指标。
[1] CHIEN A J, MOON R T. WNTs and WNT receptors therapeutic tools and targets in human disease process[J]. Front Biosci, 2007, 12: 448-457.
[2] POURREYRON C, REILLY L, PROBY C, et al. Wnt5a is strongly expressed at the leading edge in non-melanoma skin cancer, forming active gradients, while canonical Wnt signaling is repressed[J]. PloS One, 2012, 7(2): e31827.
[3] HERR P, HAUSMANN G, BASLER K. WNT secretion and signaling in human disease[J]. Trends Mol Med, 2012, 18(8): 483-490.
[4] 陈鑫, 车少敏, 易子寒, 等. Wnt/β-catenin信号通路激活诱导食管癌Eca-109细胞miRNA表达谱的研究[J]. 现代肿瘤医学, 2013, 21(1): 5-9.
[5] 汤小伟, 黄曙, 王敏, 等. Klotho与β-catenin在食管癌中的表达及临床意义[J]. 世界华人消化杂志, 2012, 20(34): 3305-3309.
[6] 刘畅, 陶晓峰, 高政南, 等. Moesin和E-cadherin与甲状腺乳头状癌侵袭的相关性[J]. 肿瘤防治研究, 2012, 39(1): 44-47.
[7] 李宁, 张力, 陈小兵, 等. 干细胞标志物Oct-4、SOX-2表达与结肠后复发转移的关系[J]. 中国肿瘤临床, 2012, 39(9): 574-577.
[8] 周逢强, 齐艳美, 李新军, 等. 上皮黏附分子与β-连环蛋白在结肠癌中的表达及临床意义[J]. 国际肿瘤学杂志, 2011, 38(11): 873-875.
[9] KIMURA Y, FURUHATA T, MUKAIYA M, et al. Frequent beta-catenin alteration in gallbladder carcinomas[J]. J Exp Clin Cancer Res, 2003, 22(2): 321-328.
[10] ZHANG X, HAN B, HUANG J, et al, Prognostic significance of Oct4 expression in adenocarcinoma of the lung[J]. Jpn J Clin Oncol, 2010, 40(10): 961-966.
[11] KANDA N, SENO H, KONDA Y, et al. STAT3 is constitutively activated and supports cell survival in association with survive expression in gastric cancer cells[J]. Oncogene, 2004, 23(28): 4921-4929.
[12] MARUYAMA K, OCHIAI A, AKIMOTO S, et al. Cytoplasmic beta-catenin accumulation as a predictor of hematogenous metastasis in human colorectal cancer[J]. Oncology, 2000, 59: 302-309.
[13] KORMISH J D, SINNER D, ZORN A M. Interactions between SOX factors and Wnt/beta-catenin signaling in development and disease[J]. Dev Dyn, 2010, 239(1): 56-68.
[14] YE F, LI Y, HU Y, et al. Expression of Sox2 in human ovarian epithelial carcinoma[J]. Cancer Res Clin, 2011, l37: 131-137.
[15] SHOLL L M, BARLETTA J A, YEAP B Y, et al. Sox2 protein expression is an independent poor prognostic indicator in stageⅠ lung adenocarcinoma[J]. Am J Surg Pathol, 20l0, 34(1): 193-198.
[16] LENGERKE C, FEHM T KURTH R, et al. Expression of the embryonic stem cell marker SOX2 in early-stage breast carcinoma[J]. BMC Cancer, 2011, 11: 42.
[17] HUANG J, LI J, QU Y, et al. The expression of claudin 1 correlates with β-catenin and is a prognostic factor of poor outcome in gastric cancer[J]. Int J Oncol, 2014, 44(4): 1293-1301.
[18] TAN C W, GARDINER B S, HIROKAWA Y, et al. Analysis of Wnt signaling β-catenin spatial dynamics in HEK293T cells[J]. BMC Syst Biol, 2014, 8(1): 44.
[19] ZHANG P, CHANG WBH, FONG B, et al. Regulation of induced pluripotent stem (iPS) cell induction by Wnt/ β-catenin signaling[J] J Biol Chem, 2014, 289(13): 9221-9232.
The expression of SOX-2 and β-catenin in gastric cancer and the relationship with recurrence and metastasis after operation
ZHANG Yan-ping, LI Ning, DENG Wen-ying, HAN Li-li, TIAN Pei-qi, XU
Yong-fei, YANG Jiao, SHEN Wei, WEI Chen, LUO Su-xia
(Department of Internal Medicine, Tumor Hospital Af fi liated to Zhengzhou University, Zhengzhou Henan 450000, China)
LUO Su-xia E-mail: ziqian1989@163.com
Background and purpose: The recurrence and metastasis of gastric cancer seriously affect survival in patients. SOX gene as a regulatory factor of the classical Wnt pathway, may play an important role in the process. This study was to explore the expression of stem cell marker SOX-2 and β-catenin in gastric cancer and to analyze the relationship with recurrence and metastasis after operation. Methods: Immunohistochemistry was used to detect the expression of SOX-2 and β-catenin in 71 tumor samples from 71 cases after surgery for gastric cancer. The correlation between SOX-2 and β-catenin expression and the clinicopathological characteristics of gastric cancer and disease-free survival was analyzed. Results: The SOX-2 protein expression was associated with metastasis, lymph node in fi ltration or differentiation (P=0.011, P=0.036, P=0.034) in the 71 gastric cancer, but not with gender, age or T stage. β-catenin expression was correlated with metastasis, lymph node invasion or T stage (P=0.025, P=0.014, P=0.026), but was not related to differentiation, gender or age. The survival analysis showed that SOX-2 and β-catenin expression was closely associated with prognosis of patients, and metastatic rate in positive expression was higher than that in negative expression. Conclusion: The expression of SOX-2 and β-catenin is associated with the development, recurrence, metastasis of gastric cancer and may be used as a useful prognostic parameter to predict overall survival.
Gastric cancer; SOX-2; β-catenin; Metastasis
10.3969/j.issn.1007-3969.2014.09.008
R735.2
A
1007-3639(2014)09-0684-06
2014-04-23
2014-07-06)
河南省卫生厅项目(No:2011020171)。
罗素霞 E-mail:ziqian1989@163.com

