辛伐他汀对肝癌细胞间缝隙连接功能的影响研究
汪灵芝彭建新余美玲黄焕森
1.广州医科大学附属第二医院麻醉科,广东 广州 510260;
2.广东省中医院肝胆外科,广东 广州 510120;
3.安徽省蚌埠医学院附属第一医院药剂科,安徽 蚌埠 233004
辛伐他汀对肝癌细胞间缝隙连接功能的影响研究
汪灵芝1彭建新2余美玲3黄焕森1
1.广州医科大学附属第二医院麻醉科,广东 广州 510260;
2.广东省中医院肝胆外科,广东 广州 510120;
3.安徽省蚌埠医学院附属第一医院药剂科,安徽 蚌埠 233004
背景与目的:肝癌的发生、发展过程中伴随着细胞间缝隙连接(gap junction,GJ)功能的下降,恢复或增强肿瘤细胞间的GJ可以抑制肿瘤细胞的恶性转化和生长增殖。本研究拟通过观察辛伐他汀对肝癌细胞间GJ功能的影响,寻找能够增强GJ功能的药物,从而为肝癌的治疗提供新策略和新手段。方法:采用磺酰罗丹明B法观察辛伐他汀对大鼠肝癌细胞Hep3b的抑制作用;细胞接种荧光法和划痕标记/染料示踪技术观察辛伐他汀对GJ功能的影响。结果:1、5和10 μmol/L辛伐他汀在24 h作用时间内均对细胞生长无抑制作用,将不影响GJ的数量;取5、10 μmol/L辛伐他汀作用细胞4 h后,与对照组相比,GJ的荧光传递功能明显增强;与对照组相比,5、10 μmol/L辛伐他汀作用细胞4 h后,荧光黄染料(lucifer yellow,Ly,Sigma)传输范围随着辛伐他汀浓度的升高逐渐增大。结论:辛伐他汀可以增强肝癌细胞GJ功能。
辛伐他汀;缝隙连接;肝癌
原发性肝癌是严重威胁人类健康的常见恶性肿瘤之一,其死亡率在消化系统肿瘤中居第3位。90%以上的原发性肝癌是肝细胞癌(hepatocellular carcinoma,HCC),全世界每年发病人数为25万,仅中国就有11万(44.7%),且呈逐年上升趋势。因此,攻克HCC已成为亟待解决的重大课题。他汀类药物广泛应用于临床治疗高胆固醇血症,近年来的研究表明,他汀类药物除了有降血脂的作用,还能够抑制肿瘤细胞的增殖,诱导其分化和凋亡[1]。细胞学的研究发现,包括辛伐他汀在内的多种他汀类药物能够抑制人肝癌细胞的生长,诱导细胞凋亡[2-3]。
细胞缝隙连接(gap junction,GJ)是细胞之间的一种蛋白质连接通道,由连接蛋白组成,广泛存在于实质性脏器(如心脏、肝脏、肾脏、中枢神经、皮肤和肌肉等)组织中,依据不同的相对分子质量而命名[4]。多数肿瘤细胞在发生、生长过程中,伴有GJ的下降或缺失;而恢复或增强肿瘤细胞间的GJ可以抑制肿瘤细胞的恶性转化和生长增殖,有利于重建细胞正常的生长调控机制,还能够增强肿瘤细胞对放化疗的敏感性[5-6]。人体正常肝脏组织主要表达连接蛋白32和连接蛋白26。研究发现,肝癌的发生、发展过程中伴随着细胞间由连接蛋白组成的GJ功能的下降,而通过药物或者其他方法上调GJ功能能够逆转肿瘤的恶性转化[7]。我们的前期研究发现,辛伐他汀能够增加睾丸癌细胞上连接蛋白43组成的GJ功能[8],但辛伐他汀对由其他连接蛋白组成的GJ功能的影响仍未知。因此,本研究拟观察辛伐他汀对肝癌细胞Hep3b上GJ功能的影响,为寻找增强GJ功能的药物和治疗肝癌的新手段提供重要的实验依据。
1 材料和方法
1.1 实验细胞和试剂
肝癌细胞Hep3b由中山大学附属第一医院外科实验室提供;胎牛血清、青链霉素、胰酶和MEM干粉等细胞培养试剂购自Gibco公司;辛伐他汀购自Sigma-Aldrich公司。
1.2 实验方法
1.2.1 人肝癌细胞Hep3b的培养
人肝癌细胞Hep3b培养于含10%胎牛血清和青链霉素的MEM培养液中,置于37 ℃、CO2体积分数为5%及饱和湿度的细胞培养箱中培养。细胞常规培养于培养瓶中,并通过0.25%胰蛋白酶消化法进行传代。实验前将细胞培养24~48 h,使其表达形成有效的GJ。
1.2.2 磺酰罗丹明B法测定辛伐他汀的细胞毒性
磺酰罗丹明B是一种粉红色的氨基甲氧杂蒽类化合物,在酸性环境下能与三氯醋酸固定后的细胞内大分子上的碱性氨基酸结合,结合的染料的量在一定范围内线性地反映了蛋白质的量,而蛋白质的量是与细胞的数目呈正比的[9]。本实验取不同浓度(5和10 µmol/L)的辛伐他汀作用Hep3b细胞不同时间(24、48、72、96和120 h)后,每孔加入50 µL冰冷的50%三氯醋酸(终浓度为10%)于4 ℃固定。倒掉固定液,用超纯水冲洗、干燥后,每孔加入0.4%磺酰罗丹明B,室温染色30 min,用1%醋酸洗去游离染料,空气干燥后,每孔精确加入150 µL的Tris (10 mmol/L)溶解染料,用酶标仪在564 nm波长处测定吸光度(A)值,以只加培养液的空白对照组调零。
1.2.3 细胞接种荧光示踪法[10]检测肝癌细胞Hep3b的GJ荧光传递功能
取对数生长期细胞,以1.0×105个/mL接种于6 孔板。随机分为对照组、1 μmol/L辛伐他汀处理组、5 μmol/L辛伐他汀处理组和10 μmol/L辛伐他汀处理组。将表达有连接蛋白的细胞与荧光指示剂calcine-AM和DiI-CM共同温育,使calcine-AM和DiI-CM进入细胞,该细胞称为“供体细胞”。将“供体细胞”接种到接受过不同处理并已生长融合的肝癌细胞Hep3b(“接受细胞”)上,培养4 h。待形成稳定的GJ后,用显微荧光系统观察,记录GJ功能。小分子的calcine(发绿色荧光)可以通过GJ进入相邻的“接受细胞”;但大分子的DiI不能自由通过GJ而留在“供体细胞”内,使之易于识别。计数一个“供体细胞”周围含有calcine的“接受细胞”作为GJ功能指标。
1.2.4 划痕标记/染料示踪技术[6]检测细胞GJ功能的变化
肝癌细胞Hep3b以1×105个/mL的浓度接种在直径为35 mm的培养皿上,每个培养皿含2 mL。待培养细胞融合到80%~90%时,将细胞分为对照组、5 μmol/L辛伐他汀处理组和10 μmol/ L辛伐他汀处理组。4 h后PBS冲洗培养皿3次,以除去细胞表面的杂质,然后加入1 mL的荧光黄染料(lucifer yellow,Ly,Sigma,0.5 mg/mL),用手术刀在培养皿表面作3道划痕。室温下静置3 min后,吸除染料,再用PBS将游离的剩余荧光染料冲洗干净。滴加少许PBS,以免在观察过程中细胞变形、死亡。荧光倒置显微镜下观察染料在划痕垂直方向上的迁移距离。每组实验重复3次。
1.3 统计学处理
实验结果使用SPSS 13.0软件进行分析。两组之间计量资料比较采用t检验,组间比较采用LSD法,P<0.05为差异有统计学意义,统计图表采用Sigma Plot 10.0绘制。
2 结 果
2.1 辛伐他汀对肝癌细胞Hep3b的抑制作用
为了排除辛伐他汀的细胞毒性对GJ功能的影响,我们首先用SRB法检测不同浓度辛伐他汀对肝癌细胞Hep3b生长的影响,选择对细胞生长无明显毒性作用的辛伐他汀浓度进行后续实验。结果显示,1、5和10 μmol/L辛伐他汀在24 h时间内均对细胞生长无抑制作用;而5和10 μmol/L组在24 h后对细胞生长有明显抑制作用(P<0.05),1 μmol/L辛伐他汀在96 h后也对细胞生长有影响(表1)。
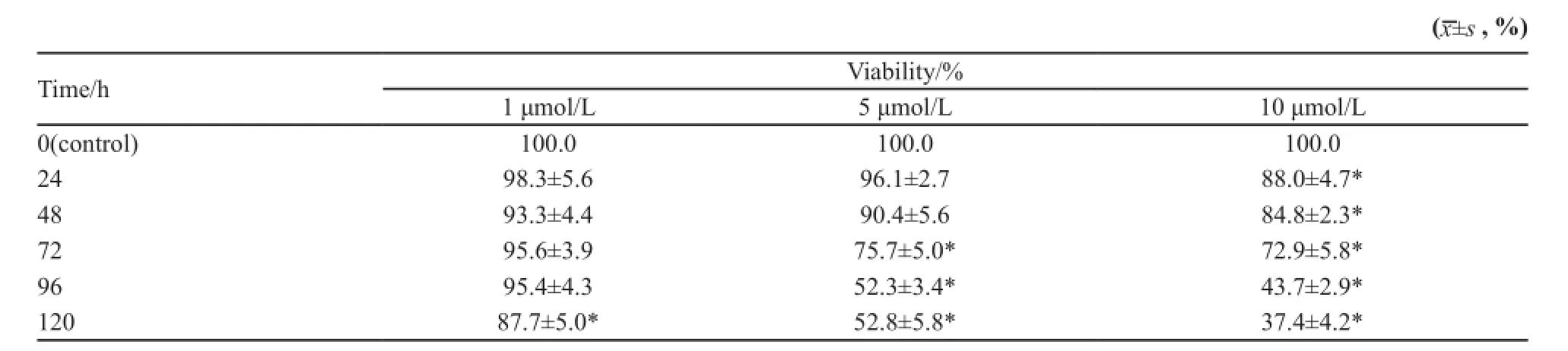
表1 辛伐他汀处理后肝癌细胞Hep3b的生存率Tab. 1 The viability of Hep3b cells treated with simvastatin
2.2 辛伐他汀增强肝癌hep3b细胞GJ功能
细胞接种荧光实验结果显示,与对照组相比,2.5、5和10 μmol/L辛伐他汀作用细胞4 h后肝癌Hep3b“供体细胞”周围的荧光“接受细胞”数明显增多,荧光传递分别增强了21%±2%、25%±3%和60%±4%。证明辛伐他汀可以增强由连接蛋白43所组成的GJ荧光传递功能(图1)。
荧光划痕实验结果显示,对照组肝癌细胞Hep3b的Ly染料局限于划痕两侧,无明显的荧光染料传输现象,而细胞经5和10 μmol/L辛伐他汀处理4 h后,肝癌细胞Hep3b的GJ功能有不同程度的增强,且随辛伐他汀浓度的增高,Ly染料传输范围也逐渐增大,这表明辛伐他汀有增强肝癌细胞Hep3b GJ功能的作用,并呈一定的剂量依赖关系(图2)。
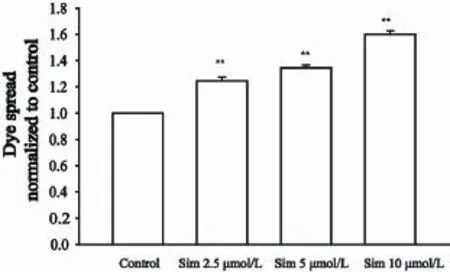
图1 不同浓度辛伐他汀对肝癌细胞Hep3b荧光传递功能的影响Fig. 1 The effect of simvastatin at concentrations on the dye spread of Hep3b cells through gap junctions assessed by parachute assay

图2 辛伐他汀对肝癌细胞Hep3b荧光传递功能的影响Fig. 2 The effect of simvastatin at concentrations on the dye spread of Hep3b cells through gap junctions assessed by scrape loading/dye transfer assay
3 讨 论
大量的研究证实,与正常细胞相比,相应的肿瘤组织伴随着GJ功能的降低或消失;而恢复和上调肿瘤细胞的GJ功能可以抑制肿瘤细胞的生长和增殖,诱导细胞凋亡[7,11]。连接蛋白基因被公认为是一种抑癌基因,而提高肿瘤细胞间GJ功能被认为是肿瘤治疗研究的新方向。肝癌的发生、发展伴随着缝隙连接蛋白和连接蛋白32、连接蛋白43及组成的GJ功能的异常。研究发现,与正常细胞相比,人肝癌细胞HuH7上连接蛋白43的表达增多引起连接蛋白32在细胞质内的聚集,最终导致肝癌细胞HuH7上连接蛋白32所组成的GJ功能的降低[12]。研究还发现,全反式维甲酸RA能够增强肝癌细胞HepG2的GJ功能[13]。这些研究都表明GJ在肝癌的发生、发展过程中扮演重要的角色。采用药物或者分子生物学方法改变GJ功能将为肝癌的治疗提供新的思路。
本研究中划痕标记/染料示踪技术结果显示,对照组中肝癌细胞Hep3b间无明显的荧光染料传输现象,证明肝癌细胞Hep3b间GJ功能本身较弱,而应用辛伐他汀4 h后荧光染料传输现象明显增强。辛伐他汀对肝癌细胞Hep3b的GJ的增强作用同样也被细胞荧光接种实验所证实,经过10 μmol/L辛伐他汀处理后的细胞间荧光传递功能增强达60%。大量的临床资料显示,他汀类药物确实能够降低肝癌的发生和死亡率,机制尚不清楚。本研究结果证明了辛伐他汀能够增强肝癌细胞间的GJ功能,将为他汀类药物的抗癌机制研究提供一定的理论依据。
GJ通道的开启及关闭受多种因素直接调控,如膜电位、pH值、Ca2+、连接蛋白的磷酸化、神经体液因子、蛋白质调节因子以及外源性化学物质等[4]。组成GJ的连接蛋白在细胞膜上的定位决定了其必定受到细胞膜物理特性的影响。像其他细胞膜上的蛋白通道一样,GJ的结构和功能受细胞膜上的脂质(主要是磷脂和胆固醇)环境的影响。对细胞膜上分离出的GJ进行分析,相比磷脂所占组分,其所含的胆固醇比例更高。研究表明,胆固醇不仅可以直接与蛋白质结合,而且可以通过改变整个脂质双分子层的物理特性影响细胞膜上离子通道的结构和功能[14]。Locke等[15]发现胆固醇和磷脂可以在体外改变由连接蛋白26或连接蛋白32组成的通道活性,外源性的补充胆固醇可以增加肝细胞GJ的组装和通透性。Meyer等[16]的研究结果与其相仿。这些都表明,胆固醇可以参与调控GJ的结构和功能。他汀类药物是羟甲基戊二酸单酰(3-hydroxy-3-methylglutaryl-coenzyme A,HMG CoA)还原酶抑制剂药物的总称,这类药物通过抑制HMG CoA还原酶的活性,阻断胆固醇合成的甲羟戊酸途径。辛伐他汀增强GJ功能是否与其对细胞内胆固醇的合成的影响有直接或者间接联系还有待进一步研究。另外,辛伐他汀还可以通过抑制细胞内甲羟戊酸途径,影响下游一系列信号转导关键分子,如Ras、Rho、Rab和Rac等,进而影响连接蛋白的合成与分布[17]。我们的前期研究还报道了辛伐他汀通过PKC磷酸化通路影响连接蛋白43的磷酸化,增强连接蛋白43组成的GJ功能[8]。因此,辛伐他汀究竟通过何种机制影响肝癌细胞的GJ功能还有待进一步研究加以阐明。
[1] GOMES M A, PRIOLLI D G, TRALHAO J G, et al. Hepatocellular carcinoma: epidemiology, biology, diagnosis, and therapies[J]. Rev Assoc Med Bras, 2013, 59(5): 514-524.
[2] KAH J, WUSTENBERG A, KELLER A D, et al. Selective induction of apoptosis by HMG-CoA reductase inhibitors in hepatoma cells and dependence on p53 expression[J]. Oncol Rep, 2012, 28(3): 1077-1083.
[3] LONARDO A, LORIA P. Potential for statins in the chemoprevention and management of hepatocellular carcinoma[J]. J Gastroenterol Hepatol, 2012, 27(11): 1654-1664.
[4] SAEZ J C, BERTHOUD V M, BRANES M C, et al. Plasma membrane channels formed by connexins: their regulation and functions[J]. Physiol Rev, 2003, 83(4): 1359-1400.
[5] HE B, TONG X, WANG L, et al. Tramadol and flurbiprofen depress the cytotoxicity of cisplatin via their effects on gap junctions[J]. Clin Cancer Res, 2009, 15(18): 5803-5810.
[6] 范高福, 童旭辉, 陶亮. 缝隙连接: 一个潜在的肿瘤治疗新靶点[J]. 蚌埠医学院学报, 2012, 37(2): 234-237.
[7] TROSKO J E, CHANG C C. Mechanism of up-regulated gap junctional intercellular communication during chemoprevention and chemotherapy of cancer[J]. Mutat Res, 2001, 480-481: 219-229.
[8] WANG L, FU Y, PENG J, et al. Simvastatin-induced upregulation of gap junctions composed of connexin 43 sensitize Leydig tumor cells to etoposide: An involvement of PKC pathway[J]. Toxicology, 2013, 312: 149-157.
[9] SKEHAN P, STORENG R, SCUDIERO D, et al. New colorimetric cytotoxicity assay for anticancer-drug screening[J]. J Natl Cancer Inst, 1990, 82(13): 1107-1112.
[10] KOREEN I V, ELSAYED W A, LIU Y J, et al. Tetracyclineregulated expression enables purification and functional analysis of recombinant connexin channels from mammalian cells[J]. Biochem J, 2004, 383(Pt 1): 111-119.
[11] TROSKO J E, RUCH R J. Gap junctions as targets for cancer chemoprevention and chemotherapy[J]. Curr Drug Targets, 2002, 3(6): 465-482.
[12] KAWASAKI Y, OMORI Y, LI Q, et al. Cytoplasmic accumulation of connexin32 expands cancer stem cell population in human HuH7 hepatoma cells by enhancing its self-renewal[J]. Int J Cancer, 2011, 128(1): 51-62.
[13] ARA C, MASSIMI M, DEVIRGILIIS CONTI L. Retinoic acid modulates gap junctional intercellular communication in hepatocytes and hepatoma cells[J]. Cell Mol Life Sci, 2002, 59(10): 1758-1765.
[14] CASCIO M. Connexins and their environment: effects of lipids composition on ion channels[J]. Biochim Biophys Acta, 2005, 1711(2): 142-153.
[15] LOCKE D, HARRIS A L. Connexin channels and phospholipids: association and modulation[J]. BMC Biol, 2009, 7: 52.
[16] MEYER R, MALEWICZ B, BAUMANN W J, et al. Increased gap junction assembly between cultured cells upon cholesterol supplementation[J]. J Cell Sci, 1990, 96(Pt 2): 231-238.
[17] PENG H, LUO P, LI Y, et al. Simvastatin alleviates hyperpermeability of glomerular endothelial cells in earlystage diabetic nephropathy by inhibition of RhoA/ROCK1[J]. PLoS One, 2013, 8(11): e80009.
The effect of simvastatin on the gap junction function of hepatocellular carcinoma cells
WANG Ling-zhi1, PENG Jian-xin2, YU Mei-ling3, HUANG Huan-sen1
(1.Department of Anesthesia, the Second Af fi liated Hospital, Guangzhou Medical University, Guangzhou Guangdong 510260, China; 2.Department of Hepatobiliary Surgery, Guangdong Province Traditional Chinese Medical Hospital, Guangzhou Guangdong 510120, China; 3.Department of Pharmacy, the First Affiliated Hospital of Bengbu Medical College, Bengbu Anhui 233004, China)
HUANG Huan-sen E-mail: huanghs1966@163.com
Background and purpose: It has been reported that gap junctional (GJ) function was signi fi cantly decreased in hepatocellular carcinoma (HCC) tissues and cell lines. However, the increased GJ suppress tumorigenesis and the development of liver cancer. This study therefore aimed to examine the effect of simvastatin on GJ function between Hep3b cells. Thus, the exploition of drugs to increase GJ function between liver cancer cells will provide an ef fi cient approach to fi ght against liver tumor as well as increase cytotoxicity of antitumor agents. Methods: SRB was used to assay the toxicity of simvastatin. The effect of simvastatin on GJ function was determined by “Parachute”dye-coupling assay and scrape loading/dye transfer assay. Results: Pretreated Hep3b cells with simvastatin at the concentration of 1, 5 or 10 μmol/L for 24 h did not induce the cytotoxicity. So simvastatin at the concentration of 5 and 10 μmol/L would not reduce the amount of GJ on cell membranes. “Parachute” dye-coupling assay showed that the treatment with 5 and 10 μmol/L simvastatin for 4 h enhanced the dye spread through GJ in Hep3b cells. Similarly, scrape loading/dye transfer assay showed that simvastatin could induce the increasing spread of lucifer yellow (Ly, Sigma) around the sco fi ng cells with increasing concentrations. Conclusion: Simvastatin could increase the GJ function of Hep3b cells.
Simvastatin; Gap junction; Hepatoma carcinoma
10.3969/j.issn.1007-3969.2014.09.001
R735.7
A
1007-3639(2014)09-0641-05
2014-03-22
2014-04-22)
广州市博士启动项目(No:2011c49);广州市医药卫生科技项目(No:20141A011083)。
黄焕森 E-mail:huanghs1966@163.com

