魔芋葡甘聚糖/普鲁兰多糖体系流变性能研究
寇丹丹 汪秀妹 魏雪琴 李雪晖 林启训 庞 杰
(福建农林大学食品科学学院1,福州 350002)
(华南理工大学生物科学与工程学院2,广州 510006)
多糖在自然界分布很广,主要包括植物多糖、动物多糖、微生物多糖及海洋生物多糖[1-3]。魔芋葡甘聚糖(Konjac Glucomannan,简称KGM)是一种高分子量的非离子型植物多糖[4],其相对分子质量分布在20~200万[5]。KGM具有增稠性、成膜性[6-8]、胶凝性[9-12]等特殊的功能,也有黏度高、分散度低、稳定性差等缺点,从一定程度上阻碍了其应用[13]。普鲁兰多糖(Pullulan,简称PULL)是一种直链状微生物多糖[14-17],其水溶液稳定性非常好,耐酸、耐碱、耐盐、耐高温,具有很好的成膜性[18-21],但黏度太低,不具有胶凝性。
将不同种多糖聚合物采用物理或化学的方法共混,可以显著改善其性能,形成具有优异综合性能的体系[22]。KGM和PULL共混后其复合体系的溶胶性能发生较大变化,而目前对两者混合复配及体系流变性能的研究很少。为得到分散性、稳定性、胶凝性、阻尼性更好的体系,本试验将KGM和PULL进行混合复配,研究其体系静态及动态流变特性,从而为其进一步的综合开发利用提供依据。
1 材料与方法
1.1 材料与仪器
魔芋葡甘聚糖(食品级):云南昭通市三艾有机魔芋发展有限公司;普鲁兰多糖(食品级):天津实发中科百奥工业生物技术有限公司。
高级旋转流变仪(Physica MCR301):奥地利安东帕有限公司。
1.2 试验方法
1.2.1 溶胶的制备
分别称取 0、10、20、30、40 mg PULL,室温下分散于100 mL去离子水中。待PULL充分溶解,置于60℃水浴中,边搅拌边加入 KGM 0、5、10、15 mg,以350 r/min的转速搅拌2 h,加碳酸钠继续搅拌10 min,形成均匀溶胶,备用。
1.2.2 流变性能分析
用流变仪测定KGM/PULL共混复合溶胶流变性能。采用PP50平板探头,平板间距为1.0 mm,进行测定。
静态流变测试:剪切速率为0.05~100 s-1,测试温度为30℃;
动态流变测试:频率扫描:应变为1%,扫描频率范围为0.1~100 Hz,测试温度为25℃;
温度扫描:应变为1%,频率为1.0 Hz,测试温度为25~100℃。将样品加到流变仪样品台上,用硅油密封,盖上盖板,防止水分蒸发。
2 结果与分析
2.1 静态流变测试结果
2.1.1 KGM浓度对体系表观黏度-剪切速率的影响
PULL质量浓度为 10 mg/mL,Na2CO3质量浓度为1 mg/mL,测试温度为30℃时,不同KGM浓度的体系黏度随剪切速率的变化,见图1。
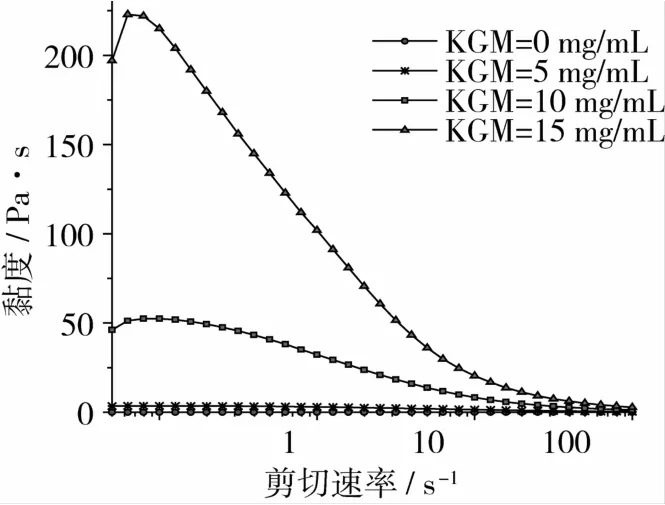
图1 不同KGM浓度下体系表观黏度-剪切速率曲线关系
由图1可以看出,单纯的PULL溶液(KGM质量浓度为0 mg/mL)黏度随剪切速率几乎无变化,是一种牛顿流体。将KGM添加到普鲁兰溶液后,共混体系的黏度与剪切速率关系发生很大变化,黏度随剪切速率的增加先增加后明显降低,显示出良好的剪切稀释性能,属于假塑性非牛顿流体。另外,随着KGM浓度的增大,体系黏度有明显增大趋势。这是因为KGM黏度高,PULL黏度低,二者共混后,KGM充分发挥其增稠增黏性能。而体系黏度与凝胶强度有着非常密切的关系。所以,添加KGM不仅可以增大体系黏度,还很可能使体系由非凝胶向凝胶化转变。但值得注意的是,KGM质量浓度超过15 mg/mL时,体系过于黏稠,不易搅拌均匀,且容易产生气泡,在实际生产过程中,要根据需求适当调整其浓度。
2.1.2 PULL浓度对体系表观黏度-剪切速率的影响
KGM质量浓度为10 mg/mL,Na2CO3质量浓度为1 mg/mL,测试温度为30℃时,不同PULL浓度的体系黏度随剪切速率的变化,从图2可以看出,随着剪切速率的增加,纯KGM溶胶黏度先增加,当剪切速率超过0.1 s-1后,黏度迅速降低,显示出良好的剪切稀释性能,属于假塑性非牛顿流体。而一定范围内增大PULL浓度,并未改变这一流体特性。在低剪切速率下,随着PULL浓度的增大,体系黏度先增大后持续降低。这可能是因为聚合物分子链段间的自身相互作用会导致聚合物分子链收缩,而聚合物分子与溶剂分子的相互作用则导致聚合物分子尺寸扩张[23]。随着PULL含量的增加,PULL分子与水分子的结合使得KGM分子和水分子的相互作用逐渐减弱,而KGM分子间结合力逐渐加强,导致KGM分子链收缩,分子尺寸大大减小,而且大量PULL覆盖在KGM胶粒表面,达到一个较高或相对饱和的状态,使整个体系胶粒间的迟滞力和黏滞力减小,流动性增大,黏度大幅度降低,混合体系分散性和稳定性得到提高。添加的PULL,起到乳化、分散的作用。
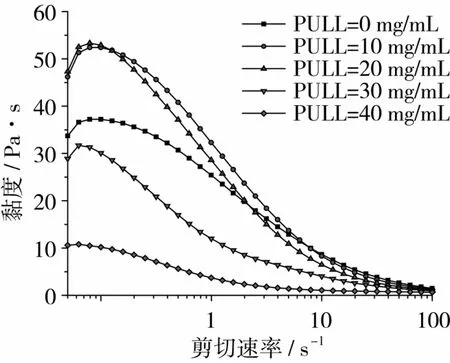
图2 不同PULL浓度下体系表观黏度-剪切速率曲线关系
2.2 动态流变分析
2.2.1 黏弹性测试
动态模量可以反映混合体系的黏弹性,储能模量G′代表弹性,损耗模量G″代表黏性。以下通过测试频率和温度对动态模量的影响,来进一步反映体系黏弹性随频率、温度的变化情况。
2.2.1.1 频率对体系黏弹性的影响
PULL质量浓度为10 mg/mL,Na2CO3质量浓度为1 mg/mL,温度25℃时,不同KGM浓度体系动态模量随频率的变化,如图3所示。KGM质量浓度为10 mg/mL,Na2CO3质量浓度为 1 mg/mL,温度 25℃时,不同PULL浓度的体系动态模量随频率的变化,如图4所示。
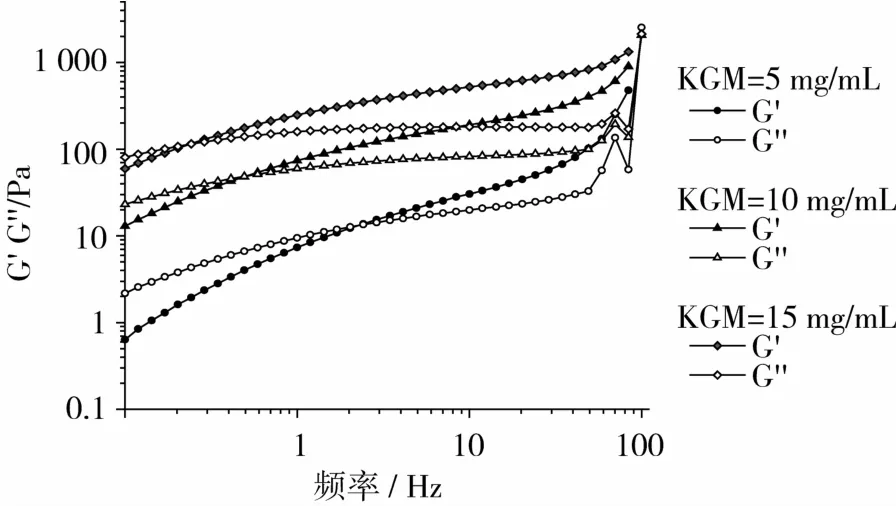
图3 不同KGM浓度下体系动态模量-频率曲线关系
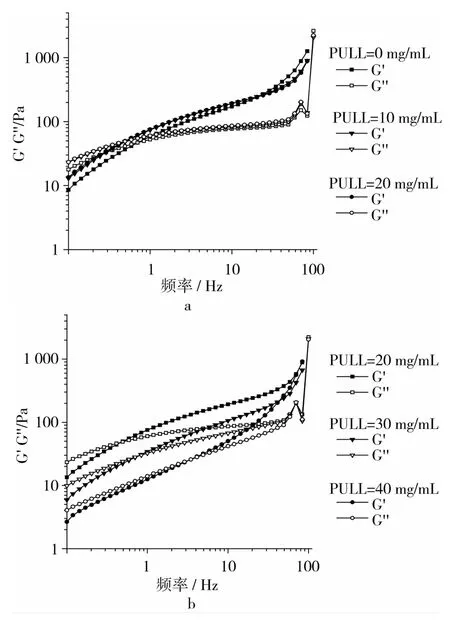
图4 不同PULL浓度下体系动态模量-频率曲线关系
从图3和图4可见,在测试的振荡频率范围内,储能模量G′和损耗模量G″随振荡频率的增加而增加。在低频率区,损耗模量G″大于储能模量G′,说明有效松弛时间足够长,分子链段的取向一致,溶胶易于流动;在高频率区,储能模量G′明显大于损耗模量G″,说明有效松弛时间减少,分子链段还来不及完全取向,是由于分子链的熵弹性产生回复,导致弹性出现。整个过程表现出明显的频率依赖性。
在碱性条件下,PULL添加量为10 mg/mL时,随着KGM浓度增大,体系储能模量和损耗模量均得到明显提高;交点Gx向低频区移动。说明随着KGM浓度的增大,体系黏度增大,在低频区就能形成网络结构。KGM添加量为10 mg/mL时,PULL添加越多,储能模量和损耗模量先轻微增加,再显著降低;交点Gx整体向高频区移动。说明随着PULL浓度增大,体系流动性增大,需要足够短的有效松弛时间才能形成网络结构,与静态流变测试结果基本相符。
2.2.1.2 温度对体系黏弹性的影响
PULL的添加量为10 mg/mL,Na2CO3质量浓度为1 mg/mL时,不同KGM浓度下体系动态模量与温度关系如图5所示。由图5可以看出,在整个测试温度区域内,随温度的升高,体系动态模量先降低后升高,表现出明显的温度依赖性。这可能是由于随着温度的升高,体系中分子的布朗运动加剧,并伴随一些氢键的断裂;而达到足够高的温度后,KGM分子链脱去乙酰基,双螺旋结构开环交叉,并在氢键、疏水等相互作用下发生相互缠绕,形成网状结构[24-25]。KGM添加越多,体系储能模量G′和损耗模量G″均越高。KGM添加量为5 mg/mL时,在温度25~100℃范围内,损耗模量G″始终大于储能模量G′,说明它易于流动。即KGM浓度为5 mg/mL,PULL的添加量为 10 mg/mL,Na2CO3的浓度为 1 mg/mL时,体系难以形成连续结构的凝胶网络。当KGM添加量为10 mg/mL,温度超过94℃时,储能模量G′大于损耗模量G″,表明在高温条件下,此浓度可以形成凝胶。当KGM添加为15mg/mL,温度超过88℃时,储能模量G′明显大于损耗模量G″,表明此时的凝胶网络结构已经富有弹性,分子链缠结贯穿效应明显。总之,KGM添加越多,形成凝胶需要加热的温度越低,体系越容易凝胶,胶凝性也越好。
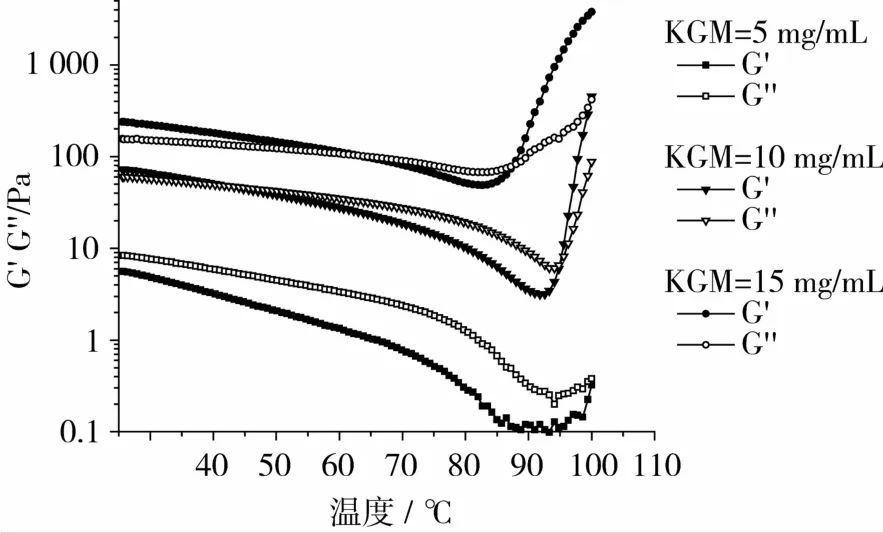
图5 不同KGM浓度下体系动态模量-温度曲线关系
KGM的添加量为10mg/mL,Na2CO3质量浓度为1 mg/mL时,不同PULL浓度下体系动态模量与温度关系如图6所示。由图6可以看出,在低温区,添加低浓度PULL,共混体系储能模量G′和损耗模量G″升高幅度小,几乎没有太大变化;PULL质量浓度大于20 mg/mL时,随着其浓度的增大,体系储能模量G′和损耗模量G″均明显下降。在25~90℃范围内,随着PULL浓度的增大,体系的模量随温度升高而降低现象减弱,也就越稳定;PULL质量浓度为40 mg/mL时,储能模量 G′和损耗模量 G″几乎没变化,此时,KGM和PULL质量比为1∶4,体系倾向于表现PULL质量的稳定性。PULL质量浓度分别为10、20、30、40 mg/mL的体系开始形成凝胶的温度分别为95、94、92.5、91.5℃,说明PULL添加越多,形成凝胶所需要的温度越低,体系越容易凝胶。
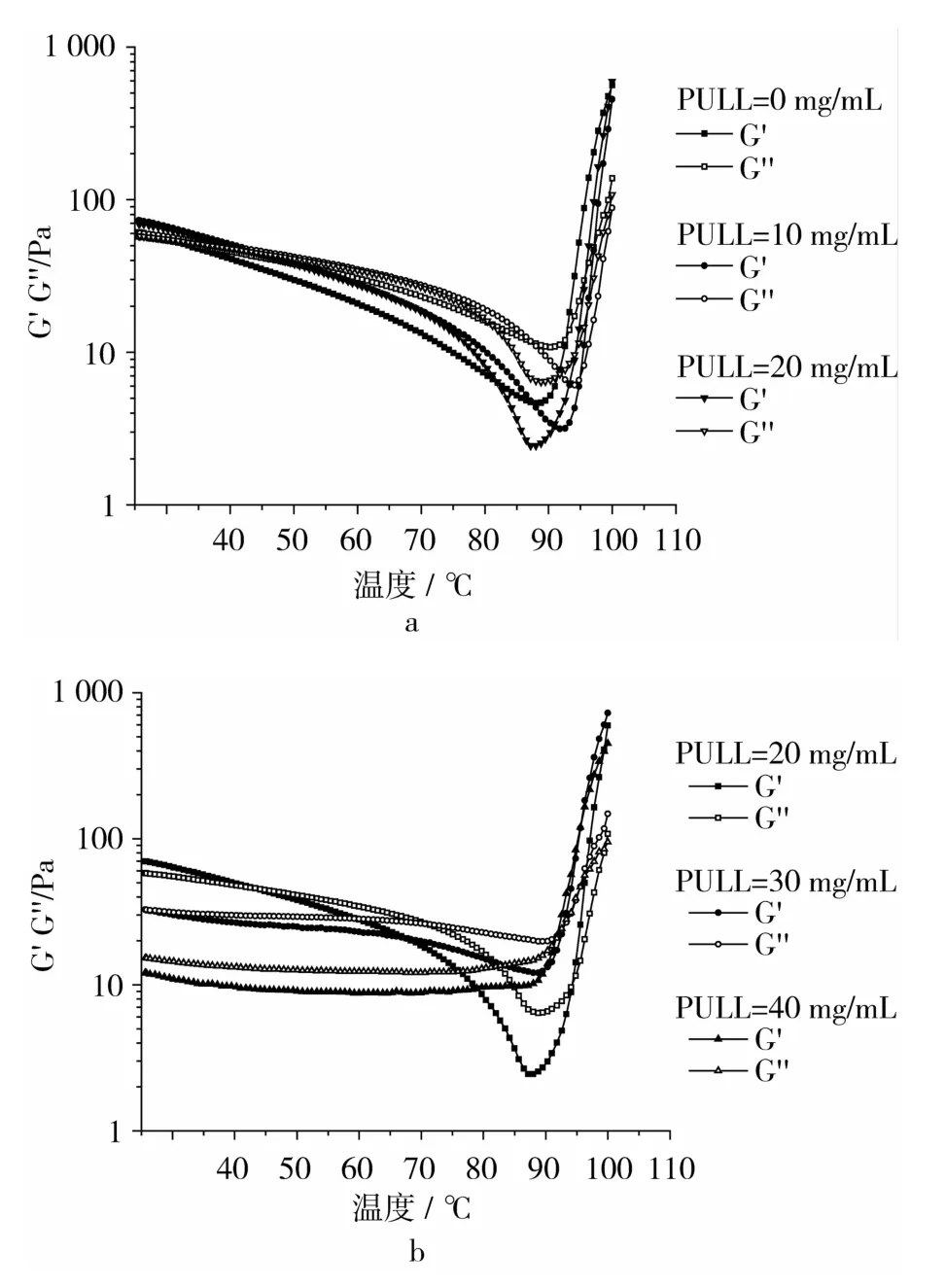
图6 不同PULL浓度下体系动态模量-温度曲线关系
2.2.2 阻尼性测试
阻尼系数tanδ=G″/G′,tanδ越大,表明体系的黏性比例越大,流动性强,反之则弹性比例较大[26-27]。通过研究频率和温度对阻尼系数的影响来进一步研究体系的阻尼性,为其在阻尼材料方面的应用提供理论依据。
2.2.2.1 频率对阻尼系数的影响
当KGM质量浓度为10 mg/mL,Na2CO3质量浓度为1 mg/mL,温度25℃时,不同PULL浓度下的阻尼系数随频率的变化如图7所示。分别选取0.1、1.0、10 Hz 3个频率,阻尼系数随 PULL浓度的变化如图8所示。
由图7~图8可以看出,在整个扫描区域内,随着频率的增大,体系阻尼系数下降。在低频扫描区域内(0.1~0.3 Hz),随着PULL质量浓度的增大,阻尼系数逐渐降低。扫描频率0.3~10 Hz时,PULL质量浓度以20 mg/mL为分界,随着PULL质量浓度的增大,阻尼系数先小幅降低,再大幅度提高。说明此时体系弹性比例先增大后减小。扫描频率>10 Hz时,随着PULL浓度的增大,阻尼系数增加。以PULL质量浓度20 mg/mL为分界,阻尼系数>1的频率区域先小幅缩窄,再大幅度拓宽。PULL质量浓度分别为0、10、20、30、40 mg/mL时,体系阻尼系数 >1的频率区域分别为0.6、0.4、0.33、0.6、3.36 Hz。PULL质量浓度为40 mg/mL时,频域最宽,说明此浓度下,KGM/PULL体系阻尼性最好,即其减震降噪效果最好。
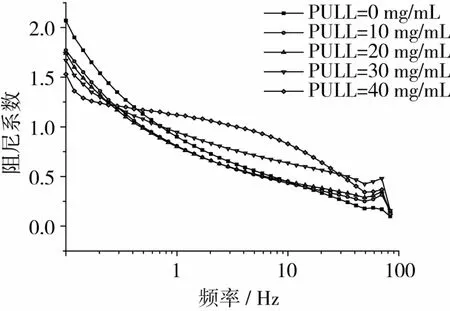
图7 不同PULL浓度下体系阻尼系数-频率曲线关系

图8 不同频率下体系阻尼系数-PULL浓度曲线关系
2.2.2.2 温度对阻尼系数的影响
PULL的添加量为10 mg/mL,Na2CO3质量浓度为1 mg/mL时,不同KGM浓度下体系阻尼系数与温度关系如图9所示。由图9可以看出,在整个温度测试范围内,随温度的升高,体系阻尼系数先升高后降低,说明体系的流动性随温度升高而缓慢升高;当温度在85~90℃之间时,体系的阻尼系数达到最大;继续升高温度,体系开始形成凝胶结构,流动性迅速下降。这与前面黏弹性测试结果相符。随着KGM浓度的增大,阻尼系数减小,从而说明体系流动性减小。这与静态流变测试随KGM浓度的增大,体系黏度增大的结果相符。
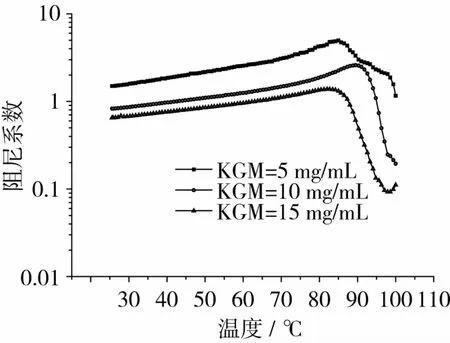
图9 不同KGM浓度下体系阻尼系数-温度曲线关系
KGM的添加量为 10 mg/mL,Na2CO3为 1 mg/mL时,不同PULL浓度下体系阻尼系数与温度关系如图10所示。由图10可以看出,在整个温度测试范围内,随着温度的升高,体系的阻尼系数先升高后降低;当温度达到90℃时,阻尼系数达到最大;继续升高温度,体系的阻尼系数反而迅速下降,这是因为体系开始形成凝胶结构,流动性迅速下降。以PULL质量浓度为20mg/mL为分界,随PULL浓度的增大,阻尼系数tanδ>1的温域先小幅度缩窄,后大幅度拓宽。当PULL质量浓度为40mg/mL时,温域最宽,阻尼性最好,减震降噪效果也最好。
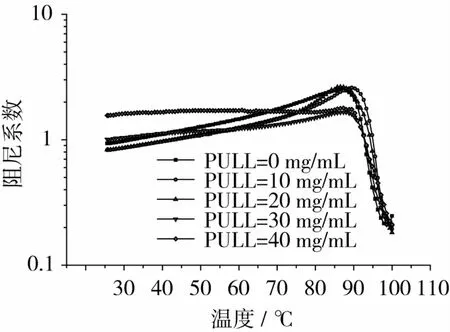
图10 不同PULL浓度下体系阻尼系数-温度曲线关系
3 讨论
KGM具有非常好的增稠性、成膜性、胶凝性,广泛应用于食品加工、保鲜等领域[28-29]。由于其水溶胶稳定性不好,不耐高温,耐酸能力也不好,使其应用受到限制[30]。PULL水溶胶稳定性好,耐酸、耐碱、耐盐、耐高温。但因为其黏度非常低,在实际生产运用中,需要添加非常高的浓度。
将KGM和PULL进行共混复配,使二者优势互补,得到黏度适中,分散性、稳定性、胶凝性、阻尼性更好的体系,与大多数复配增稠[23]不同,具有广阔的应用前景。研究浓度、频率、温度对KGM/PULL体系黏度、黏弹性、阻尼性等流变性能的影响,探讨分子间相互作用机理,预测混合体系的实际加工、存储等性能,也为进一步研究二者共混凝胶、膜材料、阻尼材料等提供了依据。
4 结论
4.1 KGM能显著提高体系的黏度及动态模量。PULL的添加,在一定范围内可以增大黏度,但效果不显著;并且当其质量浓度>20 mg/mL时,随其浓度的增加,体系黏度会显著降低。
4.2 在频率扫描中,在PULL质量浓度≤20 mg/mL时,随着PULL浓度的增加,储能模量及损耗模量小幅度增大;在PULL质量浓度>20 mg/mL时,随着PULL浓度的增加,储能模量及损耗模量均大幅降低。
4.3 在温度扫描中,KGM添加越多,体系储能模量G′和损耗模量G″均越高。在25~90℃范围内,随着PULL浓度的增大,KGM/PULL体系的温度依赖性减弱,体系更加稳定。而且PULL添加越多,形成凝胶所需要的温度越低。
4.4 PULL质量浓度20 mg/mL为分界,随着其浓度的增大,阻尼系数>1的频率和温度区域先小幅缩窄,再大幅度拓宽。当PULL质量浓度为40 mg/mL时,体系阻尼系数>1的频域和温域均最宽,说明在此浓度下,KGM/PULL体系阻尼性最好。
总之,在碱性条件下,试验范围内,KGM质量浓度为10~15mg/mL,PULL添加20~40 mg/mL时,可得到黏度适中,分散性、稳定性好,胶凝性佳,阻尼性能优良的体系。
[1]李江,陈靠山,郝林华,等.细菌胞外多糖的研究进展[J].海洋科学,2006,30(4):74-77
[2]张彦民,李宝才,朱利平,等.多糖化学及其生物活性研究进展[J].昆明理工大学学报:理工版,2003,28(3):140-145,149
[3]顾学裘,顾茂瑜.多糖类的生物活性及其发展趋向[J].中成药,1988(5):37-39
[4]黄明发,张盛林.魔芋葡甘聚糖的增稠特性及其在食品中的应用[J].中国食品添加剂,2008,(6):127-131
[5]梁叶星,熊家艳,王永红,等.辛烯基琥珀酸魔芋葡甘聚糖酯的微波半干法制备工艺及性能[J].食品科学,2013,34(14):163-168
[6]Wu C,Peng S,Wen C,et al.Structural characterization and properties of Konjac Glucomannan/curdlan blend films[J].Carbohydrate Polymers,2012,89(2):497-503
[7]Lin H,Chen Q H,LiW Y,et al.Preparation and research of KGM/starch composite films[J].Advanced Materials Research,2011,197:1163-1166
[8]Zhu W B,Chen QH,Chen J,etal.Effectof Konjac Glucomannan content on the structure and properties of sodium Hyaluronate/Chitosan/Konjac Glucomannan composite films[J].Advanced Materials Research,2013,738:67-72
[9]庞杰,吴春华,温成荣,等.魔芋葡甘聚糖凝胶研究进展及其问题[J].中国食品学报,2011,11(9):181-187
[10]Xu D Y,Liao Z F,Wang H.Preparation and characteriza-tion of Konjac Glucomannan Gel[J].Applied Mechanics and Materials,2012,117:1374-1376
[11]Luo X,He P,Lin X.Themechanism of sodium hydroxide solution promoting the gelation of Konjac Glucomannan(KGM)[J].Food Hydrocolloids,2013,30(1):92-99
[12]Du X,Li J,Chen J,etal.Effectof degree of deacetylation on physicochemical and gelation properties of Konjac Glucomannan[J].Food Research International,2012,46(1):270-278
[13]Tian D,Gong Y,Xie H.Study on aqueous viscosity behavior of Konjac Glucomannan hydrosol[J].Natural Product Research and Development,2005,17(6):736-739
[14]金征宇,顾正彪,童群义,等.碳水化合物化学[M].北京:化学工业出版社,2008:186-299
[15]Leathers T D.Biotechnological production and applications of pullulan[J].Applied Microbiology and Biotechnology,2003,62(5-6):468-473
[16]Wallenfels K,Bender H.Procedure for the production of a dextran-like polysaccharide from pullularia pullulans:German Patent,1096850[P].1961:01
[17]Roukas T.Pretreatment of beetmolasses to increase pullulan production[J].Process Biochemistry,1998,33(8):805-810
[18]Kawahara M,Mizutani K,Suzuki S,et al.Dependence of themechanical properties of a pullulan film on the preparation temperature[J].Bioscience,Biotechnology,and Biochemistry,2003,67(4):893-895
[19]Trinetta V,Cutter C N,Floros J D.Effects of ingredient composition on optical andmechanical properties of pullulan film for food-packaging applications[J].LWT-Food Science and Technology,2011,44(10):2296-2301
[20]Zhang JF,Li Z,Yan J J,et al.Preparation and properties of pullulan composite films[J].Advanced Materials Research,2012,476:2100-2104
[21]Xiao Q,Lim L T,Tong Q.Properties of pullulan-based blend films as affected by alginate content and relative humidity[J].Carbohydrate Polymers,2012,87(1):227-234
[22]赵孝彬,杜磊,张小平,等.聚合物共混物的相容性及相分离[J].高分子通报,2001,4(8):75-80
[23]崔雷,杨成.玉米支链淀粉在单糖,寡糖水溶液中的粘度行为[J].化学研究与应用,2008,20(10):1279-1281
[24]李斌,谢笔钧.魔芋葡甘聚糖凝胶机理研究[J].中国农业科学,2002,35(11):1411-1415
[25]王丽霞,庞杰.魔芋葡甘聚糖不可逆凝胶研究进展及相关问题[J].食品安全质量检测学报,2012,3(5):387-391
[26]万金虎,陈晓明,徐学明,等.四种常见亲水胶体对面团特性的影响研究[J].中国粮油学报,2009,24(11):22-25
[27]许元泽.高分子结构流变学[M].成都:四川教育出版社,1988:180-192
[28]谢建华,林常青,庞杰.魔芋精粉的应用及研究进展[J].河南科技大学学报:农学版,2004,24(3):60-63
[29]方竞,沈月新.魔芋精粉的研究进展及其在食品工业中的应用[J].食品研究与开发,2003,24(1):30-32
[30]丁金龙,孙远明,乐学义.魔芋胶与大豆分离蛋白的相互作用研究[J].中国粮油学报,2003,18(3):65-69,77.

