红碱淖遗鸥血液基因组DNA提取方法的比较研究
行文珍,雷 忻,戚珍珠,田鹏飞,张静静
(延安大学 生命科学学院,陕西 延安 716000)
遗鸥(Ichthyaetus relictus),隶属于鸻形目(Charadriiformes)鸥科(Laridae)鸥属(Larus)[1],目前繁殖地集中在蒙古国(数处)、哈萨克斯坦(2处)、俄罗斯(1处)和中国(1处),其越冬地在中国和韩国亦有发现[2-3]。1931年,瑞典博物学家艾纳·隆伯格(Ejnar Lonnberg)首次撰文提及其在中国内蒙古额济纳旗境内发现的遗鸥标本,但其认为遗鸥是黑头鸥在东方的一个变种。1971年才被苏联鸟类学家Auezov确立为有效物种[4],同时被列入《濒危野生动植物种国际贸易公约》(CITES)和《迁徙物种公约》(MSC)附录Ⅰ,在IUCN发布的《红皮书》一直被列为受威胁鸟种,是世界珍稀濒危鸟类,也是我国一级保护鸟类[5-6]。目前,陕西省神木县红碱淖湿地是国内最大的遗鸥繁殖种群[7],针对该种群开展分子生物学研究,对于拯救和保护这一濒危鸟种具有重要的科学价值和实际意义。
分子生物学技术在珍稀濒危鸟类的遗传、进化、种群关系、物种鉴定、性别鉴定等多方面的研究都有较广的应用,但是由于珍稀濒危鸟类取样困难,十分珍贵,因此选择高效的DNA提取方法尤为重要。本文采用改良的Miller的盐析法和酚-氯仿法分别对红碱淖遗鸥血液基因组DNA进行提取,并比较2种方法的提取效果,以期筛选简便、实用、经济的有效提取方法。
1 材料与方法
1.1 试验材料
遗鸥血液样品,采集于陕西省神木县红碱淖湿地,-20℃冷冻保存。
1.2 试验方法
参照柯柳玉[8]、王敏强[9]的禽血基因组 DNA提取方法并加以改良,分别采用酚-氯仿法和改良Miller盐析法从遗鸥冷冻血液样品中提取基因组DNA,酶解时间分别为10 h和16 h。
1.2.1 酚-氯仿法
取适量冷冻血液于室温下自然解冻,置于离心管中,加入10倍体积的动物血裂解液,颠倒混匀,再加入蛋白酶K使其终浓度达到100 μg/mg,颠倒混匀,55℃水浴10 h。加入等体积酚,轻轻颠倒混匀20 min,4℃ 12000 r/min离心5 min,取上清,重复上面步骤一次,取上清于另一洁净离心管中,加入等体积酚、氯仿和异戊醇混合液(体积比=25∶24∶1),轻轻颠倒混匀20 min,4℃ 12000 r/min离心5 min,取上清重复上一步骤,取上清加入等体积的氯仿和异戊醇混合液(体积比=24∶1),轻轻颠倒混匀20 min,4 ℃ 12000 r/min离心5 min,取上清,加入1/10体积的3 mol/L醋酸钠溶液(pH=5.2),二倍体积预冷的无水乙醇,室温放置15 min,12000 r/min离心5 min,弃上清,再用75%乙醇洗涤沉淀2次,室温干燥后溶于20 μL无菌水。
1.2.2 改良Miller盐析法
参照任春环[10]、苗永旺[11]的基因组快速提取方法。取适量冷冻血液置于室温下自然解冻后,将其转移至1.5 ml离心管中,加4倍体积的红细胞裂解液,混匀,4℃ 12000 r/min离心5 min,弃上清,重复上面步骤,至细胞团成粉白色。加8倍体积的生理盐水混匀,4℃ 12000 r/min离心5 min,弃上清。加入3 mL NLB(白细胞裂解液))+SDS(十六烷基硫酸钠)缓冲液,50 μL 蛋白酶 K 溶液,400 μL 10%SDS溶液,混匀,55℃ 10 h加入1/4体积6 mol/L NaCl,颠倒混匀,4℃ 12000 r/min离心10 min。取上清于加入2倍体积的预冷无水乙醇中沉淀,轻摇至DNA析出,静止30 min,12000 r/min离心2 min,小心倒掉上清液。用75%乙醇洗涤沉淀2次。室温干燥后溶于20μL无菌水。
1.2.3 DNA质量检验
取0.15 g琼脂糖放入锥形瓶中,加入10 mL 0.5×TBE(四溴乙烷Tetra Bromo Ethane)缓冲液,置于微波炉中加热至完全融化并摇匀,则为0.8%琼脂糖凝胶液。
取制胶梳、制胶板,用蒸馏水洗净晾干后置水平位置。放好梳子后,将冷却到60℃左右的琼脂糖凝胶液沿胶板一侧缓慢地一次性倒入,注意不要形成气泡。室温凝胶大约30 min,胶凝固后拔出梳子,将胶放入电泳槽内,在其中加入0.5×TBE电泳缓冲液。
取5 μL DNA 原液与2 μL 10 ×Loading Buffer混匀,然后点入加样孔,接通电泳槽与电泳仪的电源,电压80 V,30 min,停止电泳。取出胶放入EB溶液中染色约10 min后,使用凝胶成像仪检测结果。
2 结果与分析
2.1 直接观察
酚-氯仿法提取遗鸥基因组DNA呈絮状,易干燥,易溶解;改良Miller盐析法提取遗鸥基因组DNA呈丝胶状,不易干燥,难溶解。
2.2 琼脂糖凝胶电泳
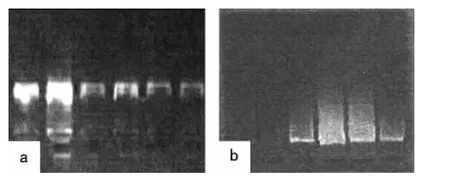
图1 酚-氯仿法和改良Miller盐析法提取遗鸥基因组DNA电泳图
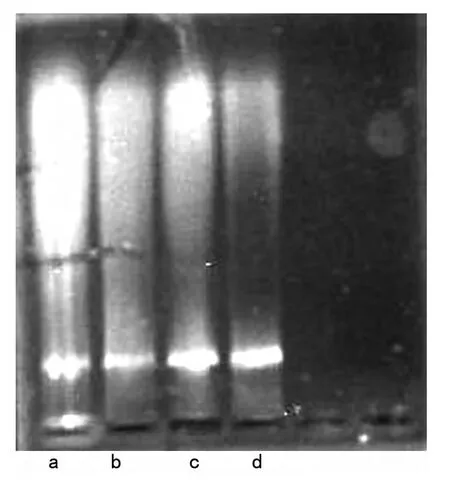
图2 酚-氯仿法不同酶解处理时间DNA电泳图
由图1可见,酚氯仿法获得的DNA样品亮度高和清晰度很高,条带较粗,降解少,基本无拖尾现象;改良Miller盐析法样品亮度和清晰度均不高,条带较细,有拖尾现象,表明酚 -氯仿抽提法提取的DNA浓度高于改良Miller盐析法。
由图2可见,酚-氯仿法提取DNA时,蛋白酶K水解10 h和16 h时的提取结果有明显差异,酶解时间为10 h提取出来的样品清晰度不高,条带较细,而酶解时间为16 h提取出的样品亮度和清晰度明显较高,条带较粗。表明水浴时间越长,提取的DNA浓度越高。
3 讨论
任春环[10]等在提取山羊全血DNA时,比较了酚-氯仿抽提法、碘化钾法方法,认为改良Miller盐析法操作步骤复杂、时间长。曹岩峰[12]等采取酚-氯仿抽提法提取了牛凝血块基因组DNA,经琼脂糖凝胶电泳和PCR检测,结果良好,只是浓度偏低。曹果清[13]等对组织中提取DNA的方法进行改进,先对凝血块进行预处理,用组织DNA抽提液裂解细胞,然后经过酚-氯仿抽提无水乙醇沉淀等步骤即可获得浓度高、纯度好、结构完整的DNA分子。Pietro[14]、Wang[15]等也认为酚 - 氯仿法较其他方法好。本研究结果显示,酚-氯仿法和改良Miller盐析法对遗鸥基因组DNA提取都较为有效,但两种方法相比较,酚-氯仿法提取的DNA总量与质量较好,且稳定,而改良Miller盐析法虽操作比较简单,但提取DNA纯度和质量均较差些。因此,酚-氯仿法在红碱淖遗鸥冷冻血液基因组DNA的提取中,效果明显优于改良Miller盐析法。
蛋白酶K能有效地分离核酸和蛋白质,其消化时间是影响DNA提取效果的关键因素。目前,大多数研究采用55℃水浴过夜的方式进行消化,这是传统酚-氯仿法中最耗时的环节。本研究分别采用酚-氯仿法酶解10 h和16 h的方法,对遗鸥基因组DNA进行提取,比较电泳结果,观察到酶解10 h时提取样品的清晰度低,条带细,拖尾现象严重,而酶解时间16 h时提取样品的亮度和清晰度明显较高,条带较粗,提示酶解16 h时的DNA提取效果优于酶解10 h,说明在一定时间范围内,蛋白酶K对遗鸥冷冻血液样品处理时间越长,基因组DNA提取效果越好。
[1]郑光美.中国鸟类分类与分布名录[M].北京:科学出版社,2005,235 -246.
[2]张荫荪,何芳奇,陈容伯,等.遗鸥繁殖生境选择及其繁殖地湿地鸟类群落研究[J].动物学研 究,1993,14(2):128-135.
[3]Vaurie C.A survey of the birds of Mongolia[J].Bull A-mer Mus Nat Hist,1964,127(3):1 -147.
[4]Auezov EM.Taxonomic evaluation and systematic status of larus relictus[J].J.Acad.Sci.Moscow,1971,50:235 -242.(in Russian).
[5]King WB(ed.).Red Data Book,2.Aves.IUCN,Morges,Switzerland,1978 -1979.
[6]Stattersfield AJ,Capper DR.Threatened Birds of the World.Bird Life International,Cambridge,UK.2000.
[7]雷忻,王文强,廉振民.陕西红碱淖遗鸥研究现状分析[J]. 延安大学学报(自然版),2011,30(4):93-96.
[8]柯柳玉,谢燕燕.禽类全血DNA不同提取方法的比较[J]. 福建畜牧兽医,2008,30(2):4-6.
[9]王敏强,曹俊辉,刘晓玲.3种禽血抗凝剂效果及其对DNA提取质量的影响[J].安徽农业科学,2006,34(23):6124-6125.
[10]任春环,张子军,张孝荣,等.三种山羊全血基因组DNA提取方法的比较[J].中国草食动物,2010,30(4):22-24.
[11]苗永旺,霍金龙,李莲军,等.从鸡血中快速提取高质量基因组DNA方法的研究[J].黑龙江畜牧兽医,2005(12):10-12.
[12]曹岩峰,李建斌,王洪梅,等.牛血凝块基因组DNA提取方法的建立[J].中国草食动物,2007,27(6):39-40.
[13]曹果清,莫清珊,陈凤仙.酚/氯仿抽提法提取绵羊凝血块中基因组 DNA[J].安徽农业科学,2009,37(34):16771-16772.
[14]Pietro FD,Ortenzi F,Tilio M,et al.Genomic DNA extraction from whole blood stored from 15 to 30 years at -20℃by rapid Phenol-chloroform protocol:a useful tool for genetic epidemiology studies[J].Mol Cell Probes,2011,25(1):44-48.
[15]Wang J Y,Yu Y,Feng L X,et al.Genomic DNA extraction from hair sacs of pigs using modified Phenol-chloroform method[J].Hereditas,2010,32(7):752 -756.

