鲤春血症病毒单克隆抗体建立及免疫学特性鉴定
景宏丽 张 旻 王 娜 李 维 贾小波 方 莹 高隆英 林祥梅 吴绍强*
(1.中国检验检疫科学研究院 北京 100029;2.蛇口出入境检验检疫局)
1 前言
鲤春病毒血症(Spring viraemia of carp,SVC)是一种由弹状病毒感染,能够引起数种鲤鱼、鲤科鱼类以及鲶科鱼类急性出血和流行性败血症,春季SVC爆发时,幼龄鲤鱼的死亡率可达70%。在奥地利、法国、德国、英国[1]、加拿大[2]和北美[3]等多个国家和地区均有SVC的相关报道,我国于2004年也首次报道了SVC[4],目前该病已被世界动物卫生组织(OIE)列为必须申报的疫病[5]。SVC的病原是鲤春血症病毒(Spring Viraemia of Carp virus ,SVCV),属弹状病毒科,暂被列入水疱病毒属。该病毒基因组为不分节、负意义的单链RNA;基因组包含有11019个核苷酸,依次编码核蛋白(N)、磷蛋白(P)、基质蛋白(M)、糖蛋白(G)、依赖RNA的RNA聚合酶(L)[6]。目前检测该病毒的常用方法是先进行病毒分离,然后用RT-PCR技术[7-9]或者其他方法[10-11]进行鉴定。RT-PCR技术虽然具有高灵敏度的优越性,但在结果判断上易出现假阳性。OIE还推荐了一些检测方法,即建立在单克隆抗体基础上的间接免疫荧光技术(IF)和酶联免疫吸附试验(ELISA)。近年来,一些学者建立了诊断SVC的商业试剂盒,主要是采用IF和ELISA两种方法检测几种弹状病毒,包括SVCV的几种不同株。ELISA结果显示试剂盒的特异性较差,而IF仅能检测出4株SVCV中的一株[12]。为了提高抗体的特异性,有些学者也应用了单克隆抗体技术。如2007年,邴国霞等制备了针对SVCV核蛋白的单克隆抗体[13];国外学者S.Reschova等制备出了抗SVCV的G蛋白的单克隆抗体,但与另外一种弹状病毒PFR有交叉反应[14]。本研究旨在制备特异性强的抗SVCV单克隆抗体,以期研制有效的病毒鉴定方法,满足我国水生动物检疫工作的迫切之需。
2 材料与方法
2.1 材料
2.1.1 试剂
RPMI 1640:购于HyClone公司;特级胎牛血清:购于杭州四季青公司;HAT、HT、聚乙二醇(PEG1500):均购于Gibco公司;二甲基亚砜、硫酸盐TMB、辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG、弗氏完全佐剂和不完全佐剂:均购于Sigma公司;DAB发色液:购于天根公司;硝酸纤维素膜:购于PALL公司;SBA抗体分型试剂盒:美国 Shouthern Biotech生产;其他试剂:均为国产分析纯。
2.1.2 仪器
TS100倒置相差显微镜:Nikon公司;二氧化碳培养箱:SANYO公司;Avanti J-30I超速离心机:Beckman公司。
2.1.3 实验动物及其他材料
SP2/0细胞、实验中涉及的鱼类细胞株和病毒株:均由本实验室保存;BALB/c小鼠:购于北京军事科学与医学研究院。
2.2 方法
2.2.1 抗原的制备和免疫小鼠
SVCV经由EPC细胞在20℃扩增,冻融一次后收集病毒悬液,经过7000g 离心35 min,收集上清液,75000g差速离心5h,收集沉淀,用0.5mL的生理盐水重悬。
免疫BALB/c小鼠,共免疫4次。具体免疫程序如下:①基础免疫。病毒悬液与弗氏完全佐剂1:1混合,按每只0.1mL腹腔注射;②2周后加强免疫。病毒悬液与弗氏不完全佐剂1:1混合,每只腹腔注射0.1mL;③之后每隔1周再按同样剂量腹腔注射加强免疫1次;④第4次免疫后第3天,将小鼠脱颈椎处死,无菌取脾脏用于细胞融合。
2.2.2 细胞融合
采用常规方法进行细胞融合[15]:取免疫小鼠的脾脏细胞和Sp2/0细胞混合于融合管内,100g离心5 min,弃上清液,轻振管底,使沉淀细胞松散均匀,置于37℃水浴中预热;用60 s时间缓慢加入1mL PEG1500溶液,边加边轻转搅拌,然后缓慢加入改良型RPMI1640培养基,终止融合;70g离心6 min,弃上清液,加入HAT培养基;再加入适量的饲养细胞分装至96孔细胞培养板,于45mL/L CO2培养箱中培养。
2.2.3 阳性杂交瘤细胞的筛选
当杂交瘤细胞群落长到占培养板孔底1/3时,取细胞培养液上清液进行检测。使用经过差速离心初步提纯、浓缩的SVCV悬液包埋96孔ELISA板,抗原的包被浓度为4μg/mL,阴性对照为正常的细胞悬液,包被条件为4℃过夜;加入待测的杂交瘤细胞培养上清液,并37℃反应90min后,洗涤,随后加入辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG,洗涤;TMB发色液发色,2 mol/L H2SO4终止反应;测定波长为450 nm时各孔的OD值(A450),计算待测上清与病毒孔和细胞孔反应后的OD值之比(P/N),当P/N≥2.1时判定为阳性。
2.2.4 阳性杂交瘤细胞系的建立与腹水的制备
将检测结果为阳性的杂交瘤细胞孔中的细胞扩大培养并及时冻存,同时按照有限稀释法进行克隆,至阳性率为100%时,即可定株。然后,进行腹水的诱生,主要是取6-8周龄雌性BALB/c小鼠,按每只0.5mL腹腔内注射无菌的液体石蜡;1周后,每只腹腔内注射106个活的阳性杂交瘤细胞;接种杂交瘤细胞后7-10 d,小鼠腹部明显膨大;用酒精棉球消毒下腹部皮肤后,用注射器抽取腹水。一般每只小鼠1 次可抽腹水1-5mL,间隔2-3 d,待腹水再生积蓄后,同法再抽,一般可抽1-3次。2000g离心10 min,收集水相上清液(不能吸取离心管最上层的油相物质),-20℃冻存备用。
2.3 单克隆抗体免疫学特性的鉴定
2.3.1 mAb效价测定
用间接ELISA方法测定。收集的腹水2倍比系列稀释,其测定步骤同2.2.3。
2.3.2 mAb的亚型分析
按照SBA抗体分型试剂盒使用说明书进行测定。
2.3.3 mAb特异性测定
选取5种不同病毒和8种细胞株作为抗原包埋ELISA板,以测定所制备的抗SVCV腹水与它们的交叉反应程度。
2.3.4 SDS-PAGE 和Western blot分析
获得的mAb分别与差速离心纯化的SVCV和EPC细胞裂解液进行免疫印迹实验,以分析抗体所识别的抗原表位。按照文献常规方法[15]进行SDS-PAGE和Western blot分析,浓缩胶浓度为50g/L,分离胶浓度为120g/L;SDS-PAGE后,电转印到硝酸纤维膜上,用100/L脱脂奶粉4℃封闭过夜;洗涤后,加入腹水抗体(1:1500),37℃孵育1h;再次洗涤,加入辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG(1:10000),37℃孵育1 h;经过洗涤后,DAB显色。
2.3.5 免疫过氧化酶染色
接种EPC细胞到24孔板上,待细胞长满单层后,每孔加入100μL SVCV;35h后用固定液(30%丙酮和70%的酒精混合液)固定15min,加入单克隆抗体9C11(1:1000),37℃孵育90min;PBS-T洗涤3次,加入过氧化物酶(HRP)标记山羊抗鼠抗体IgG(1:200),37℃孵育90min后,洗涤3次;DAB发色。显微镜下观察。
3 结果
3.1 杂交瘤细胞株的建立
细胞融合后,经含HAT的培养基进行筛选,产生200多个杂交瘤细胞;经间接ELISA法检测杂交瘤细胞培养上清液中的抗体,筛选出抗SVCV的阳性细胞株进行克隆,获得2株能稳定分泌抗SVCV mAb的杂交瘤细胞株,分别命名为9C11和1C12。
3.2 单克隆抗体免疫学特性的鉴定
3.2.1 效价和亚型分析
间接ELISA法测得腹水的效价为104以上;抗体分型试剂盒检测结果显示所分泌的抗体亚型属于Ig2b型,k链。
3.2.2 mAb的特异性测定
按照2.2.3节用ELISA方法把mAbs 9C11和1C12 分别与病毒性出血性败血症病毒(viral haemorrhagic septicaemia virus,VHSV)、鲤春病毒血症病毒(Spring viremia of carp virus,SVCV)、传染性造血组织器官坏死病毒(infectious hematopoietic necrosis virus,IHNV)、狗鱼幼鱼弹状病毒(pike fry rhabdovirus,PFRV)、草鱼呼肠孤病毒(Grass Carp reovirus,GCRV)和流行性造血器官坏死病毒(epizootic haematopoietic necrosis virus,EHNV)以及8种鱼类细胞株反应,结果见表1。结果显示:mAb 9C11和1C12均仅与SVCV反应,与其他的病毒株和细胞株均不发生反应。
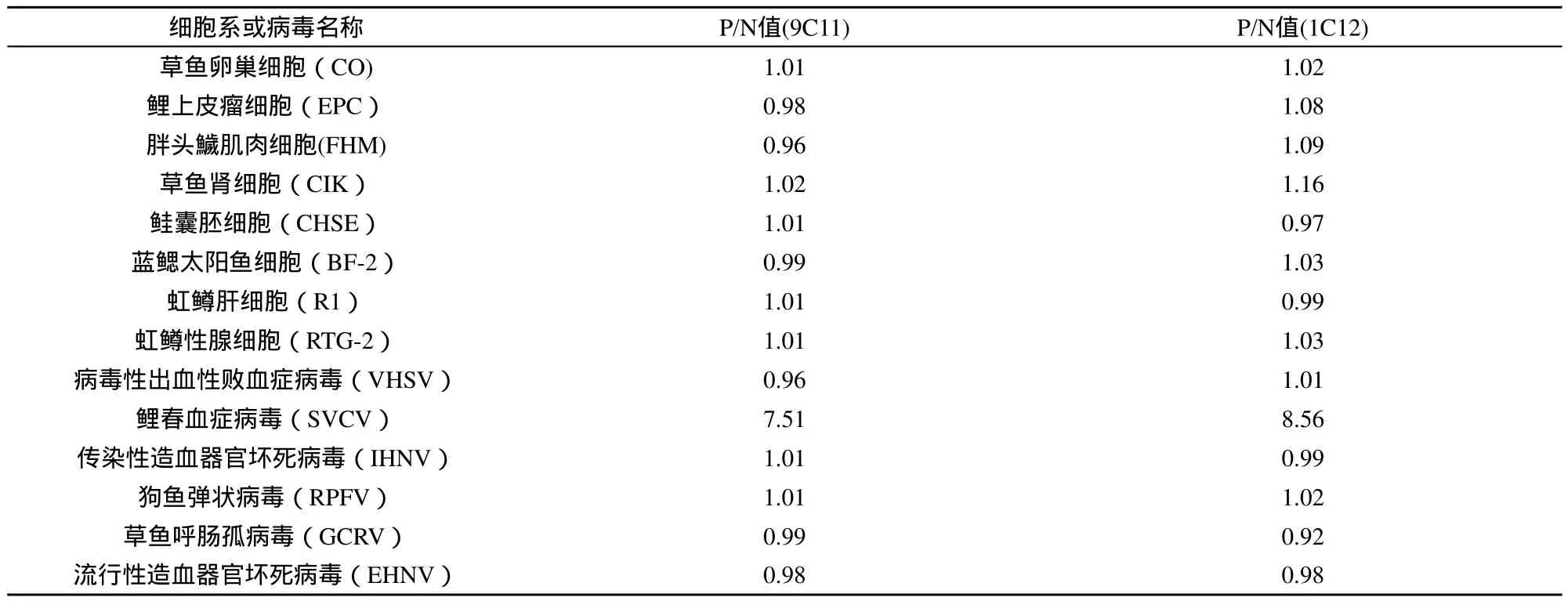
表1 mAb 9C11和1C12与病毒及细胞的ELISA反应结果(P/N值)
3.2.3 SDS-PAEG 和Western blot检测
对mAbs抗原识别表位的初步分析结果表明:单抗对应的抗原决定簇位点位于SVCV相对分子质量(Mr)230 000的蛋白带上(见图1)。
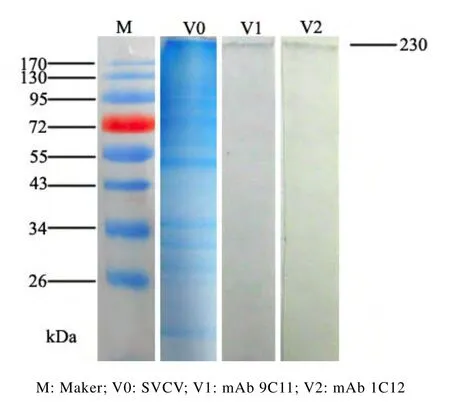
图1 SDS-PAGE和Western blot检测结果
3.2.4 免疫过氧化酶染色
经鉴定SVCV接种鲤鱼上皮瘤细胞(EPC)35h后,局部细胞出现深褐色,正常细胞未呈现颜色或仅显很浅的本底色,如图2箭头标示。A为低倍镜下结果,B为高倍镜下结果。
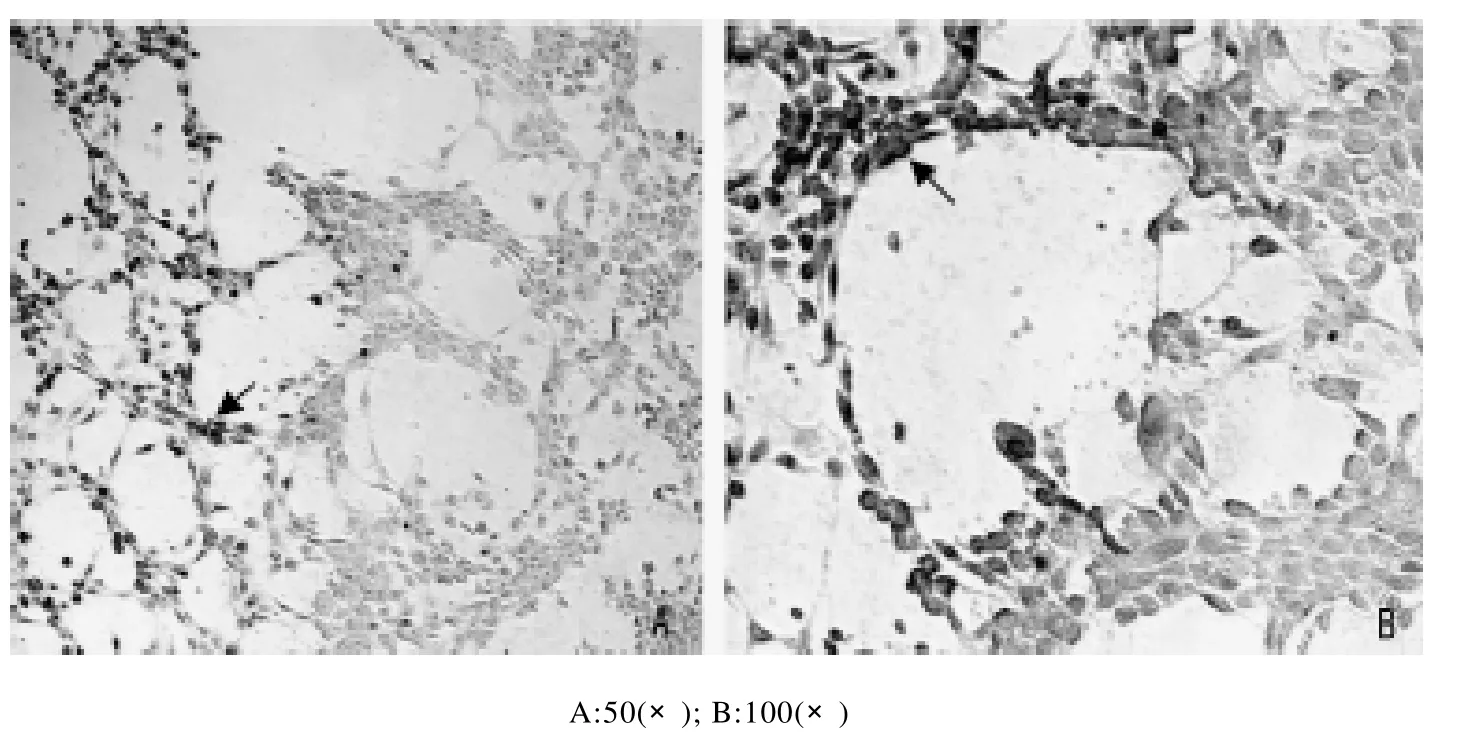
图2 免疫过氧化酶染色
4 讨论
免疫原是产生抗体的先决条件,故需选择合适的方法和反应条件来制备免疫原。应用前人的蔗糖梯度离心的方法制备病毒抗原,虽然保证了病毒的纯度,但是制备过程比较繁琐,且含量比较低。在抗原的制备上,本研究选择差速离心法,操作方便;在免疫方法上,采用免疫抑制的方法,弥补了病毒抗原制备上纯度低的缺陷,保证了免疫效果。本实验室在其他病毒抗体研制过程中也采用了类似的方法,取得了较好的免疫效果,但是具体机体对抗原产生耐受的机制或者原理还有待进一步的证实。
单克隆抗体对比多克隆抗体最主要的优势是特异性高,本研究制备的抗SVCV的mAbs仅与SVCV反应,与其他鱼类细胞和鱼类病毒株均不反应。说明该mAbs具有较高的特异性。对比国内外的其他学者的研究,本研究较全面地分析mAbs的特异性,无疑为mAbs的应用和SVCV免疫学检测方法的建立提供重要的理论基础。另外,免疫过氧化酶染色实验结果表明mAbs能够特异性的检测到细胞中的病毒,为后期免疫学方法的建立提供了坚实的基础,也为后期进一步研究病毒在宿主中的复制机制和过程提供了可能。
5 结论
本研究成功制备了抗SVCV的单克隆抗体,该抗体腹水效价均在104以上,且特异性高,与其他的病毒株和细胞株均没有交叉反应,今后可为该病毒的快速诊断及流行病学监测提供检测试剂。
[1]Way K,Bark S J,Longshaw C B,et al.Isolation of a rhabdovirus during outbreaks of disease in cyprinid fish species at fishery sites in England[J].Dis Aquat Org,2003,57(1-2):43-50.
[2]Garver K A,Dwilow A G,Richard J,et al.First detection and confirmation of spring viraemia of carp virus in common carp,Cyprinus carpio L.,from Hamilton Harbour,Lake Ontario,Canada[J].Journal of Fish Diseases,2007,30(11),665-671.
[3]Phelps N B,Armién A G,Mor S K,et al.Spring viremia of carp virus in Minnehaha Creek,Minnesota[J].J Aquat Anim Health,2012,24(4):232-237.
[4]H Liu,L Gao,X Shi,et al.Isolation of spring viraemia of carp virus(SVCV) from cultured koi (Cyprinus carpio koi) and common carp(C.carpio carpio) in P.R.China Bull[J].Eur Ass Fish Pathol,2004,24(4):194-202.
[5]Manual of Diagnostic Tests for Aquatic Animals[M].2009,262-278.
[6]Hoffmann B,Schütze H,Mettenleiter T C.Determination of the complete genomic sequence and analysis of the gene products of the virus of Spring Viremia of Carp,a fish rhabdovirus[J].Virus Research,2002,84(1-2):89-100.
[7]高隆英,史秀杰,刘荭,等.用RT-PCR快速检测鲤春病毒血症病毒基因[J].水生生物学报,2002,26:452-456.
[8]Koutna M,Vesdy T,PsikalI I,et a1.Identificationof spring viraemia of carp virus(SVCV) by combined RT-PcR and nested PCR[J].Dis Aquat Org,2003,55(3):229-235.
[9]Kim H J.Improved diagnosis of spring viremia of carp by nested reverse-transcription PCR:development of a chimeric positive control for prevention of false-positive diagnosis[J].J Virol Methods,2012,185(1):39-42.
[10]Shivappa R B,Savan R,Kono T,et al.Detection of spring viraemia of carp virus (SVCV) by loop-mediated isothermal amplification (LAMP)in koi carp,Cyprinus carpio L[J].J Fish Dis,2008,31(4):249-58.
[11]Liu Z,Teng Y,Xie X,et al.Development and evaluation of a onestep loop-mediated isothermal amplification for detection of spring viraemia of carp virus[J].J Appl Microbiol,2008,105(4):1220-1226.
[12]Dixon P F,Longshaw C B.Assessment of commercial test kits for entification of spring viraemia of carp virus[J].Dis Aquat Org,2005,67:25-29.
[13]邴国霞,张利峰,张鹤晓,等.鲤春病毒单克隆抗体的制备[J].中国兽医学杂志,2007,43(3):56-58.
[14]Reschova S,Pokorova D,Nevorankova Z,et al.Detection of spring viraemia of carp virus (SVCV)with monoclonal antibodies[J].Veterinarni Medicina,2007,52 (7):308-316.
[15]景宏丽,王静波,曹欢,等.病毒出血性败血症病毒单克隆抗体的制备及其特性分析[J].细胞与分子免疫学杂志,2013,29(4):400-402.

