沙门氏菌可替代方法实验室内验证程序研究
马 云 王明鑑 贾 臻 罗世芝 王海霞 郭 君 姚广红 王 茸 贾俊涛
(1.山东出入境检验检疫局 山东青岛 266002; 2.山东一品农产集团有限公司; 3.青岛酒店管理职业技术学院)
1 前言
沙门氏菌是最常见的食源性致病菌之一,在世界各地的食物中毒中,沙门氏菌引起的食物中毒常列榜首[1-3]。目前,沙门氏菌检测的基准方法仍是依赖于培养、生化鉴定和血清学的传统方法,由于其耗时费力,不能及时发现生产过程中的问题,因此已不适应生产的需要,迫切需要快速、准确的“可替代方法”(alternative methods)用于食品原料、加工过程以及终产品的实时检测。
可替代方法需与参照方法(基准方法)进行比较,以证明该方法对“预期目标的适用性”,此过程称为“方法验证”(validation of methods)。对于微生物检测可替代方法的验证,国际上有明确的规范,如:ISO 16140:2003/Amd 1:2011《食品和动物饲料微生物学-可替代方法的验证方案》(以下简称“ISO 16140”)和《AOAC国际方法委员会关于食品和环境表面微生物方法的验证指南》等;国内在方法验证方面仅有关于试剂盒评价的行业标准[4,5],未见系统的相关报道。此外,方法验证和实验室认可之间也存在着密切联系[6]。根据实验室认可要求CNAS-CL01《检测和校准实验室能力认可准则》(等同采用ISO/IEC 17025:2005)的规定:实验室应对非标准方法、实验室设计(制定)的方法、超出其预定范围使用的标准方法、扩充和修改过的标准方法进行确认(validation of methods,也即“方法验证”),以证实该方法适用于预期的用途。方法验证与能力验证、参考物质一起并称为质量保证的三大“基石”[6],应当引起实验室检测人员的重视。
方法验证包括“实验室内验证”(即“实验室内方法比较研究”)和“实验室间验证”(即“实验室间协作研究”)两大部分[7]。本研究依据ISO 16140,以赛默科技SureTect沙门氏菌实时PCR检测方法(以下简称“SureTect方法”)为例,对其参照GB 4789.4-2010《食品安全国家标准 食品微生物学检验 沙门氏菌检验》(以下简称“GB 4789.4”)进行了实验室内验证,以期详细介绍沙门氏菌可替代方法实验室内验证的具体程序,并为开展类似实验室内验证工作提供参考程序。本研究以一种沙门氏菌定性检测方法为例进行了实验室内验证,仅仅是开展方法验证工作过程中一次初步的尝试,今后还需在微生物定量检测方法的验证以及实验室间验证方面开展更深入细致的工作。
2 材料与方法
2.1 材料
2.1.1 菌株
包括沙门氏菌30株和干扰菌30株(见表1),主要来自美国模式培养物保藏中心(ATCC)、中国普通微生物菌种保藏管理中心(CGMCC)、中国医学细菌保藏管理中心(CMCC)及本实验室日常检测分离。
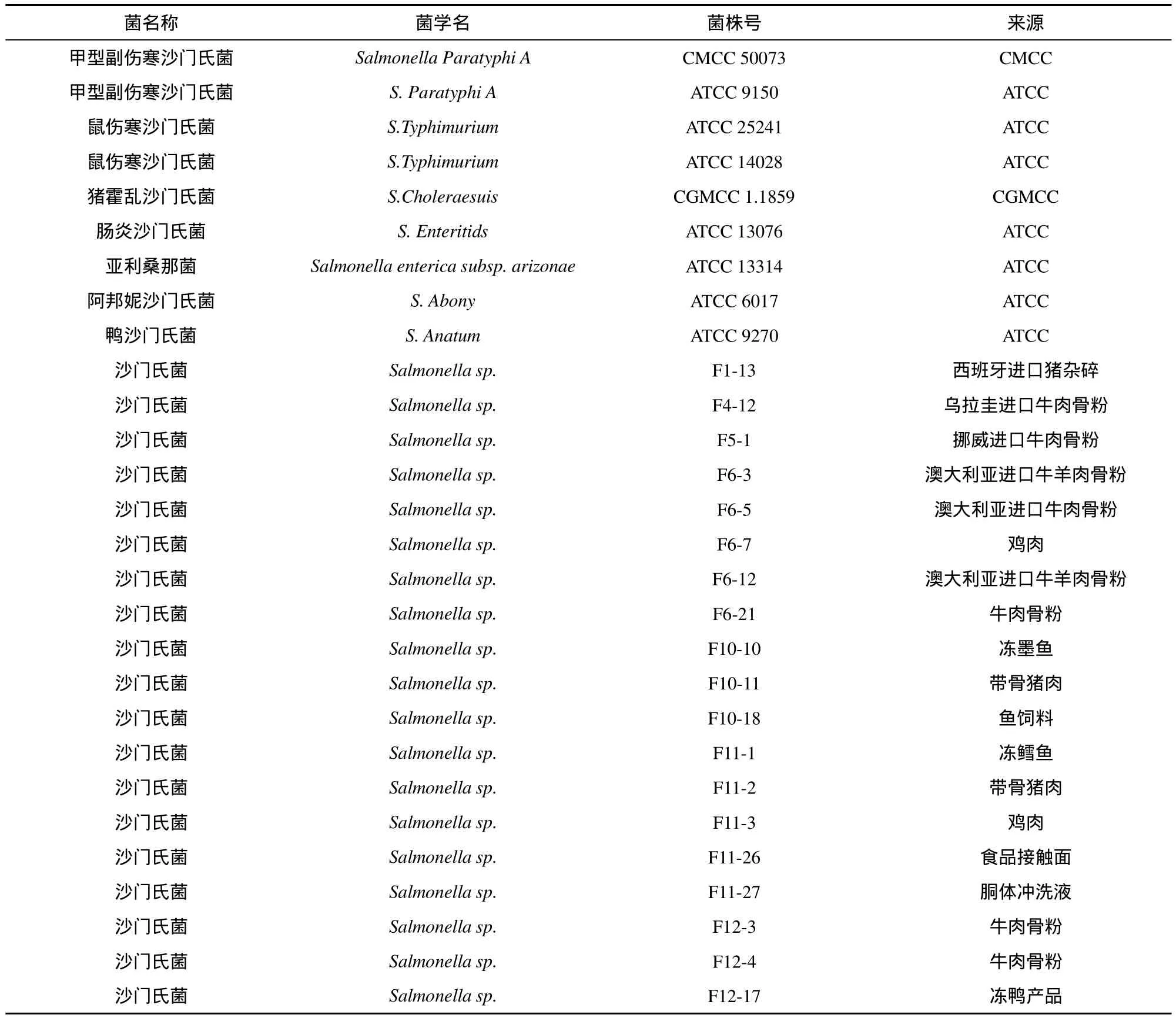
表1 菌株信息表
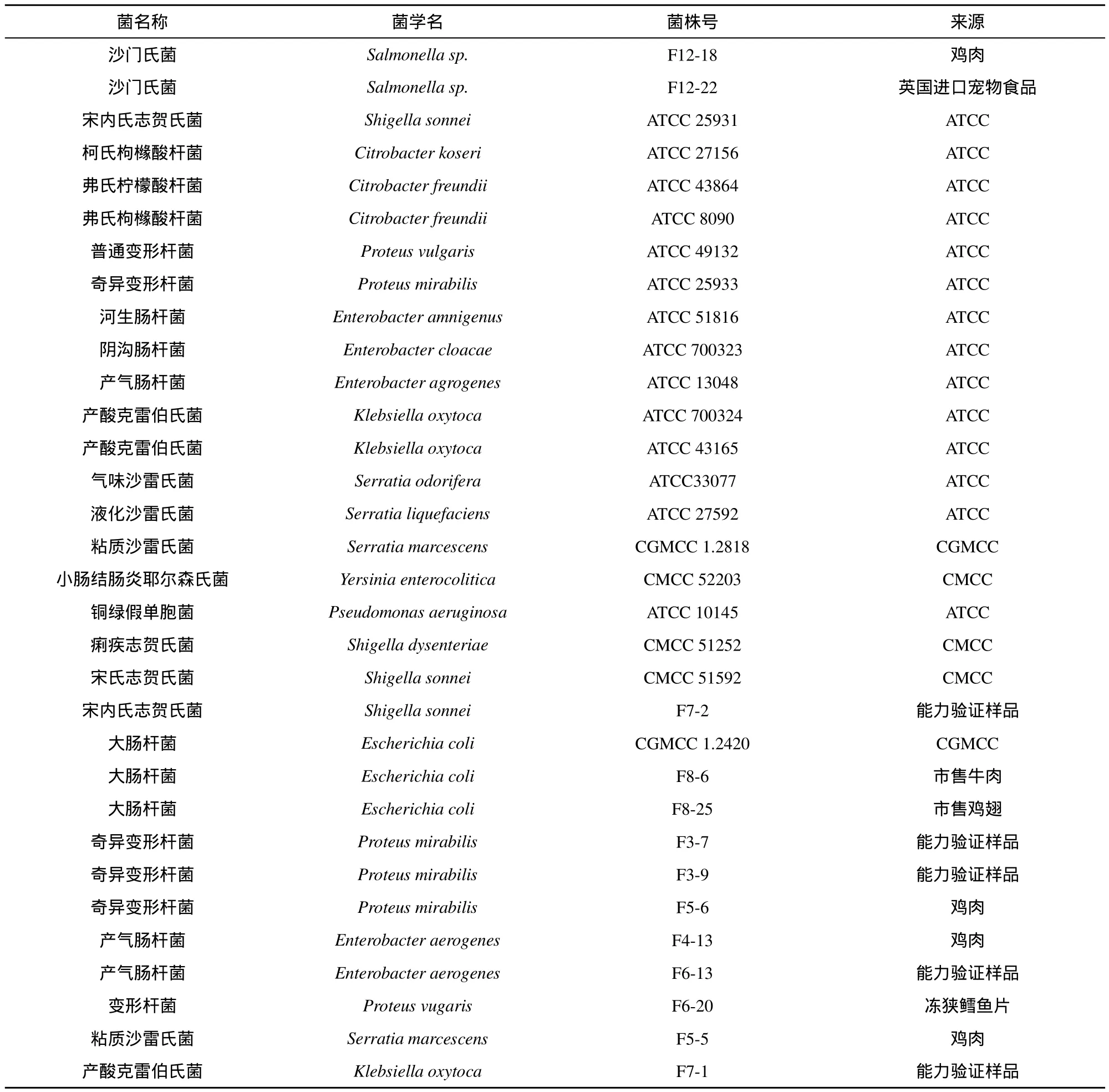
(续表)
2.1.2 主要仪器
生化培养箱(MIR-553):日本三洋公司;实时PCR仪(SureTect):赛默科技;恒温摇床(Excella E25R):美国New Brunswich Scientific。
2.1.3 培养基及试剂
缓冲蛋白胨水(BPW):美国OXOID公司;四硫磺酸钠煌绿(TTB)、亚硒酸盐胱氨酸(SC)增菌液、亚硫酸铋(BS)琼脂、木糖赖氨酸脱氧胆盐(XLD)琼脂、胰酪胨大豆酵母浸膏琼脂(TSA-YE)、三糖铁(TSI)琼脂、赖氨酸脱羧酶琼脂、尿素酶琼脂、沙门氏菌生化鉴定管套装、沙门氏菌O多价血清:北京陆桥技术有限责任公司;菌落总数测试片:美国3M公司;SureTect 沙门氏菌PCR配套试剂盒(包括蛋白酶K、裂解试剂管和PCR管):赛默科技。
2.2 方法
2.2.1 样品基质的制备
根据ISO 16140附表B.1,沙门氏菌可替代方法的验证应选取肉、禽、水产品、果蔬和乳品等五大类食品为样品基质。样品均购自大型购物超市,无菌包装后在0-4℃条件下2h内运回实验室。不同类别的样品在无菌条件下分别混匀,0-4℃冷藏待用。
2.2.2 菌液的制备
所有菌株均取自-80℃冰箱,TSA-YE上37℃活化,挑取单菌落在TSA-YE上纯化;再挑取纯培养后的单菌落接种到10mL的BPW中,120rpm/min摇床培养24h;取1mL菌液加入9mL生理盐水中,依次系列稀释备用,同时用菌落总数测试片计数每个稀释度菌液的浓度。
2.2.3 待验证方法——SureTect方法
样品和BPW按1:9稀释,在均质器上混合均匀,于37℃±1℃培养20h-24h;吸取10μL试剂盒配套蛋白酶K溶液到SureTect裂解试剂管(预装裂解液)中,再加入10μL BPW增菌肉汤,37℃孵育10min后立即于95℃孵育5min;吸取20μL裂解产物至PCR管(预装SureTect冻干PCR试剂)中,复溶冻干试剂;PCR管放入仪器并运行配套软件,约1.5h后从软件上读取结果。
2.2.4 相对准确性、相对特异性和相对灵敏度的测定和比较
相对准确性是指可替代方法和参照方法对同一样品检测获得结果的一致程度,相对灵敏度是指可替代方法能检出参照方法确认的分析物的能力,相对特异性是指可替代方法将参照方法确认的非分析物排除的能力[7]。
这3个指标验证过程如下:肉、禽、水产品、果蔬和乳品各称取60个样品,每个样品25g,分别放于无菌均质袋中。采用人工污染的方式制备样品,严格控制样品的污染水平(大约在0-10CFU/g),干扰菌株的添加水平比阳性菌株高约一个数量级。每个样品添加1mL稀释好的沙门氏菌菌液和1mL干扰菌菌液,混合均匀。采用SureTect方法和GB4789.4同时检测每一个样品。记录所有检测结果,按下列公式[7]计算SureTect方法相对准确性、相对特异性和相对灵敏度:

式中:AC—相对准确性;SP—相对特异性;SE—相对灵敏度;PA—阳性符合(真阳性)的数目;PD—阳性偏差(假阳性)的数目;ND—阴性偏差(假阴性)的数目;NA—阴性符合(真阴性)的数目。
按照ISO 16140 附件F的统计检验方法判断两种方法相对准确性、相对特异性和相对灵敏度的一致性。
2.2.5 相对检测限的测定和比较
混匀的肉、禽、水产品、果蔬和乳品各称取18个样品,每个样品25g,放于无菌均质袋中。每类食品的18个样品平均分成3组,3组分别接种沙门氏菌菌液达到不同污染水平(0、约0.04CFU/g和约0.12CFU/g),每个样品分别用两种方法同时进行检测。
根据菌落总数测试片计数获得的菌液原始浓度换算出后两个水平样品污染菌的浓度;根据3个污染水平的检出情况和3个污染水平的菌浓度报告方法的相对检出限,用Fisher确切概率法[8]检验每一水平上两种方法相对检测限的差异。
2.2.6 包含性和排他性试验
按照ISO 16140附件G的原则选取30株沙门氏菌作为目标菌,同时选取30株近似菌作为干扰菌。所有菌株在试验前需经生化、血清或分子生物学鉴定,每株测试菌株接种到培养基中进行测试。目标菌的接种水平是待验证方法相对检测限的10到100倍,干扰菌的接种水平为预计样品中细菌最大污染水平(确定为约105CFU/g)。当待验证方法对目标菌的测试出现假阴性时,应对该菌重新测试,并同时采用GB 4789.4方法验证;当对干扰菌的测试出现假阳性或可疑时,仅采用被验证方法对该菌重新测试。记录所有检测结果。
3 结果与讨论
3.1 相对准确性、相对特异性和相对灵敏度
可替代方法实验室内验证过程中的相对准确性、相对特异性和相对灵敏度与传统的方法准确性、特异性和灵敏度概念不同。前者是对很低污染水平(检出限附近)的样品检测后与参照方法的检测结果比较后获得,容易出现假阴性的情况;而后者则是对较高污染水平的样品检测后与预期结果(通常不是参照方法获得的结果)比较后获得,通常呈现高度一致(接近100%)。
对于5类人工污染的食品样品,分别采用SureTect方法和GB 4789.4同时进行检测,结果见表2。

表2 SureTect方法的相对准确性、相对特异性和相对灵敏度的计算
表2显示,SureTect方法的相对准确性、相对特异性和相对灵敏度均偏低,最低为75%,需根据ISO16140附件F的检验方法来确定SureTect方法与GB 4789.4是否存在差异。
由表2可得出5类食品都符合6≤Y(Y=PD+ND)≤22的情况,PD和ND中较小的值
都大于ISO 16140附表F.1中的M值,因此可以判定两种方法之间无显著性差异(α<0.05)。
3.2 相对检测限
分别采用SureTect方法和GB 4789.4同时检测3个不同污染水平样品,结果见表3。
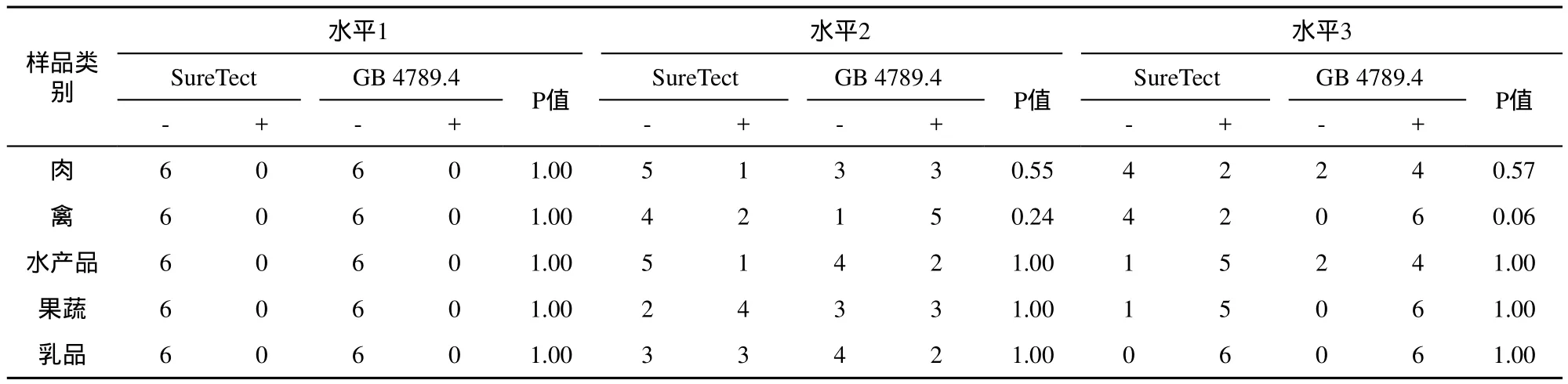
表3 SureTect方法相对检测限的计算
根据接种菌液计数结果推算,水平1接种浓度是0,水平2接种浓度约是0.03CFU/g,水平3接种浓度约是0.10CFU/g。由于水平1结果全部为阴性,不能用于相对检测限,SureTect方法的相对检测限位于水平2和水平3之间(0.03CFU/g-0.10CFU/g),即样品中沙门氏菌达到0.75(0.03×25)CFU-2.5(0.10×25)CFU就可能在BPW中增殖并被SureTect实时PCR方法检出。
表3中所有P值都大于0.05,因此在α=0.05水平,对于所有5类食品类别,两种方法的相对检测限都无显著性差别;5类食品基质对检测限几乎没有影响。
在判断两种方法是否一致的检验过程中,通常设计四格列联表进行X2检验,但是当理论频数小于5或总观测频数小于30时,X2检验不适用,需要采用Fisher确切概率检验法。Fisher确切概率检验计算繁琐,本研究采用MATLAB(R2009b版,美国 Mathworks公司)程序运行M文件自动完成检验。Fisher确切概率法的M文件下载自http://www.mathworks.cn/matlabcentral/fileexchange/5957-fisherextest。为确保该M文件的准确性,该文件经过验证后再用于Fisher确切概率检验。
3.3 包含性和排他性
根据ISO 16140,包含性是指可替代方法从许多菌株中识别出目标分析物的能力,而排他性是指可替代方法对非目标菌株抗干扰的能力。分别采用SureTect方法和GB 4789.4同时检测30株沙门氏菌和30株干扰菌获得该可替代方法的包含性和排他性指标,结果见表4。

表4 SureTect方法的包含性和排他性结果数据表
除了干扰菌中一株小肠结肠炎耶尔森氏菌Yersinia enterocolitica CMCC52203被SureTect方法检测为阳性外,两种方法检测结果均一致。在检测工作中,出现假阴性不可接受,会造成“漏检”;而偶尔出现假阳性可以接受,因其并不影响工作质量,只是增大了检测工作量。因此,即使结果中出现了一次假阳性,SureTect方法的包含性和排他性也可满足检测工作需要。
方法的包含性和排他性与前面提到的方法的准确性、灵敏性和特异性存在着相似性,都是依靠对一定数量的阳性和阴性样品进行检测来判断检测方法的性能,体现的是方法识别目标分析物和排除干扰物的能力。但是,包含性和排他性针对的是纯培养的菌,而准确性、灵敏性和特异性针对的却是污染有特定菌株的检测样品。
3.4 方法验证中的条件选择
3.4.1 沙门氏菌检测方法验证中食品基质的选取
沙门氏菌的方法验证需以人工污染的方式制备样品,制备样品时需接种特定浓度的沙门氏菌到食品基质中。对于不同微生物检测方法的验证,需要选取不同的食品基质。ISO 16140的附表B.1对各类别(categories)食品的不同种类(types)可能污染的微生物指标做出了归纳,方法验证时应针对微生物种类优先选取其对应的食品类别中推荐的种类。例如,对于沙门氏菌方法验证,食品基质应选取(括号外为食品类别,括号内为食品种类):肉(生肉)、禽(生禽)、水产品(生水产品)、果蔬(鲜果蔬、果汁/浓缩汁)、乳品(鲜、冻、发酵和干制乳品)、巧克力/烘焙产品(低水分、干制的)、其他(调味料、蛋黄酱、蛋品)、动物饲料(混合)。只有选取了附表B.1中所有推荐类别和种类,验证的方法才能称其适用于所有食品。本研究选取了前几类进出口量较大的几种食品类别为代表进行验证,验证结果适用于大多数食品类别。此外,对于每一类食品类别,必须达到60个样品才能用于相对准确性、相对特异性和相对灵敏度的分析[7]。
3.4.2 沙门氏菌检测方法验证用菌株的选取
用于方法验证的沙门氏菌应尽可能选取来源于不同菌种保藏机构、不同地域、不同食品基质的不同血清型菌株。多样的沙门氏菌菌株可以保证验证的广泛性。干扰菌株主要包括与沙门氏菌相近的、有较强干扰性的菌株,如志贺氏菌等肠杆菌科细菌和肠杆菌科之外的细菌。在包含性和排他性的验证试验中,对于沙门氏菌检测方法应至少选取30株目标纯培养物;而对于其他菌的检测方法,应至少选取50株目标纯培养物[7]。
3.4.3 食品基质污染水平的控制
方法验证过程中,样品基质的污染水平受到严格控制。对于相对准确性、相对特异性和相对灵敏度的测定,污染水平大约控制在0-10CFU/g[7],其目的是为了确保预期大约一半的样品出现阳性结果;如果全部出现阳性结果或者全部出现阴性结果,这些指标将会为0或100%,表明验证失败。对于相对检测限的测定,污染水平应控制达到如下程度:第一个水平是阴性对照(不接种沙门氏菌);第二个水平是理论上的检测限(约0.04CFU/g,即25g样品中存在1CFU);第三个水平略高于理论检测限(定为3倍的理论检测限,约0.12CFU/g)[7]。对于方法的包含性和排他性试验,目标菌的接种水平最高,确定为待验证方法相对检测限的10到100倍[7]。
3.4.4 可替代方法和参照方法步骤不同时的选择
ISO 16140中规定:“对同一样品采用可替代方法和参照方法同时检测”。对于两种方法的第一步增菌液相同时,这一规定可以满足。本研究中,两种方法第一步使用的增菌液都是BPW,可以从同一份BPW分别吸取一定体积的增菌液进行后续分析。然而对于有的检测项目,第一步使用的增菌液不一致,就无法直接用两种方法同时检测同一个样品。ISO 16140附件D.2给出了解决办法:对于液体样品,取2倍检测用量(例如,50mL)彻底均质后等分成2份再分别按两种方法的后续检测步骤继续检测;而对于非液体样品,则称取2倍质量的样品(例如,50g)加入等量稀释液(例如,50mL)彻底混匀,然后等分成2份,分别加入两种不同的增菌液(注意保持正确的增菌液比例),再分别按两种方法的后续检测步骤继续检测。
4 结论
依据ISO 16140,以SureTect沙门氏菌实时PCR检测方法为例,将其与沙门氏菌国家标准检测方法进行了实验室内验证,两种方法在相对准确性、相对特异性、相对灵敏度和相对检测限等指标上无显著性差异,包含性和排他性也基本一致。本研究详细展示了沙门氏菌可替代方法实验室内验证的具体程序并对验证程序中关键点进行了探讨,对于今后类似验证工作的开展提供了参考。
[1]王章云,腾焕昭,李柏桂,等.肠炎沙门氏菌引起的食物中毒细菌学调查[J].中国人兽共患病杂志,1999,9 (3) :115-117.
[2]马立农,刘华伟,张春柳,等.食品沙门氏菌PCR快速检测试剂盒简介[J].深圳职业技术学院学报,2005,4 (2) :95-96.
[3]张河战,辜清吾.沙门氏菌的分类、命名及中国沙门氏菌菌型分布[J].微生物学免疫学进展,2002,30 (2) :74-76.
[4]SNT 2775-2011 商品化食品检测试剂盒评价方法[S].
[5]SN/T 2435-2010 出入境动物检疫诊断试剂盒质量评价规程[S].
[6]Lombard B,Leclercq A.Validation of innovative food microbiological methods according to the EN ISO 16140 standard[J].Food Analytical Methods,2011,4:163-172.
[7]ISO 16140:2003/Amd:2011 Microbiology of food and animal feeding stuffs-Protocol for the validation of alternative method[S].
[8]Hubaux A,Vos G.Decision and detection limits for linear calibration curves[J].Analytical Chemistry,1970,42(8):849-855.

