不同水生植物抑藻效果及机理研究
苏跃龙,王正芳
(1.云龙县环境监测站,云南云龙672700;2.复旦大学环境科学与工程系,上海200433)
不同水生植物抑藻效果及机理研究
苏跃龙1,王正芳2
(1.云龙县环境监测站,云南云龙672700;2.复旦大学环境科学与工程系,上海200433)
对水芹、美人蕉、黄菖蒲、菹草4种水生植物对铜绿微囊藻的化感特征进行了研究。不同的植物组织器官及不同的植物处理方式下,抑藻效果不同,最具抑藻潜力的植物为黄菖蒲和美人蕉。经黄菖蒲和美人蕉种植水培养5d后,铜绿微囊藻的抑制率达70.12%~77.25%。质量分数为0.53%的黄菖蒲叶提取物,经11d的培养后,对铜绿微囊藻的抑制率为65.30%。抑藻机理可能在于化感物质的胁迫使微囊藻细胞内活性氧自由基过量堆积,进而引起对藻细胞的伤害和影响藻类正常的光合作用。SOD酶活性与藻的比增长率均呈现较好的负相关关系。
水生植物;铜绿微囊藻;超氧化物歧化酶;抑藻;化感作用
植物化感抑藻为富营养化湖泊水体蓝藻的治理提供了新的途径。大部分化感物质是植物生长中产生的次生代谢物质,在环境中不易造成危害与污染,较易于降解,具有很好的生态安全性[1]。越来越多的研究表明[2,3],植物化感抑藻是可以替代物理、化学治理的安全有效的方法。目前,陆生植物化感作用的研究进行得较为深入,大麦秸秆[4]、灌木[5]、稻壳[6]、柑橘皮、香蕉皮[7]等都表现出较好的抑藻效果。
水生植物的化感作用虽与陆生植物类似,但其在化感特征、作用方式等方面存在一些差别:水生植物的代谢产物更为复杂,化感物质在水体环境中更易稀释、扩散,抑藻效果受水体中化感物质浓度影响较大[8]。胡光济等人[9]研究了水生植物菖蒲的干体提取液对铜绿微囊藻生长的影响,结果表明,菖蒲干体提取液中含有抑藻活性的化感物质,高浓度的提取液(>40ml/L)对铜绿微囊藻的抑制率高达98.66%;而低浓度的提取液(<30ml/L)对藻的生长并无显著影响。Wu等人[10]从浮萍中成功提取出化感物质,当化感物质浓度为60mg/L时,抑藻率为50%,藻细胞内的叶绿素a含量减少50%;当化感物浓度提高到100mg/L时,抑藻率可达90%,藻细胞内的叶绿素a含量可减少75%。
水生植物释放的化感物质降解速率较快,在非连续分泌情况下只能对浮游藻类产生短期的抑制作用[11,12]。因此,在天然浅水湖泊中,化感物质连续释入环境,在水体中维持一定浓度才可发挥有效的抑藻作用。不同植物产生的化感抑藻化合物的种类和数量都可能不同,即便是同一植物在不同的培养体系中产生的相同化感物质其抑藻能力也可能存在很大差异,在同一植物体内不同组织、器官化感化合物的量也会不同,植物产生和分泌化感物质的差异,可能对其抑藻能力产生较大影响。
化感物质抑藻途径可能有以下几种:① 破坏叶绿素。有些化感物质通过破坏藻类的叶绿素,影响其光合作用,从而抑制藻类的生长。②破坏细胞膜。化感物质能降低细胞膜的完整性,使细胞内物质大量渗出,渗出液的电导率增加。③影响酶活性。化感物质能影响生物体的酶活性,由于酶的特性不同,化感物质能提高某些酶的活性,却能抑制另一些酶的活性。
本文以富营养化水体为对象,选取水芹、美人蕉、黄菖蒲、菹草4种水生植物,通过人工模拟自然条件的方法,一方面,通过研究各植物对氮磷离子吸收浓度动力学差异,研究植物根、茎、叶各器官中氮磷的分布特征,分别从基质相、植物相、水相中氮磷营养物质含量及浓度的变化来探讨不同水生植物系统中氮磷在水相、基质相、植物相中的富集与转移效果,确定各相作用对氮磷去除的贡献率,并判别氮磷去除率与植物根系基质酶的相互关系。另一方面,开展不同水生植物、不同植物组织器官及化感物质的不同提取方式对铜绿微囊藻的化感作用研究,考察其抑藻特性,确定其生长拐点时间及受损机制。结合氮磷削减及抑藻潜力对各水生植物进行综合评价,以期为利用水生植物抑制藻类生长、削减富营养化水体中氮磷、创造稳定优美的水生生态环境提供一定的理论依据。
1 材料与方法
1.1 植物材料
选择4种水生植物:水芹(Oenanthe javanica)、黄菖蒲(Iris pseudacorus L)、美人蕉(Canna lily)、菹草(Potamogeton crispus)。在试验前将植物用去离子水冲洗干净,转入0.2mmol/L的CaSO4溶液中,饥饿培养24h后待用。
1.2 化学试剂
试验所用CaSO4、Ca(ClO)2等化学试剂均为市售分析纯试剂。
1.3 实验方法
1.3.1 藻的培养
将铜绿微囊藻(Microcystis aeruginosa,FACHB-905)移入灭菌后的2L培养基中扩培,培养条件为:25℃,光照:12h,光强度2000 lux,记录其生长曲线,取处于对数末期的藻液开展以下抑藻试验。培养期间每日摇匀2次。
1.3.2 植物提取物抑藻试验
将叶片用自来水水洗,去除附着的泥沙等杂质后,用蒸馏水冲洗2~3遍。之后置于滤纸上,室温干燥10min。新鲜叶片剪成<5mm×5mm大小,用四分法取出10g。混匀后,10g叶片混合物置于100m l蒸馏水中,水浴加热2h。冷却后,经玻璃纤维滤纸(Whatman GF/C)过滤,将滤液定容至100ml,此时提取物浓度为10g/100ml=10%[4]。根茎提取物制备方法与叶片组织相同。将8ml植物提取物添加到BG-11培养基中,定容为150ml,使植物提取物体积分数(V∶V)=5.3%,此时锥形瓶中有相当于0.8 g植物组织的提取物,即植物提取物质量分数 (m∶V) =0.53%。将锥形瓶置于高压灭菌锅中灭菌30min,待降至常温后,将已培养好的藻液离心 (6000 rpm,10℃,4 min),接种,藻密度控制为3.0× 106cells/ml。另外,设不加植物提取物的藻密度为3.0×106cells/ml的锥形瓶作为空白。培养条件:25℃,光照:12h,光强度2000lux。培养期间每日摇匀2次。
1.3.3 植物组织抑藻试验
将叶片用自来水水洗,去除附着的泥沙等杂质后,用蒸馏水冲洗2~3遍。之后置于滤纸上,室温干燥10min。称取5 g新鲜叶片剪成5mm×5mm,在10%Ca(ClO)2溶液中泡15min,蒸馏水水洗4次。水洗后沥干水分,在滤纸上室温干燥10min。根茎组织制备方法与叶片组织相同。将0.8g植物组织添加到BG-11培养基中,定容为150ml,使植物组织质量分数(m∶V)=0.53%[13]。后续步骤同上。
1.3.4 种植水抑藻试验
水生植物种植35d后,取其种植水先用中速滤纸抽滤一遍,后经0.45μm微孔滤膜减压过滤,滤掉可能带入的原生动物及微生物等。过滤装置为真空抽滤器及砂芯过滤装置。取100ml种植水,加入已灭菌并装有50 m培养基的三角瓶中,再接种藻类,使起始藻密度为3.0×106cells/ml,对照用同样经过真空过滤的自来水100ml,代替种植水。在培养过程中,用封口膜封住锥形瓶瓶口,每天定时摇动2次。
1.3.5 藻细胞超氧化物歧化酶的测定
按照GB/T5009.171-2003中邻苯三酚自氧化的方法测定酶活力。
1.3.6 藻生物量的测定
以藻密度表示(cell/m l),取少量混合均匀的藻液,加入一滴卢哥氏液固定后,用滴管在藻液中部吸取少量藻液,缓慢滴入血细胞计数板 (事先将盖玻片盖好),用吸水纸吸去多余液体,在显微镜下用血球计数板对细胞数量计数2次,若2次相差超过20%则进行第3次。
1.4 计算方法
1.4.1 藻抑制率及生长参数的确定
抑制率公式:IR=(1-Nt/Mt)×100%
式中:IR—抑制率,Nt—处理组第t天藻细胞密度值,Mt—对照组第t天藻细胞密度值。
以Logistic方程拟合藻类的增长过程。以每个处理组的最大生物量 (Nm)作为各自K的估计值。应用其对数形式Ln[(K-Nt)/Nt]=a-rt,以最小二乘法进行回归分析,获得该方程的斜率和截距作为a和r的估计值。藻类的生长拐点即为Logistic方程的二阶导数等于0的时间,由公式tp=(a-ln2)/r来计算。
1.4.2 铜绿微囊藻比增长速率μ的计算

式中:μ-比增长速率 (d-1),B2-某一时间间隔终结时藻类的生物量(cell/ml),B1-某一时间藻类的生物量(cell/ml),t2-t1-时间间隔(d)。
1.4.3 最大生物量Nmax的确定
从接种当天起,隔天取样计数铜绿微囊藻的个数,当藻类增长<5%时,取其藻量作为最大生物量(×106cell/ml),用每毫升藻液中所含的藻细胞个数表示。
2 结果与讨论
2.1 不同植物根茎叶的抑藻效果
图1为不同植物根的抑藻效果,与对照相比,水芹、黄菖蒲、美人蕉的根组织器官及其提取物组中藻的生长均受到不同程度的抑制。总体上看来,前5 d抑藻效果不明显,第5d,对照组藻密度为1.03×107cell/ml,其他各组的藻密度为9.61×106~1.10×107cell/ml,抑藻率在-6.77%~6.77%波动;5d后各组藻类生长趋势开始有了明显不同。组织器官组中,黄菖蒲根抑藻效果最好,第11d生物量降为1.33×107cell/ml,与对照组生物量2.76× 107cell/ml相比,其抑制率为51.81%;水芹组及美人蕉组抑藻效果较差,试验结束时抑藻率仅为4.00%、9.73%。与组织器官组相比,水芹及美人蕉根提取物组表现为更好的抑藻效果,第11d时,抑制率分别为33.10%、20.68%;黄菖蒲根提取物组表现较差,试验结束时,其抑藻率仅为16.43%,低于黄菖蒲根组织组。

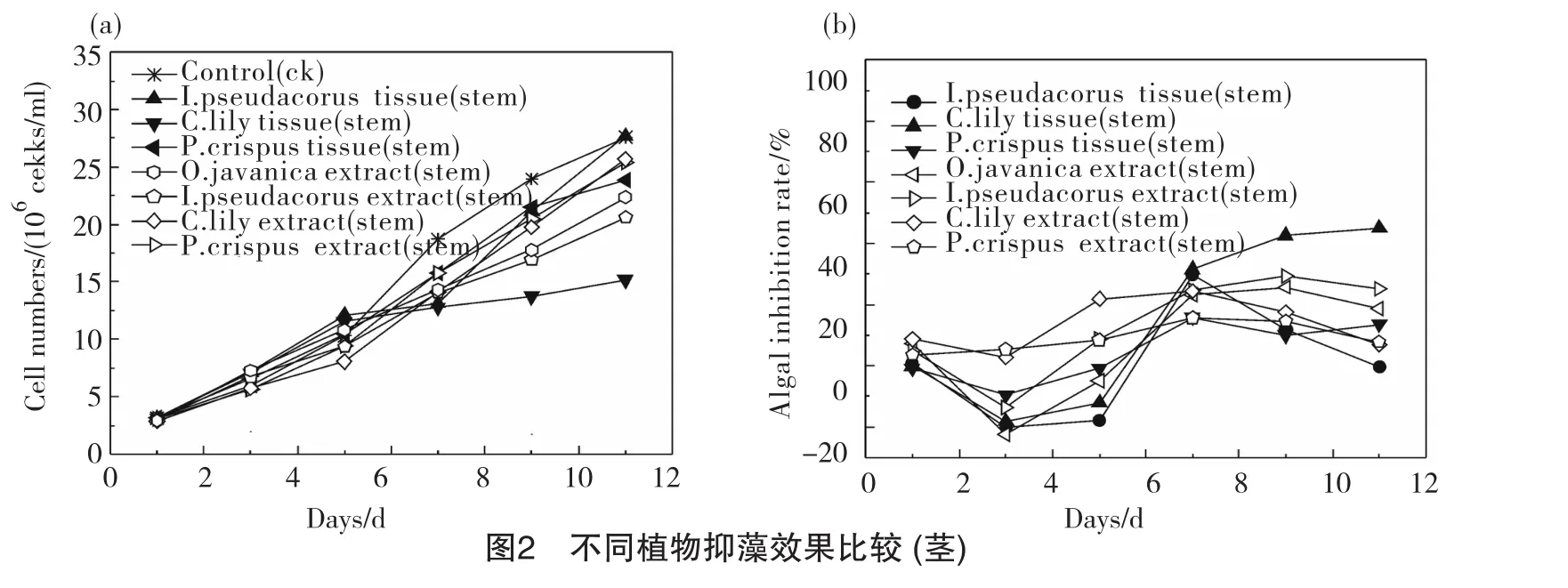
从图2可以看出,茎组织器官组中抑藻效果最为明显的是美人蕉茎组,其生物量从第5d后,缓慢增加,不再呈对数式增长,试验结束时,其生物量为1.52×107cell/ml,与对照组2.76×107cell/ml相比抑制率为44.95%;菹草茎组抑藻效果次之,11d时,其抑制率为13.48%;黄菖蒲茎组表现最差。组织提取物组中,美人蕉及菹草组在0~11d均表现出抑藻效果,抑制率变化较为平稳,但值较低,在2.66%~24.47%内波动;水芹及黄菖蒲组在7d后才开始有抑藻效果,抑藻率保持在18.80%~29.33%。
从图3可以看出,植物叶组织提取物抑藻比叶组织更具优势,水芹、黄菖蒲、美人蕉、菹草4组的叶提取物对藻的抑制效果均好于叶组织组,特别是美人蕉叶提取物组,从试验开始到结束,生物量均保持较低水平,11d时其生物量为6.75×106cell/ml,仅为对照组的1/4;水芹叶提取物组对藻的抑制率随着时间的增加而增大,呈稳定上升趋势,3d、7d、11d时的抑制率分别为12.52%、 24.47%、56.96%;黄菖蒲叶提取物从第5d开始表现出抑藻效果,试验结束时抑制率达到65.30%;相比之下,菹草叶提取物抑藻效果一般,抑制率为32.28%。植物叶组织组中,各植物叶组织对藻的抑制率从大到小依次为:黄菖蒲(31.71%)>水芹(15.86%)>菹草(8.09%)>美人蕉(-30.89%)。
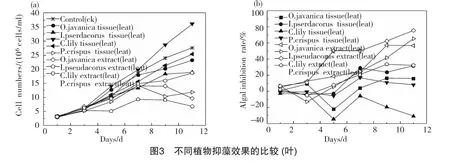
在水生植物化感抑藻技术领域中,化感作用是一种重要的化学生态防御机制,是植物代谢活动对藻类所产生的不利作用[14]。植物与周围的生物群落以次生代谢物质为媒介建立了稳固的化学作用关系,它们通过茎叶挥发、茎叶淋溶、根系分泌以及植物残株的腐解等途径向水体中释放化感物质,来影响水体中藻类的生长[15]。研究和掌握这种化学作用规律,对认识植物群落结构、演替并合理开发和利用,实现藻类的有效控制,减少生态系统修复对化学药剂的依赖具有重要意义。通过上述分析,可以发现,植物组织及组织提取物的抑藻效果大不相同,同一种植物的相同器官在不同的处理方式下及同一处理方式下的不同植物,抑藻效果都有着强烈的反差,比如,黄菖蒲根组织对藻的抑制率为51.81%,提取物却仅为16.43%;美人蕉叶提取物对藻的抑制率高达75.52%,叶组织不仅对藻没有抑制效果反而促进了藻的生长。一般认为,水生植物的化感抑藻作用是多种化学物质混合作用的结果,以上试验结果的差异性可以归结为不同植物、不同植物器官中以及不同处理方式下导致抑藻效应的化学物质种类及含量的不同[1,16,17]。因此,只有掌握了不同植物类型及处理方式下的抑藻潜力,才能在水体富营养化植物修复或水华生物控制工程中实现有效控藻。
2.2 累积效应分析
以上水生植物各器官的抑藻效果,在植株有机整体中最终以经各种途径释放到水体中化感物质的累积效应表现出来。分别取4种植物35d的种植水进行抑藻试验,结果如图4所示。从图中可看出,黄菖蒲及美人蕉种植水的抑藻效果非常好,生物量从第3d开始明显下降且保持较低水平,抑制率在第5d分别已经达到77.25%和70.12%。水芹抑藻效果次之,试验结束时,其对藻的抑制率为40.02%。菹草抑藻效果最差,该组藻生物量与对照组类似,呈指数增长模式;其抑制率随着时间的增长先增大后减小,最高可达51.94%,出现在第7d,试验结束时抑制率最低为15.05%。水生植物能连续释放某些化感物质抑制藻类的生长,但这些物质的理化性质不稳定,在天然水体中容易被微生物所利用。当化感物质达到一定量时才表现为有效的抑藻效应,因此,水生植物的化感抑藻作用表现出明显的累积性[18,19]。从以上结果可以看出,黄菖蒲、美人蕉种植水抑藻效果较为明显,而水芹、菹草种植水抑藻效果较差,这说明同一种植条件下,相同时间范围内,黄菖蒲、美人蕉两种植物体系中有效化感物质的累积效应要明显大于水芹及菹草。

2.3 不同植物抑藻特征分析
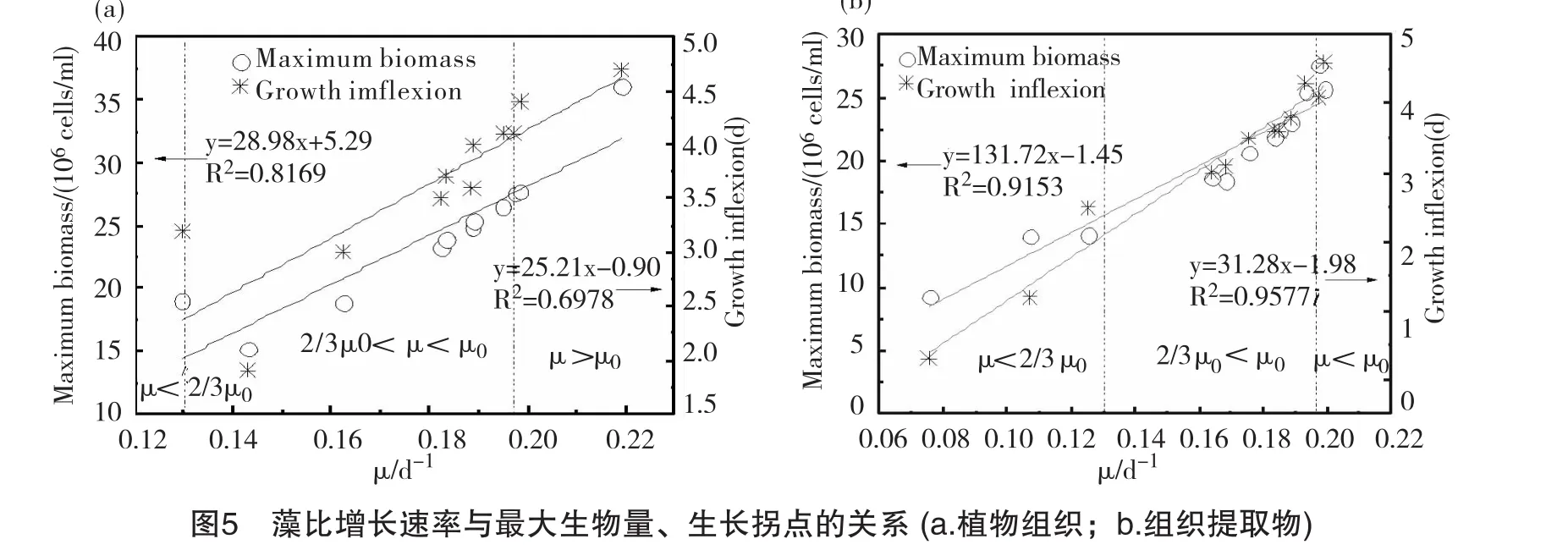
对藻生物量、增长率及生长拐点的把握对于藻的抑制有着一定的指示意义,本研究采用Logistic方程,以每个处理组的最大生物量(Nm)作为各自K的估计值,以ln[(K-Nt)/Nt]为y,时间t为x,以最小二乘法进行回归分析,获得该方程的斜率和截距作为a和r的估计值。藻类的生长拐点即为Logistic方程的二阶导数等于0的时间,由公式tp=(a-ln2)/r计算得出。各植物组织及组织提取物化感作用下铜绿微囊藻的logistic方程参数、判定系数及拐点时间见表1和表2。

表1 培养条件下铜绿微囊藻的logistic方程参数、判定系数及拐点时间(植物组织)

表2 培养条件下铜绿微囊藻的logistic方程参数、拐点出现时间(组织提取物)
为了清晰地比较藻最大生物量、生长拐点及比增长率的关系,对以上K、tp参数及藻比增长率μ作图,如图5。从图中可以看出,藻最大生物量及生长拐点时间与藻的比增长率有着较好的相关性,组织提取物组相关性较好,K与μ,tp与μ的线性拟合系数分别为0.9153、0.9577;相比之下,组织器官组相关性较差,从图上可以看出,在比增长率为0.13/d时,藻最大生物量及生长拐点偏离拟合直线较远。总体而言,较好的抑藻作用表现为比增长速率低、生物量小、生长拐点时间早。以对照组生长速率μ0为参照标准,将试验范围内藻的生长参数按μ>μ0,μ0>μ>2/3μ0以及μ<2/3μ0划分为3个区间,表示化感抑藻程度,判断各组试验的抑藻潜力。处于μ<2/3μ0区间的表现为抑藻效果最佳,也说明其对应的植物组织及组织提取物最具抑藻潜力,顺序分别为美人蕉叶提取物组>黄菖蒲叶提取物组>水芹叶提取物组>美人蕉茎组;其中提取物组生长拐点为0.3~2.5d,组织器官组为3.2d;处于μ0>μ>2/3μ0区间的抑藻效果次之,67%的试验组处于这一区间;其中提取物组生长拐点为3.5~4.1d,组织器官组为1.9~4.1d;μ>μ0的为无抑藻效果,组织器官组与植物提取物组的生长拐点均>4.4d。从以上分析可以看出,组织提取物比植物组织组抑藻效果更好;另外,与根、茎器官相比,挺水植物叶的提取物更具抑藻潜力。
2.4 铜绿微囊藻化感受损机制
近几年,“生物活性氧伤害”理论[20]在植物化感抑藻领域应用较为广泛,一般认为,在正常的生理情况下,藻细胞中活性氧不断产生的同时,也被不断地清除,因而产生的自由基不会造成对藻细胞的损伤;但一旦当藻细胞处于胁迫条件下,自由基的产生与清除失去平衡,活性氧含量会显著增加。过量的氧自由基破坏脂体、蛋白、DNA灯,导致细胞内抗氧化剂的减少,酶活性受到不同程度的影响[21]。在微囊藻细胞中,抗氧化酶主要包括超氧化物歧化酶(Superoxide Dismutase,SOD)、过氧化氢酶(Catalase,CAT)、过氧化物酶(Peroxidase,POD)等,其中SOD酶起主要作用;另外,SOD酶与CAT、POD酶的酶活性表达方式存在差异,正常生长的藻细胞,SOD酶活性较高,容易测定,而CAT、POD酶活性则相对较弱,因此本研究采用SOD酶为主要测试指标,研究铜绿微囊藻的化感受损机制。
图6为植物组织及提取物对铜绿微囊藻SOD酶活性的影响趋势。从图中可以看出,对照组的SOD酶活性前期一直保持较低水平,说明对照组的藻类生长状况良好,没有受到外界条件的胁迫;到试验结束时 (11d),对照组由于生物量的巨增导致遮光效应明显,使得藻类所受环境胁迫增强,SOD酶略有升高(1.14U10-6/cells),但依旧低于其他大部分试验组。水芹、黄菖蒲、美人蕉及菹草4种植物的组织器官及组织提取物对藻的化感作用不同,因此在藻SOD酶活性大小上表现为较大差异,且随着作用时间的变化呈现不同的变化趋势。至试验结束时,植物组织组中SOD酶活性最大的是黄菖蒲根组,其SOD值为2.27 U 10-6/cells;最小的是美人蕉叶组,其SOD值为0.77 U 10-6/cells。提取物组中SOD酶活性最大的是美人蕉叶组,其SOD值为4.30 U10-6/cells;最小的是美人蕉根组,其SOD值为0.95 U 10-6/cells。
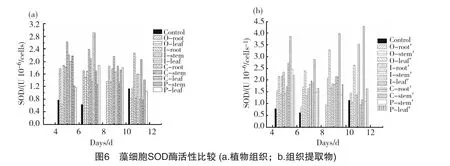
藻细胞超氧化物歧化酶 (SOD)在生物体清除超氧化物阴离子自由基 ()过程中起着重要作用,是细胞抗衡胁迫的主要保护酶[22]。在抑藻试验体系中,SOD酶的增大是微囊藻在生长环境中受到了培养基中化感物质胁迫时的应激反应;当增大到某一值时,SOD酶活性有下降趋势,可能是SOD酶不能与O2·-在更高的水平上建立新的平衡,表明此时藻细胞已经受到了较大程度的损伤[23]。将试验结束时各组中SOD酶活性与藻比增长率进行比较分析,从图7可以发现,在植物组织及组织提取物组,SOD酶活性与藻的比增长率均呈现较好的负相关关系,即藻细胞内SOD酶活性较大时,比增长率较低;反之较高。

3 结论
不同植物种植水对铜绿微囊藻的生长抑制影响差异很大,主要是因为种植系统中化感物质的积累效应不同,抑藻效果顺序为美人蕉、黄菖蒲>水芹>菹草。不同的植物组织器官及不同的植物处理方式下,抑藻效果不同,最具抑藻潜力的几组为美人蕉叶提取物组>黄菖蒲叶提取物组>水芹叶提取物组>美人蕉茎组,具体表现为比藻增长速率低、生物量小、生长拐点时间早。抑藻机理可能在于化感物质的胁迫使微囊藻细胞内活性氧自由基过量堆积,进而引起对藻细胞的伤害和影响藻类正常的光合作用;SOD酶活性与藻的比增长率均呈现较好的负相关关系,即藻细胞内SOD酶活性较大时,比增长率较低,反之较高。
[1]DaiW,Zhang S L,Lin Y J,et al.Allelopathic Effects of Berberine,a Plant Alkaloid,on the Algae,Microcystis aeruginosa(FACHB-905),at Different Initial Densities[J].Israeli Journal of Aquaculture-Bamidgeh,2013,(65):1-5.
[2]Ferrier M D,Butler B R,Terlizzi D E,et al.The effects of barley straw(Hordeum vulgare)on the growth of freshwater algae[J]. Bioresource Technology,2005,96(16):1788-1795.
[3]Xiao X,Chen Y-x,Liang X-q,et al.Effects of Tibetan hulless barley on bloom-forming cyanobacterium(Microcystis aeruginosa)measured by different physiological and morphologic parameters[J].Chemosphere,2010,81(9):1118-1123.
[4]Ball A S,Williams M,Vincent D,et al.Algal growth control by a barley straw extract[J].Bioresource Technology,2001,77(2):177-181.
[5]Park M H,Hwang SJ,Ahn C Y,etal.Screening of seventeen oak extracts for the growth inhibition of the cyanobacterium Microcystis aeruginosa Kutz.em.Elenkin[J].Bulletin of Environmental Contamination and Toxicology,2006,77(1):9-14.
[6]Park M-H,Kim B-H,Chung I-M,et al.Selective Bactericidal Potential of Rice(Oryza sativa L.var.japonica)Hull Extracton Microcystis Strains in Comparison with Green Algae and Zooplankton[J].Bulletin of Environmental Contamination and Toxicology,2009,83(1):97-101.
[7]Chen JZ,Liu Z L,Ren G J,etal.Control ofMicrocystisaeruginosa TH01109 with batangas mandarin skin and dwarf banana peel[J].Water Sa,2004,30(2):279-282.
[8]Chen J,Zhang H,Han Z,et al.The influence of aquatic macrophytes on Microcystis aeruginosa growth[J].Ecological Engineering,2012,(42):130-133.
[9]胡光济,张维昊,尚吟竹,等.菖蒲干体提取液对两种水华藻类生长的影响[J].应用生态学报,2009,(9):2277-2282.
[10]Wu X,Wu H,Chen J,et al.Effects of allelochemical extracted from water lettuce(Pistia stratiotes Linn.)on the growth,microcystin production and release ofMicrocystis aeruginosa[J].Environmental Science and Pollution Research,2013,20(11):8192-8201.
[11]Chang X,Eigemann F,and Hilt S.Domacrophytes supportharmful cyanobacteria Interactions with a green alga reverse the inhibiting effectsofmacrophyteallelochemicalson Microcystisaeruginosa[J].Harmful Algae,2012,(19):76-84.
[12]Mulderij G,MooijW M,Smolders A JP,etal.Allelopathic inhibition of phytoplankton by exudates from Stratiotes aloides[J].A-quatic Botany,2005,82(4):284-296.
[13]Chen J,Zhang H,Han Z,et al.The influence of aquatic macrophytes on Microcystis aeruginosa growth[J].Ecological Engineering,2012,(42):130-133.
[14]Nakai S,HosomiM.Allelopathic inhibitory effectsof polyphenols released by Myriophyllum spicatum on algal growth[J].Allelopathy Journal,2002,10(2):123-131.
[15]Nakai S,Zou G,Okuda T,etal.Anti-cyanobacterialallelopathic effectsof plants used for artificial floating islands[J].Allelopathy Journal,2010,26(1):113-121.
[16]Huang Y,Bai Y,Wang Y,et al.Allelopathic effects of the extracts from an invasive species Solidago canadensis L.on Microcystis aeruginosa[J].Letters in Applied Microbiology,2013,57(5):451-458.
[17]Zhang T T,He M,Wu A P,et al.Allelopathic effects of submerged macrophyte Chara vulgaris on toxic Microcystis aeruginosa[J].Allelopathy Journal,2009,23(2):391-401.
[18]Wu Z B,Gao Y N,Wang J,etal.Allelopathic effects of phenolic compounds present in submerged macrophytes on Microcystis aeruginosa[J].Allelopathy Journal,2009,23(2):403-410.
[19]Wang H Q,Cheng SP,Zhang SH,etal.Chemical Composition in Aqueous Extracts of Potamogeton malaianus and Potamogeton maackianus and their Allelopathic Effects on Microcystis aeruginosa[J].Polish Journal of Environmental Studies,2010,19(1):213-218.
[20]Mccord JM F I.Superoxide Dismutase-An Enzymic Function for Erythrocuprein(Hemocuprein)[J].JBiol chem,1969,(244):6049.
[21]Collen J,Davison IR.Reactive oxygen production and damage in intertidal Fucus spp.(Phaeophyceae)[J].Journal of Phycology,1999,35(1):54-61.
[22]Zhang S,Zhang B,DaiW,et al.Oxidative damage and antioxidant responses in Microcystisaeruginosa exposed to the allelochemical berberine isolated from golden thread[J].Journal of Plant Physiology,2011,168(7):639-643.
[23]Liu Y,Li F,Huang Q X.Allelopathic effects of gallic acid from Aegiceras corniculatum on Cyclotella caspia[J].Journal of Environmental Sciences-China,2013,25(4):776-784.
Research of Effects and M echanism on Algae Control by Different Aquatic M acrophytes
SU Yue-long1,WANG Zheng-fang2
(Yunlong Environmental Monitoring Station,Yunlong Yunnan 672700 China)
The allelopathic effects of four aquatic macrophytes(Iris pseudacorus,Canna indica,OenantheJavanica,and Potamogeton)on the growth of Microcystis aeruginosa were investigated.The allelopathic effectswere different by different organs and various pretreatment.Iris pseudacorus and Canna indica were found to have themost potentialities of controlling algae.The water after culturing Iris pseudacorus and Canna indica were used to culture algae.The inhibition rate of algae could reach 70.12%to 77.25%five days later.The liquid extracted from the leaves of Irispseudacorus with 0.53 percentage ofmass fraction was applied to culture algae for11 days.The inhibition rate was 65.30%.The allelopathic mechanism could be explained by the stress fromthe allelopathic materials that damaged and hindered the photosynthesis of algae through improving the accumulation of active oxygen radicals in the cells of algae.In addition,the activity of superoxide dismutase(SOD)showed a good negative correlation with the growth of Microcystis aeruginosa.
aquatic macrophyte;microcystis aeruginosa;superoxide dismutase;algae control;allelopathy
X17
A
1673-9655(2014)06-0015-08
2014-08-20

