人工湿地中反硝化细菌的筛选及鉴定
武孔焕,聂菊芬,王志芸,贺能琴
(云南高原湖泊流域污染过程与管理重点实验室 (筹),云南省环境科学研究院,云南昆明650034)
人工湿地中反硝化细菌的筛选及鉴定
武孔焕,聂菊芬,王志芸,贺能琴
(云南高原湖泊流域污染过程与管理重点实验室 (筹),云南省环境科学研究院,云南昆明650034)
用平板划线的方法分离和纯化湿地中的反硝化细菌,从陶粒、碎石和分子筛中共筛选到19株具有潜在反硝化能力的菌株,根据生长速度和外观形态,将其归为4类。分离出的菌株中硝氮去除率在50%以上的菌株有15株,其中去除率最高的菌株为FZS1、FZS4和FZS6,分别为99.67%、98.06%和97.26%,都为兼性厌氧、可运动性细菌。
反硝化细菌;筛选;鉴定;人工湿地
氮素是导致水体污染的重要污染物之一,在国内外,氮素的治理工作日益受到重视,生物脱氮技术受到广大研究者的关注。生物脱氮技术是以反硝化细菌为主,在兼性厌氧条件下,把硝酸盐及亚硝酸盐作为电子受体而生成氮气的过程。从环境中分离、筛选高效反硝化菌株,并掌握其脱氮特性,是提高反硝化细菌应用的关键环节。
陈朋等筛选到一株反硝化细菌LZ-14,通过硝酸盐还原产气试验,证明该反硝化细菌具有良好的产气能力,可以作为生物脱氮的菌种来源[1]。曾庆武筛选到的反硝化细菌A13经鉴定为地衣芽孢杆菌,该菌株不会严重积累亚硝酸盐,其最适反应条件为温度32.5℃、CODMn35.1mg/L、时间114.2h、投菌量6.2×l06cfu/ml,在最适反应条件下,脱氮效率高达99%以上[2]。邵晴等分离筛选到的反硝化细菌A1,其反硝化作用主要集中在菌体的对数生长期,对亚硝酸盐的降解率达到99%[3]。
本研究以湿地中的不同基质 (陶粒、碎石和分子筛)为基础,采用一定的生物学手段,尝试从这些基质中分离、筛选出具有高效脱氮功能的菌株。
1 试验材料与方法
1.1 基质采集
采集通海县六一大沟人工湿地中的基质 (陶粒和碎石)和昆明理工大学呈贡校区的基质 (分子筛),基质置于4℃保存备用 (陶粒简称TL、碎石简称SS、分子筛简称FZS)。
1.2 湿地中反硝化细菌数量的测定
反硝化过程对NO3-消耗的速率显著大于基质中其它生物化学过程对的利用,因此通过在适宜的培养条件下,测定介质中+的消失量,可以初步估计反硝化细菌的数量,采用最大可能数法[4]。
1.3 湿地中反硝化细菌的筛选
1.3.1 培养基成分[5]
(1)菌株分离、纯化、保藏培养基
CH3COONa,2g;蛋白胨,15g;酵母膏,3g;葡萄糖,1g;NaCl,6g;琼脂,12g;KNO3,1.5g;pH控制在7.0~7.2。
(2)菌株筛选、脱氮培养基
CH3COONa,2 g;KH2PO4,0.4 g;MgSO4· 7H2O,0.6g;CaCl2·2H2O,0.07g;KNO3,1g;pH控制在7.0~7.2。
(3)需氧性测定培养基
蛋白胨,10g;酵母膏,5g;葡萄糖,lg;琼脂,15g。
1.3.2 试剂
二苯胺试剂:0.5g无色的二苯胺加入到20ml蒸馏水及100ml浓硫酸中。
1.3.3 菌株分离和纯化
基质悬液制备[6]:分别称取10g基质 (陶粒、碎石和分子筛)至90ml无菌水中,置于摇床上振荡30min,然后吸取lml基质混合液至试管中的无菌水(9ml)中,得到10-2稀释液,依次按10倍稀释法稀释至10-9,由此得到各种水样的稀释样。
分别吸取各稀释液0.lml至反硝化细菌分离用固体培养基平板 (已放置过夜,无杂菌生长),用涂棒将稀释液涂布均匀。之后将平板倒置,放入30℃恒温培养箱培养。
待平板长出菌落后,挑选形态大小各异的菌落用划线培养的方式进行分离。记录所挑取菌落的形态、大小、边缘、质地、凹凸性、光学特征、颜色、同心环和光泽度等。
分离得到的菌株用划线培养的方式对其纯化,在此过程中用显微镜观察,看有无杂菌生长,至无杂菌生长时,方可认为菌株已经纯化完毕。纯化后的菌株接种于斜面培养基,保存备用。
1.3.4 反硝化的脱氮能力
于150mm×15mm的试管中加入已灭菌冷却后的DM培养基,用接种环挑取纯化后的各菌落 (1环)于试管内,震荡使其混匀。加入灭菌的液体石蜡1ml封口,以未接种任何菌种的试管做空白对照。待所有菌株接种完毕,将其置于30℃恒温培养箱培养。
培养9d后,吸取菌液,用0.22μm微孔滤膜过滤,测定滤液中NO3--N和NO2
--N含量变化,确定筛选到菌种的反硝化脱氮能力。
1.3.5 需氧性及运动性测定
将需氧性测定培养基分装入试管内并灭菌,灭菌结束后冷却。用接种针取少许菌株菌落,对试管底部作垂直穿刺接种。置于冷水中让其冷却凝固。于30℃培养7d,观察细菌沿穿刺线的生长情况。以未接种细菌的试管作空白对照,平行2份。
1.3.6 试验指标检查方法NO2
--N用N-(1-萘基)-乙二胺分光光度法,NO3
--N用紫外分光光度法。
2 试验结果和讨论
2.1 湿地中反硝化细菌数量的测定
采用MPN计数法监测了湿地中反硝化细菌的数量,从表1可知陶粒中的反硝化细菌数量最多,为20497MPN/g;其次分别为分子筛和碎石。出现这种差异情况可能和各基质的内部结构有密切的关系。陶粒的内部结构呈细密蜂窝状微孔,这些微孔有益于微生物的生长,而碎石和分子筛的表面较陶粒光滑,不利于微生物的生长,因此微生物数量少于陶粒的微生物数量。
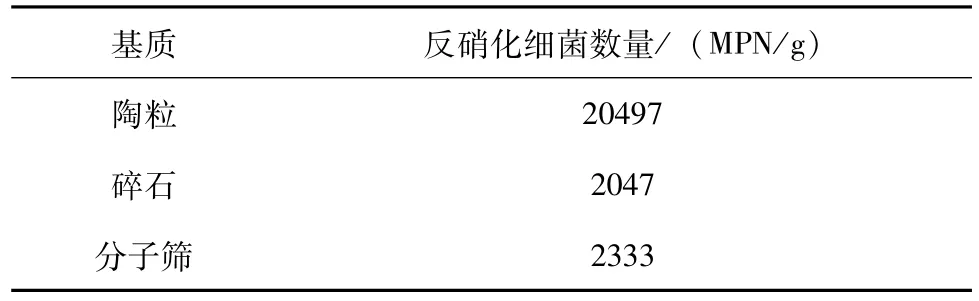
表1 各基质反硝化细菌数量
2.2 湿地中反硝化细菌的筛选
以湿地中各种不同的基质为基础,采用直接分离的方式筛选反硝化细菌。具体操作过程为:将各种基质用无菌水制成各种稀释度的悬液,然后采用涂布平板法将各种基质悬液均匀涂至固体培养基,并放入培养箱培养。
从图1可以看出,各菌落形态差异较大,颜色和大小都不同,说明本研究选用的基质 (陶粒、碎石和分子筛)具有微生物多样性的特征。细菌菌落主要出现在10-2和10-3稀释度上,而其它稀释度菌落生长相对较少。相关的研究表明,在实验室条件下,基质中绝大部分微生物是不能培养的。因此不同基质悬液涂布平板后菌落生长情况并不能准确表明各基质中微生物的实际数量,但可以大致反映微生物种群的多样性。
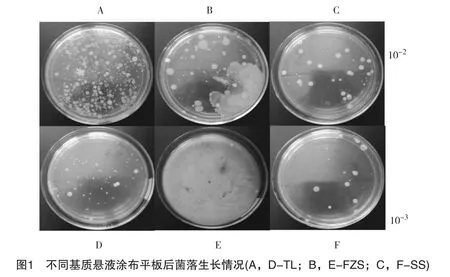

表2 不同基质分离出的各菌株形态特征
表3 各菌株培养5d后-N和-N含量变化比较
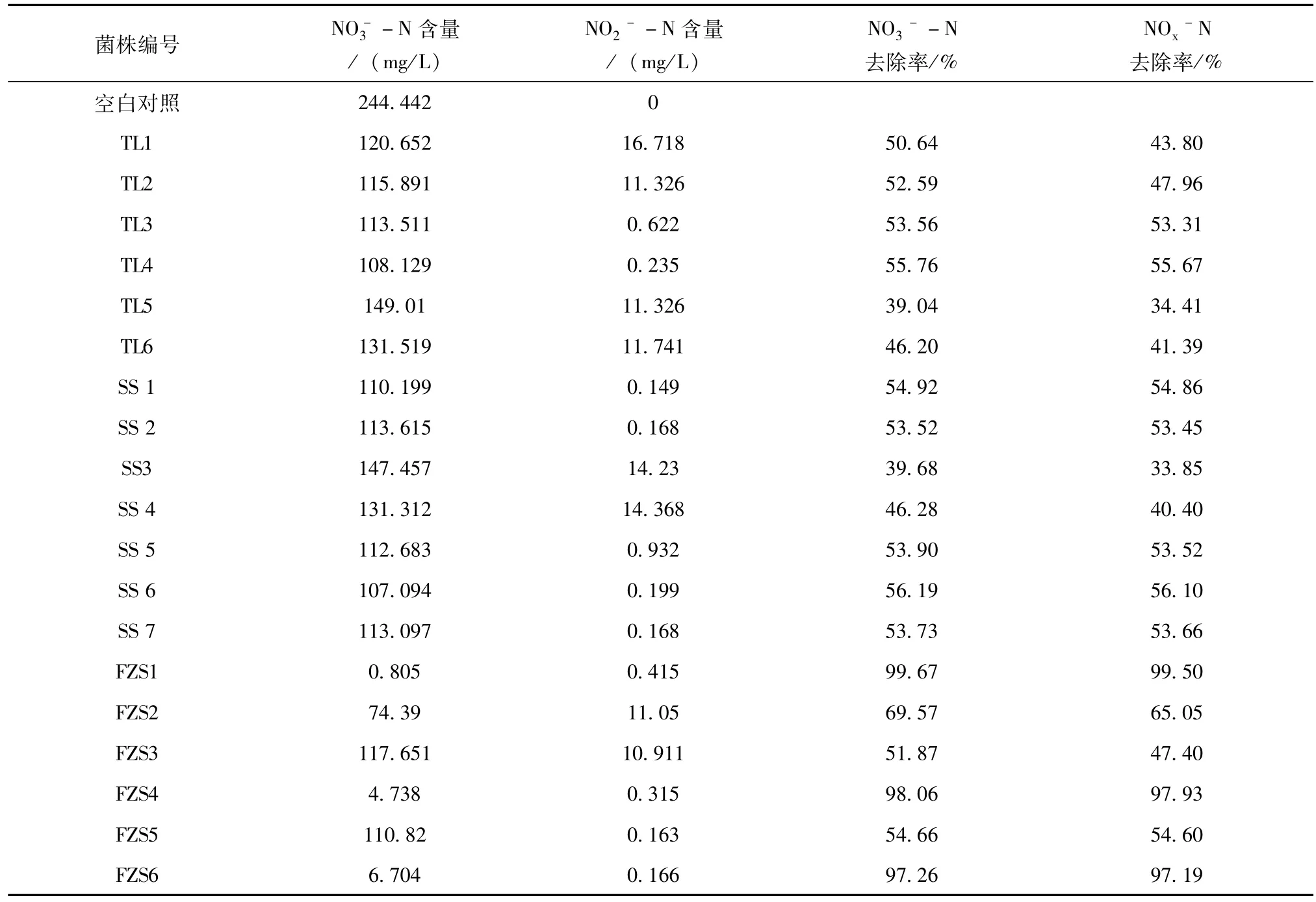
表3 各菌株培养5d后-N和-N含量变化比较
菌株编号 NO-3-N含量/(mg/L)/%空白对照NO2--N含量/(mg/L)NO3--N去除率/% NOx-N去除率244.442 0 TL1 120.652 16.718 50.64 43.80 TL2 115.891 11.326 52.59 47.96 TL3 113.511 0.622 53.56 53.31 TL4 108.129 0.235 55.76 55.67 TL5 149.01 11.326 39.04 34.41 TL6 131.519 11.741 46.20 41.39 SS 1 110.199 0.149 54.92 54.86 SS 2 113.615 0.168 53.52 53.45 SS3 147.457 14.23 39.68 33.85 SS 4 131.312 14.368 46.28 40.40 SS 5 112.683 0.932 53.90 53.52 SS 6 107.094 0.199 56.19 56.10 SS 7 113.097 0.168 53.73 53.66 FZS1 0.805 0.415 99.67 99.50 FZS2 74.39 11.05 69.57 65.05 FZS3 117.651 10.911 51.87 47.40 FZS4 4.738 0.315 98.06 97.93 FZS5 110.82 0.163 54.66 54.60 FZS6 6.704 0.166 97.26 97.19
在实验过程中,通过肉眼观察,挑取外观差异较大的19株菌株,进行纯化。将各菌株依次命名为TL1至TL6、SS 1至SS7、FZS1至FZS6,本研究按菌株的生长速度,大致将其分为四类:
A类:TL2、TL5、SS1、SS4、SS5、SS7号共6支菌株,长势旺盛、迅速,培养24h即能长出显著菌落;
B类:TL1、TL3、TL4、TL6、SS2、SS3、SS6、FZS1、FZS 2、FZS3、FZS5号共11支菌株,长势较为缓慢,经过4d的培养后长出菌落,可菌落大小明显小于A类菌落,菌落呈点状;
C类:FZS 4菌株,生长旺盛、迅速,培养24h就可见菌落已铺满大半个平板;
D类:FZS 6菌株,生长旺盛、迅速,培养24h就可见菌落已铺满整个平板。
为了验证持续培养是否影响各菌株的形态特征,对纯化之后的菌株继续培养7d,发现各菌株的菌落形态和以上描述的大致相似。
筛选到的19株反硝化细菌都为单个排列方式的杆状细菌,形状上表现为点状、圆形、丝状等,表面光滑、湿润和边缘整齐的菌株有15株,不透明和有光泽的菌株占大部分,颜色上表现各异,包括乳白色、白色、棕色,黄色等(表2)。
从表3可看出,各菌株培养9d后,各管中NO3
--N的含量都表现出不同程度的下降,表明本研究分离出的菌株都具有一定的硝酸盐还原能力。测定结果表明NO3--N含量去除率在50%以上的菌株有15株,其中去除率最高的菌株为FZS1、FZS4和FZS6,分别为99.67%、98.06%和97.26%。在硝酸盐含量降低的过程中,各管中都出现亚硝酸盐累积的现象,最高累积硝酸盐的菌株为TL1菌株(16.718 mg/L)、SS4菌株(14.368 mg/L)和SS3菌株(14.23 mg/L)。NO3--N含量的降低,表明筛选到的菌株具有还原硝酸盐的能力,但是NO2--N累积的现象,又说明某些菌株只具有将NO3--N初步还原为NO2
--N的能力,但无法进行或尚未进行进一步的还原反应,导致不能从反应体系中彻底脱氮[1]。

从本研究的结果可知,FZS1、FZS4和FZS6同时具有较高的硝酸盐还原能力和亚硝酸盐还原能力,表明它们对--N的去除建立在-N转化为气态产物的基础上,应是具有完整的反硝化酶系,从而表现出较强的脱氮能力[1]。这些菌株可以用于后续试验,确定菌株的最适温度、碳氮比、碳源、pH等,为后续用于实际生产提供理论参考。
在培养基的表面和整个穿刺线都能观察到细菌的生长 (图2),表明筛选的菌株都为兼性厌氧菌;同时可见细菌的穿刺线较粗,表明细菌具有运动性,属于可运动性细菌。
[1]陈朋.反硝化细菌的筛选、鉴定及其强化处理硝酸盐废水的研究[D].济南:山东大学,2009.
[2]曾庆武.反硝化细菌的分离筛选及应用研究 [D].武汉:华中农业大学,2008.
[3]邵晴,余晓斌.好氧反硝化细菌的筛选及反硝化特性研究[J].生物技术,2008,18(3):63-65.
[4]许光辉,郑洪元.土壤微生物分析方法手册 [M].北京:农业出版社,1986:110-118,234-241.
[5]Shi HR,Lee CM.Combining anoxic denitrifying ability with aerobic-anoxic Phosphorus-rernoval examinations to serene denitrifying phosphorus-removing bacteria[J].Intemational Biodeterioration&Biodegradation,2006,57(2):121-128.
[6]中国科学院南京土壤研究所微生物室.土壤微生物研究法[M].北京:科学出版社,1985:5.
Isolation and Identification of Denitrifying Bacteria in Constructed W etland
WU Kong-huan,NIE Ju-fen,WANG Zhi-yun,HE Neng-qin
(Yunnan Institute of Environmental Science,Yunnan Key Laboratory of Pollution Process and Management of Plateau Lake-watershed(Prepare to Construct),Kunming Yunnan 650034 China)
Streak platemethod was applied to isolate and purify the denitrification bacteria from wetland.Nineteen bacterial strains having the potential denitrification capacity were selected from ceramic,stone,and molecular sieves.These strains were categorized into 4 groups based on their growth speeds and appearances.The results showed that fifteen bacterial strains could remove more than 50 percent of nitrate nitrogen.Among the bacterial strains,three groups of strains,namely FZS1,FZS4,and FZS6,have the highest removal rates of 99.67%,98.06%,and 97.26%respectively.All these bacterial strains are facultative anaerobic and motile.
denitrifying bacteria;select;identify;constructed wetland
X52
A
1673-9655(2014)06-0006-04
2014-05-28

