Rac1对L02肝细胞株上皮细胞间质转化及增殖和凋亡的影响*
王晖晖,张峰,沈珊珊,诸葛宇征
·实验性肝炎·
Rac1对L02肝细胞株上皮细胞间质转化及增殖和凋亡的影响*
王晖晖,张峰,沈珊珊,诸葛宇征
目的检测Rac1在TGF-β1诱导的L02细胞上皮间质转化中的作用,及其对细胞增殖和凋亡的影响。方法应用不同活性的Rac1质粒pExRed-NLS Flag(空载体组)、pExRed-NLS Flag Rac1(野生型Rac1组)、pExRed-NLS Flag Rac1T17N(显性负调控Rac1组)、pExRed-NLS Flag Rac1G12V(持续活化型Rac1组)瞬时转染L02细胞,经5 ng/ml TGF-β1处理细胞。采用免疫印迹法检测融合蛋白Flag-Rac1表达,采用细胞免疫荧光及免疫印迹法检测Ck8和Vimentin表达,采用细胞划痕实验及Transwell法检测细胞迁移能力。使用不同浓度的Rac1特异性抑制剂NSC23766处理L02细胞,采用CCK-8法检测细胞增殖,采用Annexin V-FITC/PI双染法检测细胞凋亡。结果四组质粒均成功瞬时转染到L02细胞中;与空载体组和野生型Rac1组比,持续活化型Rac1转染细胞Vimentin蛋白表达水平显著增高,CK8蛋白表达水平降低,细胞迁移能力增加;与空载体组和野生型Rac1组比,显性负调控Rac1转染细胞Vimentin蛋白表达水平降低,CK8蛋白表达水平增高,细胞迁移能力降低(P<0.05);在NSC23766处理L02细胞后,细胞增殖被抑制,但各处理组细胞凋亡无明显差异。结论Rac1可促进TGF-β1诱导的L02肝细胞株上皮间质转化和细胞增殖,但对细胞凋亡无明显影响。
L02细胞;Rac1;上皮间质转化;增殖;凋亡
上皮细胞间质转化(epithelial-to-mesenchymal transition,EMT)是指具有极性的上皮细胞转化成具有活动能力、能够在细胞基质间自由移动的间质细胞,以上皮细胞极性的丧失和间质特性的获得为重要特征[1]。近年来,已有研究发现肝上皮细胞可通过EMT参与细胞外基质的合成与分泌[2]。Ras相关C3肉毒素底物1(Ras-related C3 botulinum toxin substrate 1,Rac1)是小G蛋白超家族的成员之一,于1989年首次被发现[3]。众多研究显示Rac1在多种细胞内具有调节肌动蛋白细胞骨架重组,导致细胞板状伪足形成和膜褶皱样运动,促进细胞运动与迁移,抑制细胞凋亡等作用[4]。Bakin et al[5]证实Rac1通过抑制转化生长因子β1(transforming growth factor-β1,TGF-β1)诱导鼠乳腺上皮细胞(NmuMG)中p38MAPK及其下游底物ATF2的磷酸化,进而抑制TGF-β1诱导的EMT。TGF-β1在诱导肝细胞EMT中也起到关键的作用[6]。但是,Rac1在EMT中的作用尚不清楚。本文将通过转染不同活性的Rac1质粒到人肝上皮细胞株L02中,观察其对TGF-β1诱导的EMT的作用,同时研究Rac1对L02细胞增殖和凋亡的影响,以进一步探讨Rac1在肝纤维化的发生和发展中的作用。
1 材料与方法
1.1 细胞与试剂人肝细胞株L02细胞为南京市鼓楼医院消化科实验室保存;四种质粒pExRed-NLS Flag(空载体)、pExRed-NLS Flag Rac1(野生型)、pExRed-NLS Flag Rac1T17N(显性负调控)和pExRed-NLS Flag Rac1G12V(持续活化型)由日本心脑血管研究中心Nao Mochizuki教授惠赠,RPMI 1640培养基、胎牛血清购于维森特生物技术(南京)有限公司;胰酶购于美国Gibco公司;CCK-8试剂盒购于日本同仁化学研究所;抗Rac1小鼠源性单克隆抗体购于英国Abcam公司,抗波形蛋白(Vimentin)鼠源性抗体购于德国Merck&Millipore公司;抗角蛋白-8(Cytokeratin-8,CK-8)兔源性抗体购于Bioworld公司;GAPDH购于美国Epitomics公司;辣根过氧化物酶标记羊抗小鼠或抗兔IgG购自杭州联科生物公司;TGF-β1购自美国Peprotech公司,FITC标志的羊抗兔IgG和Lipofectamine2000购于美国Invitrogen公司;Transwell小室购自美国Corning公司;Annexin V-FITC/PI凋亡检测试剂盒购于圣地亚哥eBioscience公司;NSC23766购于美国Tocris bioscience公司。
1.2 细胞培养取人L02细胞,培养于含10%胎牛血清的RPMI 1640培养基中(37℃、5%CO2),待细胞融合至90%左右,用0.25%胰酶-EDTA消化、传代。
1.3 细胞转染及TGF-β1预处理将对数生长期的L02细胞以每孔2×105个细胞接种于6孔细胞培养板,37℃培养过夜。根据Lipofectamine2000说明书操作步骤,将四种质粒分别转入细胞内,转染4~6 h,换成正常培养基,并用5 ng/ml TGF-β1处理48 h。
1.4 细胞融合蛋白的检测采用Western blotting法,取经过预处理的细胞,加PBS洗涤,加入RIPA裂解液冰上裂解30 min,30 min后4℃、12000 r/m离心10 min,取上清液于-20℃保存。各组蛋白等量加样,10%SDS-PAGE凝胶电泳分离蛋白,200 mA恒流转至PDVF膜上,5%脱脂奶粉封闭1 h,分别加入一抗(小鼠抗人Rac1 1:5000,兔抗人GAPDH 1:5000,小鼠抗人Vimentin 1:5000,兔抗人CK8 1:5000),室温孵育过夜,TBST洗涤3次,加HRP标记的羊抗兔或鼠(1:5000)二抗,室温孵育2 h,TBST洗涤3次,每次10 min,加ECL发光液化学发光显色,手动压片曝光,并用Quantity one 4.4定量分析,以目的蛋白与内参GAPDH的比值作为目的蛋白的相对表达量。
1.5 细胞Vimentin和CK8检测采用免疫荧光法,取预处理细胞,加4%多聚甲醛固定15 min,加10%山羊血清封闭1 h,加小鼠抗人Vimentin单克隆抗体(1:200),兔抗人CK8单克隆抗体(1:200),4℃过夜,加FITC标记的羊抗兔IgG(1:200)室温下孵育1 h,用2 μg/ml DAPI避光孵育5 min,染核。于荧光显微镜下拍照,并分析各组细胞的荧光强度。
1.6 细胞迁移能力检测采用细胞划痕实验法,转染细胞4~6 h,以无菌移液管尖在培养板单层细胞的相同位置划直线,PBS洗去脱落细胞,加5 ng/ml的TGF-β1处理24 h,显微镜下观察细胞从划痕处向中央爬行的距离,每孔随机选取6个视野观察并拍摄,行3次独立实验取均值;另采用Transwell小室实验,转染细胞4~6 h,胰酶消化,调整各组细胞使其细胞数为1×104/ml。取各组细胞200 μl,加入各小室,下室加入500 μl的10%FBS-RPMI 1640培养基,并按5 ng/ml的质量浓度加入TGF-β1,常规培养24 h,取出,加PBS洗涤,4%多聚甲醛固定,结晶紫染色,光镜下随机选取6个视野,拍照、计数,取平均值。
1.7 细胞增殖的检测采用CCK-8法,取对数生长期的L02细胞,以2×104/孔接种于96孔板,过夜贴壁培养,加入质量浓度分别为25μmo/L、50μmo/L、100μmo/L和200μmo/L的Rac1特异性抑制剂NSC23766,分别处理0 h、24 h、48 h和72h。每组加入CCK-8溶液10μl/孔,37℃培养箱孵育1 h,以酶标仪测定450 nm波长处吸光度值。
1.8 细胞凋亡的检测采用Annexin V-FITC/PI双染法,加不同浓度的NSC23766(25μmo/L、50μmo/L、100μmo/L和200μmo/L)干预L02细胞48 h,按照Annexin V-FITC/PI凋亡检测试剂盒说明书处理,上流式细胞仪(BD FACSAria II)检测。1.9统计学处理应用SPSS18.0软件进行数据统计,计量资料以(±s)表示,组间比较采用单因素方差分析,两两比较采用SNK法,P<0.05为差异有统计学意义。
2 结果
2.1 质粒转染情况在质粒转染后,采用Western blotting法检测融合蛋白Flag-Rac1的表达,结果与空质粒组比,野生型Rac1组、显性负调控Rac1组和持续活化型Rac1组在瞬时转染后,可见融合蛋白的表达(图1)。
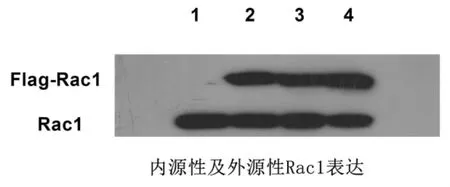
图1 质粒转染L02细胞融合蛋白的表达1:pExRed-NLS Flag;2:pExRed-NLS Flag Rac1;3:pExRed-NLS Flag Rac1T17N;4:pExRed-NLS Flag Rac1G12V(持续活化型Rac1组)
2.2 Rac1促进间质Vimentin表达,抑制上皮CK8表达四组细胞在瞬时转染后,与空质粒组和野生型Rac1组比,持续激活型Rac1转染细胞CK8表达减少,Vimentin表达增加,而显性负调控Rac1转染细胞CK8表达增加,Vimentin表达减少(图2);持续激活型Rac1转染细胞较空质粒或野生型Rac1转染细胞CK8表达减少,Vimentin表达增加,而显性负调控Rac1转染细胞CK8表达增加,Vimentin表达减少,以上差异具有统计学意义(P均<0.05,图3)。
2.3 Rac1促进L02细胞迁移与空质粒或野生型Rac1转染细胞比,持续激活型Rac1转染细胞划痕愈合效率较高,而显性负调控Rac1转染细胞则相对较低(P均<0.05,图4);与空质粒或野生型Rac1转染细胞比,持续激活型Rac1转染的L02细胞迁移能力增加,而显性负调控Rac1转染的L02细胞迁移能力减弱(P均<0.05,图4)。

图2 各组细胞Vimentin和CK8的表达情况(免疫荧光染色,400×)

图3 各组细胞Vimentin和CK8的表达情况(Western blotting法)
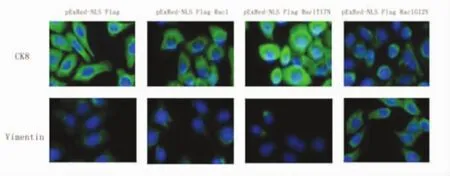
图4 各组细胞迁移能力的变化细胞划痕实验和Transwell法检测
2.4 Rac1促进L02细胞增殖与对照组比,除了25 μmo/L处理组的细胞外,其他处理组的L02细胞在48 h和72 h时的细胞增殖率均降低,且呈浓度依赖性(图5)。
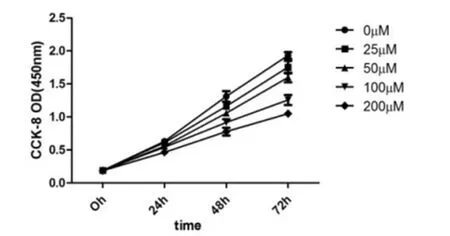
图5 NSC23766对细胞增殖的影响
2.5 Rac1对L02细胞凋亡无影响与对照组比,各处理组L02细胞凋亡的差异无统计学意义(P>0.05,图6)。

图6 NSC23766对细胞凋亡的影响
3 讨论
在诱导EMT发生的众多细胞因子和转录因子中,TGF-β1是关键因子之一。TGF-β1首先被发现在正常乳腺上皮细胞中可诱导EMT的发生[4],之后又被证明其能在体外调控多种不同的上皮细胞发生EMT,包括角质形成细胞、气道上皮细胞和肝细胞等[6,8]。Kojima et al[9]研究发现TGF-β1通过下调Claudin-1,同时上调SIP1和Snail诱导大鼠肝细胞EMT。Kaimori et al[10]进行体外实验发现,组蛋白脱乙酰酶可抑制TFG-β1诱导肝细胞EMT的发生。
已有研究表明Rac1可通过不同机制参与多种上皮细胞的EMT过程,Rac1可协同PI3K、JNK信号通路,在I型胶原诱导的鼠乳腺上皮细胞的EMT过程中发挥调控作用。Santibanez et al发现表达持续活化型Rac1(Q61LRac1)可促进角质形成细胞发生EMT,同时细胞运动及侵袭能力增强。相反,表达显性负调控型Rac1(N17TRac1)将抑制TGF-β1诱导的细胞伸展、运动和迁移。然而,在TGF-β1诱导的肝上皮细胞EMT中Rac1的作用并不明确。
本实验通过将不同Rac1活性的质粒转染到肝上皮细胞中,经TGF-β1诱导后,证实Rac1通过以下两个方面影响L02细胞EMT:(1)细胞出现EMT分子标志物的改变,即上皮标志物CK8表达下调、间质标志物Vimentin表达上调;(2)细胞划痕实验和Tranwell小室实验均证实细胞迁移能力增强。
既往研究主要集中在Rac1对细胞运动等的影响,而并无Rac1对肝上皮细胞的增殖和凋亡影响的报道。本实验中采用的特异性Rac1抑制剂NSC23766是一种具有膜通透性的复合物,能特异性地阻断Rac1与Rac1特异性的GEFs Trio和Tiam1结合而影响Rac1 GDP/GTP的循环,从而抑制Rac1的活性。本研究用CCK-8法检测了不同浓度Rac1抑制剂NSC23766对L02增殖水平的影响,结果显示L02细胞增殖被抑制的程度随着抑制剂浓度的增加而增加,即抑制Rac1的活性可抑制L02细胞增殖,与Bosco et al的研究结果相吻合,即在抑制Rac1活性后,经典Wnt通路受抑制,从而逆转了缺乏NF2细胞的细胞增殖。本实验结果显示,采用Annexin V-FITC/PI双染法检测细胞凋亡,发现不同浓度的NSC23766对L02细胞凋亡无明显的影响。
本研究通过将上调和下调Rac1活性的质粒转染到L02细胞,初步证实Rac1可促进TGF-β1诱导的肝上皮细胞EMT;通过Rac1抑制剂处理L02细胞,观察到Rac1可促进L02细胞增殖,而对其凋亡无明显影响;这些现象的发生机制仍然有待进一步探讨。
[1]Greenburg G,Hay ED.Epithelia suspended in collagen gels can lose polarity and express characteristics of migrating mesenchymal cells.J Cell Biol,1982,95(1):333-339.
[2]FirrincieliD,BoissanM,ChignardN.Epithelial-mesenchymal transition in the liver.Gastroenterol Clin Biol,2010,34(10): 523-528.
[3]Didsbury J,Weber RF,Bokoch GM,et al.Rac,a novel ras-related family of proteins that are botulinum toxin substrates.J Biol Chem,1989,264(28):16378-16382.
[4]Leve F,Morgado-Díaz JA.Rho GTPase signaling in the development of colorectal cancer.J Cell Biochem,2012,113(8): 2549-2559.
[5]Bakin AV,Rinehart C,Tomlinson AK,et al.p38 mitogen-activatedproteinkinaseisrequiredforTGFbeta-mediated fibroblastic transdifferentiation and cell migration.J Cell Sci,2002,115(Pt 15):3193-3206.
[6]Kaimori A,Potter J,Kaimori JY,et al.Transforming growth factor-beta1 induces an epithelial-to-mesenchymal transition state in mousehepatocytesinvitro.JBiolChem,2007,282(30): 22089-22101.
[7]Santibánez,F,KocicJ,FabraA,etal.Rac1modulates TGF-beta1-mediatedepithelialcellplasticityandMMP9 productionintransformedkeratinocytes.FEBSLett,2010,584(11):2305-2310
[8]Hackett TL,Warner SM,Stefanowicz D,et al.Induction of epithelial-mesenchymal transition in primary airway epithelial cells from patients with asthma by transforming growth factor-beta1. Am J Respir Crit Care Med,2009,180(2):122-133.
[9]Kojima T,Takano K,Yamamoto T,et al.Transforming growth factor-betainducesepithelialtomesenchymaltransitionby down-regulation of claudin-1 expression and the fence function in adult rat hepatocytes.Liver Int,2008,28(4):534-545.
[10]Kaimori A,Potter JJ,Choti M,et al.Histone deacetylase inhibition suppresses the transforming growth factor beta1-induced epithelial-to-mesenchymal transition in hepatocytes.Hepatology,2010,52(3):1033-1045.
(收稿:2014-02-07)
(校对:陈从新)
Effects of Rac1 on epithelial-mesenchymal transition,and proliferation and apoptosis of L02 cells in vitro
Wang Huihui,Zhang Feng,Shen Shanshan,et al.School of Medicine,Southeast University,Nanjing,210009,Jiangsu Province,China
ObjectiveTo investigate the effects of Rac1 on epithelial mesenchymal transition(EMT)induced by transforming growth factor β1(TGF-β1),and on cell proliferation and apoptosis of L02 cells in vitro. MethodsRac1 plasmids with different activity including pExRed-NLS Flag(vector),pExRed-NLS Flag Rac1(wild type),pExRed-NLS Flag Rac1T17N(dominant negative mutant)and pExRed-NLS Flag Rac1G12V(constitutively active mutant)were transiently transfected into L02 cells,followed by stimulation of exogenous TGF-β1 at dose of 5ng/ml;Exogenous Flag-Rac1 fusion protein was determined by Western blot analysis;Immunofluorescence and Western blot were used to evaluate epithelial markers of Ck8 and mesenchymal markers of vimentin;Cell motility was assessed by transwell assay and wound healing assay;L02 cells were treated with different concentrations of Rac1 inhibitor(NSC23766),and the influence of Rac1 on cell proliferation and apoptosis were detected by CCK-8 assay or Annexin V-FITC/PI double staining,respectively.ResultAll kinds of plasmids were successfully transiently transfected into L02 cells;Compared with the vector group and the wild type group,constitutively active mutant pExRed-NLS Flag Rac1G12V significantly increased the expression of vimentin,decreased the expression of CK8 and enhanced cell motility,whereas the effects of dominant negative mutant pExRed-NLS Flag Rac1T17N were just the opposite of above results(P<0.05);Disruption of Rac1 activity with NSC23766 inhibited cell proliferation(P<0.05)without increasing cell apoptosis.ConclusionsRac1 promotes the EMT process and cell proliferation induced by TGF-β1 in L02 cells without affecting cell apoptosis in vitro.
L02 cells;Rac1;Epithelial-mesenchymal transition;Proliferation;Apoptosis
10.3969/j.issn.1672-5069.2014.05.019
江苏省自然科学基金资助项目(BK2011094)
210009南京市东南大学医学院(王晖晖);南京大学医学院附属鼓楼医院消化科(张峰,沈珊珊,诸葛宇征)
王晖晖,女,24岁,硕士研究生。E-mail: wanghuihui19891021@163.com
诸葛宇征,E-mail:yuzheng9111963@aliyun.com

