中国人群携带m.14484T>C突变的Leber’s遗传性视神经病变线粒体单体型及多态位点分析
孟祥娟, 朱金萍, 高敏, 张赛, 赵福新, 张娟娟, 刘晓玲,韦企平, 童绎, 张铭连, 瞿佳, 管敏鑫1,
1. 温州医科大学Attardi线粒体生物医学研究院, 浙江省医学遗传学重点实验室, 温州 325035;
2. 温州医科大学附属眼视光学院, 温州 325027;
3. 北京中医药大学东方医院, 北京 100078;
4. 河北省邢台市眼科医院, 邢台 054001;
5. 浙江大学遗传研究所, 杭州 310023
中国人群携带m.14484T>C突变的Leber’s遗传性视神经病变线粒体单体型及多态位点分析
孟祥娟1,2, 朱金萍1,2, 高敏1,2, 张赛1,2, 赵福新2, 张娟娟5, 刘晓玲2,韦企平3, 童绎2, 张铭连4, 瞿佳2, 管敏鑫1,5
1. 温州医科大学Attardi线粒体生物医学研究院, 浙江省医学遗传学重点实验室, 温州 325035;
2. 温州医科大学附属眼视光学院, 温州 325027;
3. 北京中医药大学东方医院, 北京 100078;
4. 河北省邢台市眼科医院, 邢台 054001;
5. 浙江大学遗传研究所, 杭州 310023
线粒体ND6基因(MT-ND6)上的m.14484T>C突变是Leber’s遗传性视神经病变(Leber’s hereditary optic neuropathy, LHON)的一个原发性突变, 但该突变自身不足以产生视力损伤。为研究线粒体单体型对携带该突变人群LHON发病的影响, 文章对1 177例中国汉族LHON患者MT-ND6基因进行了全面系统的筛查, 共筛查到67例患者携带m.14484T>C同质性突变, 在该研究群体中所占比例为5.7%。携带m.14484T>C突变的51例家系LHON的外显率从5.6%~100.0%不等, 平均外显率为21.5%。对家系中51例先证者线粒体全基因组进行分析, 各表现为不同的多态性, 分别属于18个东亚线粒体单体型。其中单体型A和单体型F在病例组频率均明显低于106例对照组。另外, 单体型M10a在病例组中占9.8%, 在对照组中未被发现, 进一步发现该单体型家系LHON的平均外显率(46.13%)显著高于其他单体型家系的平均外显率, 提示线粒体单体型M10a可能增加视力损伤的风险。
Leber遗传性视神经病变; 线粒体; 突变; 单体型; 外显率
Leber遗传性视神经病变(Leber's hereditary optic neuropathy, LHON)是一种主要累及视网膜、巩膜筛板前部视乳头黄斑束纤维, 导致视网膜神经节细胞退行性病变的母系遗传性疾病。1871年, 德国眼科医生 Leber首先描述其临床特征:该病好发于青壮年男性, 表现为双眼同时或先后急性或亚急性无痛性视力减退, 可同时伴有中心视野缺失及色觉障碍[1~3]。线粒体DNA(mtDNA)突变是LHON发病的分子基础, 自1988年Wallace等[4]发现LHON家系中MT-ND4基因的m.11778G>A突变以来, 目前已发现60多个mtDNA突变与LHON发病密切相关[5]。绝大多数LHON患者只携带该病3个mtDNA原发突变(即m.3460G>A、m.11778G>A或m.14484T>C突变)中的一个。本课题组相继发现了m.3394T>C、m.3866T>C、m.4435A>G、m.5601C>T、m.11696G>A、m.12338T>C、m.14502T>C、m.14693A>G、m.15951A>G突变与LHON相关[6~15]。在LHON家系中, 发病或未发病但携带致病性突变的女性, 其后代(即母系成员)均会遗传相应突变, 但并不是所有母系成员都表现出 LHON症状(即不完全外显), 并且男性突变携带者的发病率高于女性(即性别偏好), 提示其他遗传因素或环境因素[16~18]可能对该病产生影响。目前在欧洲白人中已发现线粒体单体型 J增加携带m.11778G>A、m.14484T>C突变家系LHON外显率,单体型K降低携带m.3460G>A突变家系该病的外显率[19]。Ji等[20]对中国携带m.11778G>A突变的LHON家系研究发现:线粒体单体型M7b1,2以及单体型G可以增加携带 m.11778G>A突变家系外显率, 而单体型M8a降低携带该原发突变家系的外显率。为分析线粒体单体型以及多态性位点在汉族LHON患者发病的影响, 本文首先对1 177例患者进行mtDNA突变筛查, 然后从中选取51例携带m.14484T>C突变的LHON先证者进行了临床评估、家系调查及线粒体全基因组分析。
1 对象与方法
1.1 研究对象
本课题组自 2004年与温州医科大学附属眼视光医院、北京中医药大学东方医院眼科、河北省邢台市眼科医院等全国各地多家医院合作, 在全国范围内收集了1 177例LHON先证者。同时, 收集106例年龄、种族、地域匹配的健康体检人群作为正常对照。与所有受试者签署知情同意书, 并采集受试者外周静脉血样3 mL或制成滤纸片。
1.2 方法
1.2.1 眼科临床检查
对收集的LHON先证者及部分家系成员进行眼科临床检查, 包括标准对数视力表检测视力、色觉检查、视野计检查视野、电生理仪检测视觉诱发电位、眼底照相拍片等检查。视力损害程度参照世界卫生组织标准:正常>0.3; 0.1≤轻度≤0.3; 0.05≤中度<0.1; 0.02≤重度≤0.05; 极重度<0.02。
1.2.2 基因组DNA提取
对患者及对照组取外周静脉血, 经EDTA-K2抗凝或制成滤纸, 用经典的酚-氯仿法提取基因组DNA。
1.2.3 PCR扩增及测序分析
对所有患者, 首先对 m.14484T>C突变所在片段通过正向引物 5′-GCATAATTAAACTTTACTTC-3′和反向引物5′-AGAATATTGAGGCGCCATTG-3′进行引物扩增, 用限制性内切酶 MvaⅠ进行酶切鉴定之后进行测序验证。PCR扩增体系、扩增条件以及检测方法见参考文献[3, 21]。
对51例先证者使用24对有部分重叠的正反向引物进行线粒体基因组全序列PCR扩增、纯化、正反向引物测序[22]。使用Chromas 2.24、DNASTAR 5.0等软件对测序结果与线粒体基因数据库网站(http://www.mitomap.org)以及修正的mtDNA剑桥参考序列[23]比对分析。同时, 利用同样的方法对 106例正常对照进行线粒体DNA测序、分析。
1.2.4 种系发生学分析
为了分析 RNA和氨基酸编码区的错义突变的保守性, 选择 14个灵长类哺乳动物:白额卷尾猴(Cebus albiforns)、大猩猩(Gorilla gorilla)、人(Homo sapiens)、长臂猴(Hylobates lar)、环尾狐猴(Lemur catta)、猕猴(Macaca mulatta)、地中海猕猴(macaca sylva)、蜂猴(Nycticebus coucang)、倭黑猩猩(Pan paniscus)、黑猩猩(Pan troglodytes)、阿拉伯狒狒(Papio hamadryas)、苏门答腊猩猩(Pongo abelii)、庞戈猴(Pongo pygmaeus)、马来跗猴(Tarsius bancanus)。查找错义突变在14个灵长类哺乳动物对应的RNA和氨基酸,计算RNA或氨基酸保守系数, 进行保守性分析。
1.2.5 线粒体单体型分析
通过线粒体全基因组测序结果的变异位点进行线粒体单体型分析[24,25], 确定线粒体单体型。
1.2.6 统计学分析
统计携带 m.14484T>C突变的例数以及病例组和对照组中各线粒体单体型例数, 计算每种单体型所占比例, 同时通过临床资料计算各单体型平均外显率。应用SPSS16.0软件, 对每种单体型相应的病例组和对照组个数以及突变位点通过 χ2检验, 以 P值<0.05为具有统计学差异。
2 结果与分析
2.1 临床评估
对来自全国不同地区的1 177例病例的mtDNA筛查中, 发现67例携带m.14484T>C突变, 该突变均为同质性突变。对其中51例先证者及其家系成员进行了临床评估。先证者大多为青年男性(男性 47例, 女性4例), 发病年龄从6.0岁~44.0岁, 平均年龄为19.0岁。发病时视力损伤程度从轻度到极重度表现不一。对各先证者家系成员进行分析, 每个家系患者男女比例从3∶0到1∶2, 家系外显率也不同,从 5.6%~100%不等, 平均外显率为 21.5%。临床数据具体见表1。

表1 患者临床资料总结
2.2 线粒体全基因组变异位点统计
用24对部分重叠引物对51例先证者线粒体全基因组扩增并进行序列测定。结果与线粒体基因数据库网站(http://www.mitomap.org)以及修正的mtDNA剑桥参考序列[23]进行比对分析, 发现379个先前已经报道过的突变位点。其中D-Loop区多态性位点有105个; RNA编码区突变有36个; 氨基酸编码区突变有238个, 其中包括同义突变164个, 错义突变74个。表2详细列举了本文筛查到的RNA和氨基酸编码区已报道的错义突变及其相应例数、氨基酸的改变和14个物种中碱基改变对应的RNA和氨基酸的保守性。
本文对 51例先证者线粒体全基因组进行分析,发现先前未报到过的突变位点共37个:其中D-Loop区4个; RNA编码区有6个, 其中5个位点具有较高的保守性:m.1829A>C、m.2406A>G、m.2607T>C、m.3180del-A、m.10010T>G; 编码氨基酸的同义突变有18个, 错义突变9个, 其中5个位点具有较高的保守性, 分别是:m.3776G>A, m.8536A>G, m.11771C>G, m.11957A>G, m.13187C>G。具体见表3。
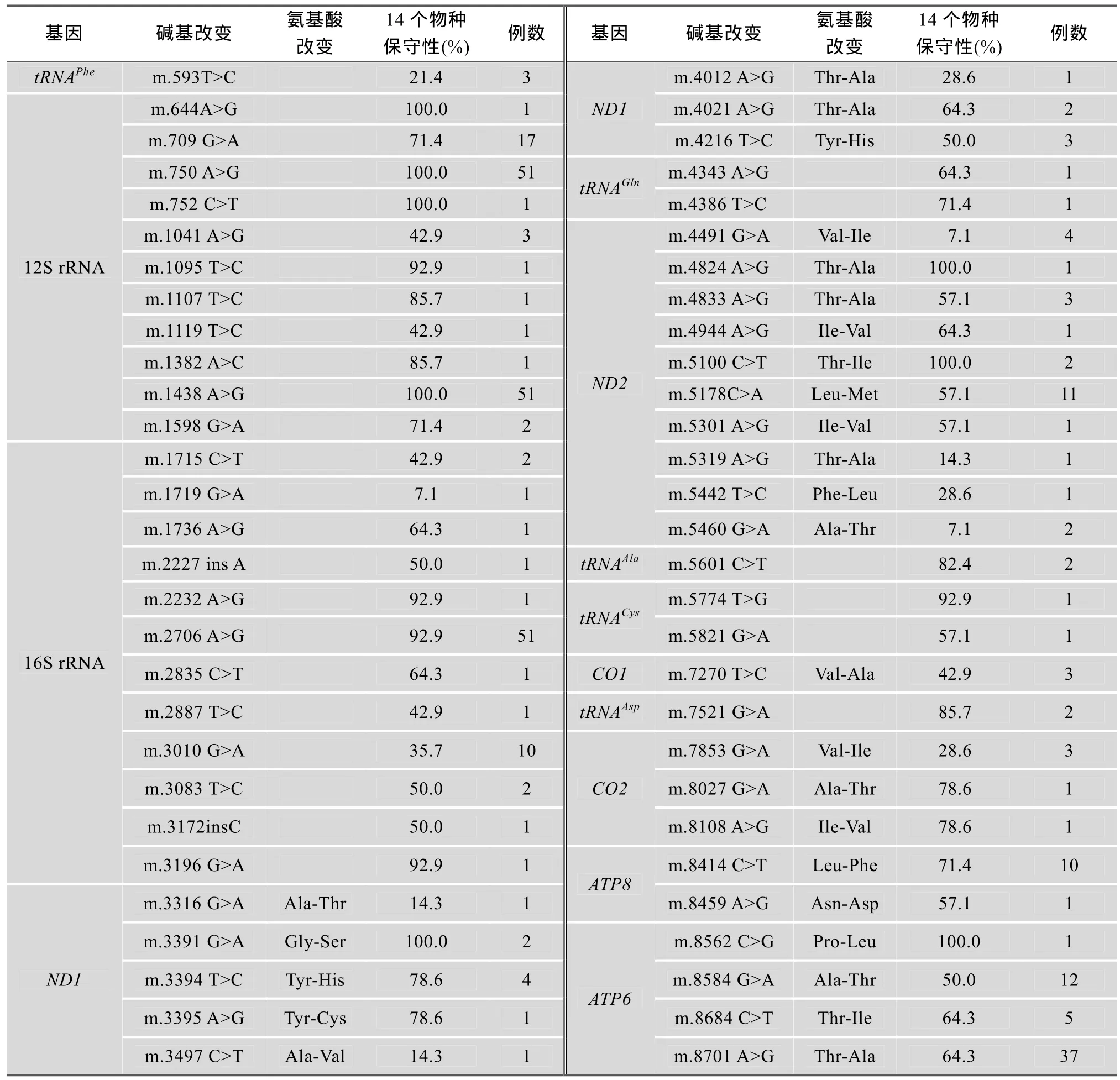
表2 本文筛查到的已报道的变异位点
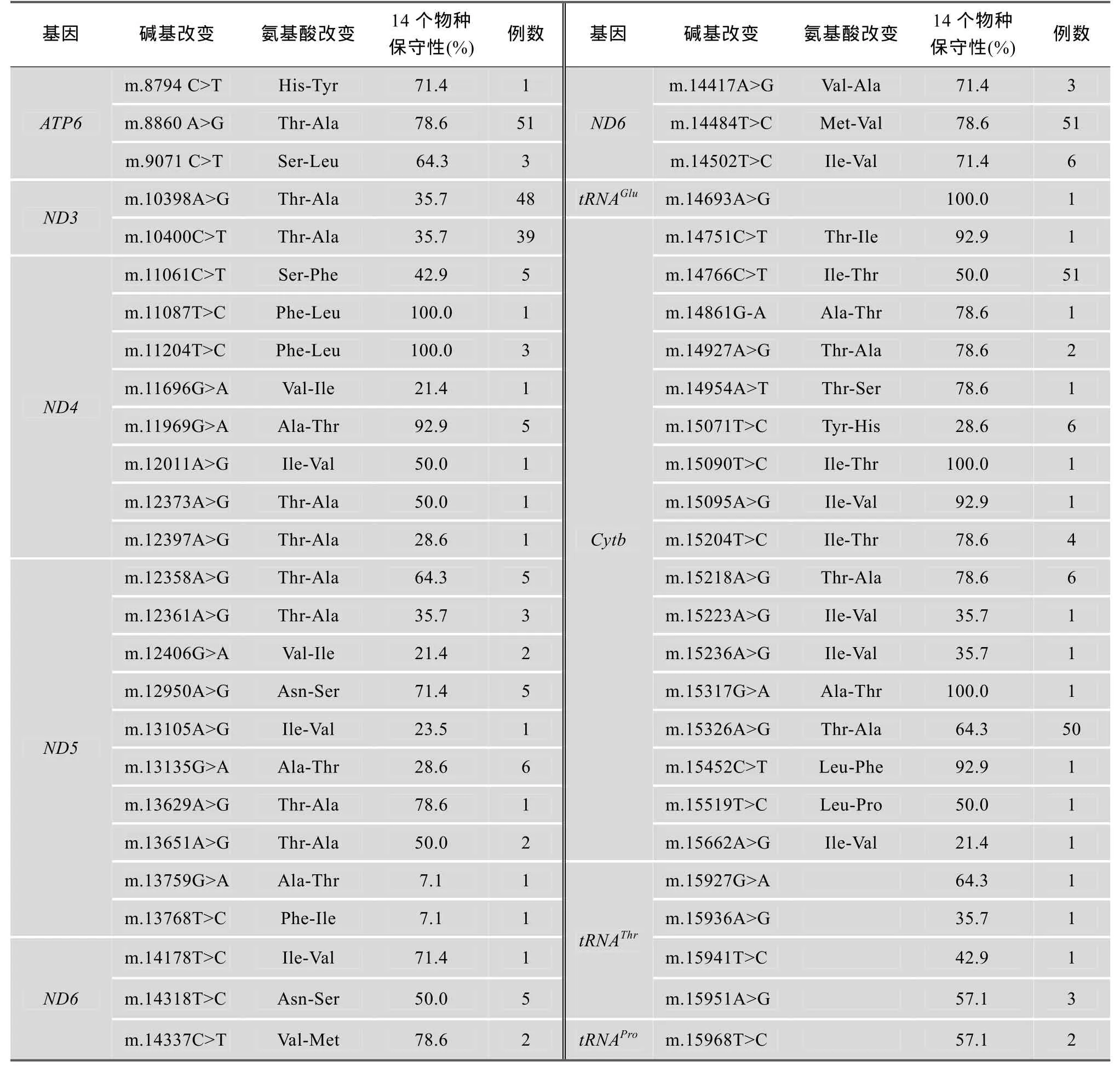
续表2
2.3 线粒体单体型统计
用51例先证者和106例正常对照的mtDNA序列, 进行线粒体单体型分型。51例先证者属于18个线粒体单体型, 分别是:B、B4、B5、C、D4、D5、G2、G3、H2、M7、M8、M9、M10a、M11、R11、N9、Y、Z; 106例对照也存在18种线粒体单体型, 分别是:A、D、F、B、B4、B5、C、D4、D5、G2、H2、M7、M8、M9、M11、N9、Y、Z。线粒体单体型的例数、平均外显率和平均发病年龄, 以及对照组和病例组之间的P值等见图1。
3 讨 论
在1 177例先证者中筛查到携带m.14484T>C突变 67例, 该突变频率在这组汉族 LHON患者中为5.7%。王燕等[1]在110例中国携带原发突变的LHON患者中发现m.14484T>C突变频率为7.3%, 近几年在欧洲白人患者中发现 m.14484T>C突变占原发突变的14%[5]。
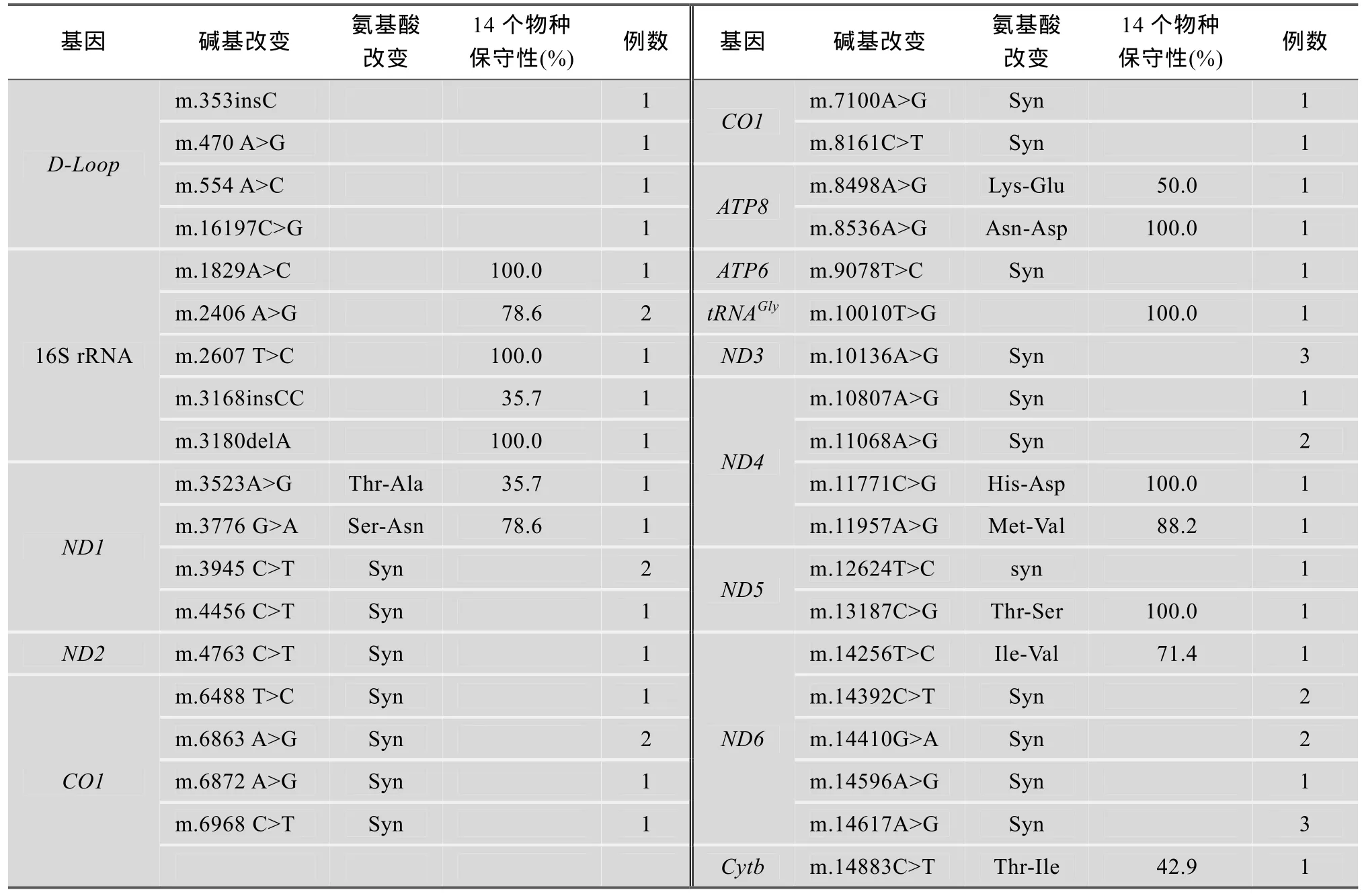
表3 本文筛查到的未被报道过的变异位点

图1 对照组-病例组线粒体单体型分布
线粒体单体型分析需要排除有亲缘关系的个体,本研究对所选取的 51例先证者进行线粒体全基因组分析, 发现RNA编码区m.5601C>T[9]、m.15951A>G[15]突变和氨基酸编码区m.3394T>C[6]、m.11696G>A[10]、m.14502T>C[12]突变被报道与该病相关。此外,还筛查到 37个未被报道过的突变位点, 其中 RNA编码区5个位点具有较高的保守性, 除m.2406A>G的保守性为78.6%, 其余4个位点保守性均为100%;病例组中m.2406A>G突变有2例, 其余突变均为1例, 对照组中该 5个位点均未发生突变; 经统计学分析, m.2406A>G突变在病例组和对照组之间P值<0.05, 具有统计学差异, 但是否为LHON继发性突变需要进一步研究。氨基酸编码区的 5个较高的保守性位点中, m.3776G>A保守性为78.6%, m.11957A>G为88.24%, 其余的保守性为100%; 这5种突变在病例组均为1例, 对照组尚未发现该5种突变, 经分析不具有统计学差异, 尚不能认为这 5种突变与该病相关。
51例先证者大多数是男性, 发病年龄不等, 平均为19.0岁, 每种单体型的平均发病年龄没有很大差别, 单体型对发病年龄可能没有影响。患者家系外显率不等, 平均外显率为21.5%, 各单体型外显率差异较大, 提示线粒体单体型影响外显率的表达。
对具有统计学差异的各线粒体单体型分别进行分析。单体型A、F在正常人群分别有12例、19例,病例组不存在这两种单体型, 提示线粒体单体型A、F可能降低携带m.14484T>C突变人群发病的风险。其中单体型A的特异位点m.4824A>G突变导致ND2第 119位保守性为 100%的苏氨酸改变为丙氨酸, m.663A>G突变与12S rRNA第16位相关, 该位的保守性为79%。Kaewsutthi等[26]报道单体型F在携带m.11778A>G 突变的泰国人群中比例很低, 可能降低视力损伤。
线粒体单体型G3在病例组有2例, 对照组不存在该单体型。该东亚线粒体单体型分支特异位点是m.16274G>A, 对照组有5例突变, 不具有统计学差异。两例家系平均外显率为7.0%, 低于平均外显率,尚不能认为线粒体单体型G3增加携带m.14484T>C突变家系的外显率。
线粒体单体型 M10a在对照组不存在, 病例组有5例。该单体型平均外显率为46.1%, 高于总体平均外显率21.5%。发病平均年龄为17.4岁。目前国内外报道的环境因素对该病外显率的影响表现在吸烟饮酒方面, 尚无地理环境对该病外显率产生影响的报道。Kirkman等[17]开展了一个较大规模的基因-环境因素相互作用的研究, 结果显示, 吸烟对LHON发病的影响不依赖于性别和饮酒习惯而独立发生; 只有当过量饮酒时, LHON的发病才受酗酒的影响[18]。对该单体型的5例患者进行临床资料分析,其中编号WZ271、WZ272、WZ274、WZ274患者无吸烟饮酒史, 编号WZ273患者具有少量吸烟饮酒史,所以可以排除环境因素对该种单体型外显率的影响。进一步对其单体型代表性特异位点进行分析:其中m.14502T>C突变已被报道是LHON的继发性突变[12]; 5例m.15218A>G突变保守性为78.57%, 导致复合物Ⅰ亚基Cytb第158位苏氨酸突变为丙氨酸,这个位点在对照组未被发现, 有统计学差异。在线粒体单体型M10a中除已知的m.14502T>C突变之外, m.15218A>G突变也可能协同原发突变对疾病外显率起到促进作用。
线粒体单体型 R11在对照组没有, 病例组有 3例。对该单体型特异位点分析, 其中 D-Loop区m.16311T>C、m.189A>G、m.185G>A突变在对照组也均存在, 无统计学差异, m.13681T>C为同义性突变, m.10398A>G、m.12950A>G、m.11061C>T、m.10031T>C突变保守性均较低, 且外显率 14.4%,低于平均外显率。尚不能认为单体型 R11对携带m.14484T>C突变家系的外显率产生影响。
此外线粒体单体型 M9不具有统计学差异, 在病例组有4例, 对照组有3例。家系外显率为50.9%,明显高于平均外显率, 该单体型特异位点m.3394T>C是LHON的继发性突变位点[6], 单体型M9是否增加家系外显率, 需要进一步研究。
为探究患者线粒体单体型地区差异, 对临床资料先证者来源进行分析发现, 除来自河南 3例患者,其中1例属于单体型M9, 2例属于单体型M10a, 其他地区患者所属线粒体单体型分布趋势比较均衡。
本文对中国 51例携带 m.14484T>C突变的LHON先证者以及家系进行研究, 初步分析了线粒体单体型对携带 m.14484T>C突变家系外显率的影响。发现单体型 A、F可能降低携带该原发突变人群LHON的发病; 单体型M10a与正常人群存在统计学差异, 并且发现该单体型家系外显率较高, 提示线粒体单体型 M10a可能增加携带该原发突变家系外显率; 发现m.2406A>G这一新突变位点, 但是否为该病的继发性突变需要进一步研究; 在各地区患者单体型分析中河南患者 3例, 2例属于单体型M10a, 其他地区患者所属单体型分布趋势无明显差别。在多数LHON家系, 同种线粒体单体型患者的发病年龄和视力损害程度不等以及男性多发的现象,提示除线粒体单体型和致病性突变以外, 可能与其他因素如核修饰基因[27~29]、环境因素[16~18]等相关,这些因素在该病的发生发展中的作用有待进一步研究。
[1] Yu-Wai-Man P, Griffiths PG, Hudson G, Chinnery PF. Inherited mitochondrial optic neuropathies. J Med Genet, 2009, 46(3): 145-158.
[2] 王燕, 郭向明, 贾小云, 黎仕强, 肖学珊, 郭莉, 张清炯.中国人Leber遗传性视神经病变的原发突变及临床特征.中华医学遗传学杂志, 2005, 22(3): 334-336.
[3] Qu J, Zhou X, Zhao F, Liu X, Zhang M, Sun YH, Liang M, Yuan M, Liu Q, Tong Y, Wei QP, Yang L, Guan MX. Low penetrance of Leber's hereditary optic neuropathy in ten Han Chinese families carrying the ND6 T11484C mutation. Biochim Biophys Acta, 2010, 1800(3): 305-312.
[4] Wallace DC, Singh G, Lott MT, Hodge JA, Schurr TG, Lezza AM, Elsas LJ 2nd, Nikoskelainen EK. Mitochondrial DNA mutation associated with Leber’s hereditary optic neuropathy. Science, 1988, 242(4884): 1427-1430.
[5] MITOMAP: A Human Mitochondrial Genome Database. http://www.mitomap.org, 2009.
[6] Zhang M, Zhou X, Li C, Zhao F, Zhang J, Yuan M, Sun YH, Wang J, Tong Y, Liang M, Yang L, Cai W, Wang L, Qu J, Guan MX. Mitochondrial haplogroup M9a specific variant ND1 T3394C may have a modifying role in the phenotypic expression of the LHON-associated ND4 G11778A mutation. Mol Gene Metab, 2010, 101(2-3): 192-199.
[7] Zhou X, Qian Y, Zhang J, Tong Y, Jiang P, Liang M, Dai X, Zhou H, Zhao F, Ji Y, Mo JQ, Qu J, Guan MX. Leber's hereditary optic neuropathy is associated with the T3866C mutation in mitochondrial ND1 gene in three Han Chinese Families. Invest Ophthalmol Vis Sci, 2012, 53(8): 4586-4594.
[8] Qu J, Li RH, Zhou XT, Tong Y, Lu F, Qian YP, Hu YW, Mo JQ, West CE, Guan MX. The novel A4435G mutation in the mitochondrial tRNAMetmay modulate the phenotypic expression of the LHON-associated ND4 G11778A mutation. Invest Ophthalmol Vis Sci, 2006, 47(2): 475-483.
[9] 周晖晖, 戴显宁, 林蓓, 米慧, 刘晓玲, 赵福新, 张娟娟,周翔天, 孙艳红, 韦企平, 瞿佳, 管敏鑫. 7例携带线粒体tRNAAlaC5601T突变的Leber遗传性视神经病变家系的相关研究. 遗传, 2012, 34(8): 1031-1042.
[10] Qu J, Li R, Zhou X, Tong Y, Yang L, Chen J, Zhao F, Lu C, Qian Y, Lu F, Guan MX. Cosegregation of the ND4 G11696A mutation with the LHON-associated ND4 G11778A mutation in a four generation Chinese family. Mitochondrion, 2007, 7(1-2): 140-146.
[11] 冀延春, 刘晓玲, 赵福新, 张娟娟, 章豫, 周翔天, 瞿佳,管敏鑫. 线粒体T12338C突变可能是与Leber遗传性视神经病变相关的突变位点. 遗传, 2011, 33(4): 322-328.
[12] Zhang JJ, Zhou XT, Zhou J, Li CW, Zhao FX, Wang Y, Meng YZ, Wang JY, Yuan MX, Cai WS, Tong Y, Sun YH, Yang L, Qu J, Guan MX. Mitochondrial ND6 T14502C variant may modulate the phenotypic expression of LHON-associated G11778A mutation in four Chinese families. Biochem Biophys Res Commun, 2010, 399(4): 647-653.
[13] Tong Y, Mao Y, Zhou X, Yang L, Zhang J, Cai W, Zhao F, Wang X, Lu F, Qu J, Guan MX. The mitochondrial tRNAGluA14693G mutation may influence the phenotypic manifestation of ND1 G3460A mutation in a Chinese family with Leber’s hereditary optic neuropathy. Biochem Biophys Res Commun, 2007, 357(2): 524-530.
[14] 张永梅, 冀延春, 刘晓玲, 周翔天, 赵福新, 孙艳红, 韦企平, 张娟娟, 刘燕, 瞿佳, 管敏鑫. 线粒体 tRNAGluA14693G可能是与Leber遗传性视神经病变相关的基因突变. 遗传, 2010, 32(4): 353-359.
[15] Li RH, Qu J, Zhou XT, Tong Y, Hu YW, Qian YP, Lu F, Mo JQ, West CE, Guan MX. The mitochondrial tRNAThrA15951G mutation may influence the phenotypic expression of the LHON-associated ND4 G11778A mutation in a Chinese family. Gene, 2006, 376(1): 79-86.
[16] Newman N J. Leber hereditary optic neuropathy: bad habits, bad vision. Brain, 2009, 132(Pt 9): 2306-2308.
[17] Kirkman MA, Yu-Wai-Man P, Korsten A, Leonhardt M, Dimitriadis K, De Coo IF, Klopstock T, Chinnery PF. Gene environment interactions in Leber hereditary optic neuropathy. Brain, 2009, 132(Pt 9): 2317-2326.
[18] Charlmers RM, Harding AE. A case-control study of Leber’s hereditary optic neuropathy. Brain, 1996, 119(Pt 5): 1481-1486.
[19] Hudson G, Carelli V, Spruijt L, Gerards M, Mowbray C, Achilli A, Pyle A, Elson J, Howell N, La Morgia C, Valentino ML, Huoponen K, Savontaus ML, Nikoskelainen E, Sadun AA, Salomao SR, Belfort R Jr, Griffiths P, Man PY, de Coo RF, Horvath R, Zeviani M, Smeets HJ, Torroni A, Chinnery PF. Clinical expression of Leber hereditary optic neuropathy is affected by the mitochondrial DNA-haplogroup background. Am J Hum Genet, 2007, 81(2): 228-233.
[20] Ji Y, Zhang AM, Jia X, Zhang YP, Xiao X, Li S, Guo X, Bandelt HJ, Zhang Q, Yao YG. Mitochondrial DNAhaplogroups M7b1’ 2 and M8a affect clinical expression of leber hereditary optic neuropathy in Chinese families with the m. 11778G-->A mutation. Am J Hum Genet, 2008, 83(6): 760-768.
[21] Brown MD, Torroni A, Reckord CL, Wallace DC. Phy-logenetic analysis of Leber's hereditary optic neuropathy mitochondrial DNA's indicates multiple independent oc-currences of the common mutations. Hum Mutat, 1995, 6(4): 311-325.
[22] Rieder MJ, Taylor SL, Tobe VO, Nickerson DA. Automating the identification of DNA variations using quality-based fluorescence re-sequencing: analysis of the human mitochondrial genome. Nucleic Acids Res, 1998, 26(4): 967-973.
[23] Andrews RM, Kubacka I, Chinnery PF, Lightowlers RN, Turnbull DM, Howell N. Reanalysis and revision of the Cambridge reference sequence for human mitochondrial DNA. Nat Genet, 1999, 23(2): 147.
[24] Tanaka M, Cabrera VM, González AM, Larruga JM, Takeyasu T, Fuku N, Guo LJ, Hirose R, Fujita Y, Kurata M, Shinoda K, Umetsu K, Yamada Y, Oshida Y, Sato Y, Hattori N, Mizuno Y, Arai Y, Hirose N, Ohta S, Ogawa O, Tanaka Y, Kawamori R, Shamoto-Nagai M, Maruyama W, Shimokata H, Suzuki R, Shimodaira H. Mitochondrial genome variation in eastern Asia and the peopling of Japan. Genome Res, 2004, 14(10A): 1832-1850.
[25] Kong QP, Bandelt HJ, Sun C, Yao YG, Salas A, Achilli A, Wang CY, Zhong L, Zhu CL, Wu SF, Torroni A, Zhang YP. Updating the East Asian mtDNA phylogeny: a prerequisite for the identification of pathogenic mutations. Hum Mol Genet, 2006, 15(13): 2076-2086.
[26] Kaewsutthi S, Phasukkijwatana N, Joyjinda Y, Chuenkongkaew W, Kunhapan B, Tun AW, Suktitipat B, Lertrit P. Mitochondrial haplogroup background may influence Southeast Asian G11778A Leber hereditary optic neuropathy. Invest Ophthalmol Vis Sci, 2011, 52(7): 4742-4748.
[27] Phasukkijwatana N, Kunhapan B, Stankovich J, Chuenkongkaew WL, Thomson R, Thornton T, Bahlo M, Mushiroda T, Nakamura Y, Mahasirimongkol S, Tun AW, Srisawat C, Limwongse C, Peerapittayamongkol C, Sura T, Suthammarak W, Lertrit P. Genome-wide linkage scan and association study of PARL to the expression of LHON families in Thailand. Hum Genet, 2010, 128(1): 39-49.
[28] Zhang AM, Jia X, Zhang QJ, Yao YG. No association between the SNPs (rs3749446 and rs1402000) in the PARL gene and LHON in Chinese patients with m. 11778G>A. Hum Genet, 2010, 128(4): 465-468.
[29] Ji Y, Jia X, Li S, Xiao X, Guo X, Zhang Q. Evaluation of the X-linked modifier loci for Leber hereditary optic neuropathy with the G11778A mutation in Chinese. Mol Vis, 2010, 16(47): 416-424.
(责任编委: 夏昆)
The analysis of mitochondrial DNA haplogroups and variants for Leber’s hereditary optic neuropathy in Chinese families carrying the m.14484T>C mutation
Xiangjuan Meng1,2, Jinping Zhu1,2, Min Gao1,2, Sai Zhang1,2, Fuxin Zhao2, Juanjuan Zhang5, Xiaoling Liu2, Qiping Wei3, Yi Tong2, Minglian Zhang4, Jia Qu2, Minxin Guan1,5
1. Zhejiang Provincial Key Laboratory of Medical Genetics, Attardi Institute of Mitochondrial Biomedicine, Wenzhou Medical University, Wenzhou 325035, China;
2. School of Ophthalmology and Optometry, Wenzhou Medical University, Wenzhou 325027, China;
3. Dongfang Hospital, Beijing University of Chinese Medicine and Pharmacology, Beijing 100078, China;
4. Xingtai Eye Hospital, Hebei Province, Xingtai 054001, China;
5. Institute of Genetics, Zhejiang University, Hangzhou 310023, China
The m.14484T>C mutation in mitochondrial ND6 gene (MT-ND6) is a primary mutation underlying the development of Leber’s hereditary optic neuropathy (LHON) , but by itself not enough to cause visual loss. To explore the role of mitochondrial haplogroups on the expression of LHON for the people carrying the m.14484T>C mutation, we performed systematic and extended mutational screening of MT-ND6 gene in a cohort of 1177 Han Chinese patients with LHON. A total of 67 affected subjects carried the homoplasmic m.14484T>C mutation, accounting for 5.7% of this LHON population. The penetrances of optic neuropathy among 51 pedigrees carrying the m.14484T>C mutation ranged from 5.6% to 100.0%, with the average of 21.5%. The sequence analysis of entire mitochondrial genomes of 51 probands exhibited distinct sets of polymorphisms belonging to 18 Eastern Asian haplogroups. The frequencies of haplogroup A and haplogroup F were significantly less in the LHON mtDNA samples than those in 106 Chinese controls. On the other hand, the haplogroup M10a accounted for 9.8% of the patient’s mtDNA samples but was absent in 106 Chinese controls. Strikingly, the average penetrance (46.13%) of optic neuropathy for the pedigrees carrying mitochondrial haplogroup M10a was higher than those carrying other mtDNA haplogroups. These observations indicated that mitochondrial haplogroup M10a may increase the risk of visual loss.
Leber’s hereditary optic neuropathy(LHON); mitochondrial; mutation; haplogroup; penetrance
2013-09-23;
2013-10-28
国家自然科学基金项目(编号:81200724), 国家科技支撑计划(编号:2012BAI09B03)和温州医科大学附属眼视光医院创新引导课题(编号:YNCX201010)资助
孟祥娟, 在读硕士研究生, 专业方向:临床检验诊断学。E-mail: xiangjuanmeng002@163.com
管敏鑫, 教授, 博士生导师, 研究方向:人类遗传学和线粒体病。E-mail: gminxin88@zju.edu.cn
10.3724/SP.J.1005.2014.0336
时间: 2013-12-30 18:17:41
URL: http://www.cnki.net/kcms/detail/11.1913.R.20131230.1817.001.html

