山奈酚对慢性脑缺血大鼠星型胶质细胞和轴突的影响
余录,胡光强,李永杰,陈碧琼(泸州医学院:化学教研室;解剖教研室;药物与功能性食品研究中心,四川泸州646000)
山奈酚对慢性脑缺血大鼠星型胶质细胞和轴突的影响
余录,胡光强1,李永杰2,陈碧琼
(泸州医学院:化学教研室;1解剖教研室;2药物与功能性食品研究中心,四川泸州646000)
目的:观察山奈酚对慢性脑缺血大鼠胶质纤维酸性蛋白(glialfibrillary acidic Protein,GFAP)和β淀粉样前体蛋白(βam yloid PrecursorProtein,β-APP)的影响,探讨其对星型胶质细胞和轴突的作用。方法:将大鼠随机分为假手术组、模型组、山奈酚治疗组,采用双侧颈总动脉结扎建立大鼠慢性脑缺血模型,用免疫组织化学法检测大鼠脑组织GFAP和β-APP的表达。结果:与假手术组比较,模型组GFAP和β-APP阳性表达显著增加(P<0.01),而山奈酚治疗组显著减少GFAP和β-APP的过度表达,较之于模型组有明显的改善(P<0.05)。结论:山奈酚对慢性脑缺血损伤大鼠星型胶质细胞和轴突具有保护作用。
山奈酚;慢性脑缺血;星型胶质细胞;轴突
慢性脑缺血是指各种原因引发的长期脑血流灌注不足,在阿尔茨海默病(Alzheimer'sdisease,AD)、血管性痴呆(vascular dementia,VD)等中枢神经系统疾病的发生发展过程中起着重要的作用。在中枢神经系统疾病的治疗中,神经元的保护一直是主轴。但是,随着近年来的研究发展,胶质细胞、轴突等营养、支持结构的保护受到国内外学者的广泛关注,即提倡既要保护脑灰质,也要保护脑白质的全脑保护概念[1]。山奈酚(Kaempferol)属于黄酮醇类,是一种植物雌激素,主要来源于姜科植物山奈的根茎,也广泛存在于多种水果、蔬菜中,具有抗癌、降糖等多种药理学效应[2-3],在中枢神经系统疾病如脑缺血的研究中也显示其有效性,但目前尚无其在缺血后脑白质部分作用的研究。本研究通过双侧颈总动脉结扎(bilateralcommon carotid artery occlusion,BCCAO)建立大鼠慢性脑缺血损伤模型,探讨山奈酚对星形胶质细胞和轴突的保护作用。
1 材料与方法
1.1 药物与试剂
山奈酚由成都曼斯特生物科技有限公司提供(纯度大于或等于98%,淡黄色粉末,批号:MUST-12102503),GFAP、β-APP多克隆抗体(武汉博士德生物工程有限公司),生物素化羊抗兔IgG、SABC试剂盒(武汉博士德生物工程有限公司),其他试剂均为国产分析纯。
1.2 实验动物及分组
雄性Wistar大鼠,体重180~220g,购自重庆滕鑫生物技术有限公司,随机分为3组:假手术组,模型组和山奈酚治疗组(15mg/kg,ip)。山奈酚溶解于二甲基亚砜(DMSO),假手术组和模型组给予等体积的溶媒,均于术后2 h至3周每日定时给予。死亡大鼠剔除,并进行相应补充。
1.3 BCCAO模型的建立
参照de la Torre等[4]的方法制作大鼠慢性脑缺血模型。用10%水合氯醛(350mg/kg)腹腔注射(ip)将大鼠麻醉,仰卧固定于手术台上,从颈部正中切口,依次结扎左右两侧颈总动脉,假手术组只分离动脉不结扎,术中用红外线灯照射保持大鼠体温在37℃。1.4组织切片的制备
每组5只大鼠,术后21 d用冰冻的PBS溶液及4%的多聚甲醛溶液灌流取脑,用10%中性甲醛固定48h,从大脑前囟-0.26mm处向后切取厚约3mm的冠状脑组织,石蜡包埋,制作脑部冠状切片,厚度约5μm,用于免疫组织化学染色。
1.5 GFAP和β-APP免疫组化检测
免疫组织化学染色采用SABC法。将石蜡切片在55℃烤3 h,二甲苯脱蜡、梯度乙醇中复水,3%的H2O2灭活内源性过氧化物酶,然后用微波在98℃进行抗原修复10min,再用5%BSA封闭,加稀释的一抗(GFAP和β-APP)于37℃孵育2 h,继而移置于4℃冰箱过夜。次日加二抗孵育1 h、清洗,滴加SABC,37℃孵育1h后,清洗。然后用DAB显色、苏木素进行复染以及盐酸酒精进行分化、再用自来水返蓝、脱水封片。
1.6 图像分析和统计学处理
免疫组化染色后,在400倍光学显微镜下,每张切片取同侧额叶皮层区计算每0.25mm2区域额叶皮层区GFAP阳性表达数。β-APP阳性轴突在每张胼胝体固定位置选取3个不重叠的区域采图,采集图片用ImagePro-plus5.0软件分析计算免疫反应阳性的累积光密度值(IOD)。所有实验数据以Mean±SD表示,实验结果用SPSS16.0软件进行统计分析,组间比较采用单因素方差分析的方法进行,P<0.05为有统计学意义。
2 结果
2.1 山奈酚对BCCAO大鼠胼胝体β-APP表达的影响
本实验发现,假手术组基本无β-APP轴突染色,模型组的β-APP阳性表达主要聚集于脑白质区域的胼胝体和内囊,少量出现在皮层。而山奈酚治疗组减少胼胝体β-APP的聚集(图1A1~C1)。通过统计分析,治疗组与模型组的IOD比较差异有统计学意义(P<0.05,表1)。
表1 山奈酚对BCCAO大鼠GFAP、β-APP表达的影响(s,n=5)

表1 山奈酚对BCCAO大鼠GFAP、β-APP表达的影响(s,n=5)
注:与模型组比较,a P<0.05;b P<0.01
组别假手术组模型组山奈酚治疗组(15mg/kg)GFAP阳性细胞数/0.25mm215.00±2.38b88.25±13.46 36.48±10.51aβ-APP(IOD)2772.42±546.48b10598.53±2369.23 5492.19±1590.51a
2.2 山奈酚对BCCAO大鼠额叶皮层GFAP表达的影响
免疫组化染色显示,GFAP阳性细胞呈棕黄色。假手术组有少量正常的GFAP阳性细胞表达,胞体较小、分支较细。而模型组GFAP阳性细胞数量增多,且体积增大,突起多而粗;与模型组相比,山奈酚处理明显减少星形胶质细胞的活化,减轻胶质瘢痕的形成(图1A2~C2)。统计学结果显示:与模型组比较,山奈酚显著降低GFAP阳性细胞的表达,在细胞数量上有统计学意义(P<0.05,表1)。
3 讨论
慢性脑缺血的组织病理学改变主要表现为胶质细胞的增生活化、轴突变性、脱髓鞘等。星形胶质细胞是脑中分布最多、体积最大的一类细胞,占神经细胞的50%~60%,在中枢神经系统扮演重要角色,它具有支持、营养和稳定内环境的作用,其终足与神经元、血管之间形成双向通信。在慢性脑缺血的进程中,星形胶质细胞增生形成胶质瘢痕,进一步加重脑缺血白质的病理损伤[5]。同时,星形胶质细胞为轴突提供能量支持并影响突触的生理活动[6],而轴突是实现中枢信号传递的主要渠道,它将细胞体发出的神经冲动传递给其它神经元或分布在肌肉或腺体的效应器。多项研究表明,轴突损伤是中枢神经系统疾病的预警器[7],因此,本实验研究选取星形胶质细胞和轴突作为治疗靶点。GFAP是星形胶质细胞特有的一种细胞骨架蛋白,是成熟的星形胶质细胞特异性的分子标志[8]。β-APP是β淀粉样蛋白(amyloidβ peptide,Aβ)的前体物质,在正常情况下,β-APP处于较低水平,但在缺血损伤、阿尔茨海默病时表达增高或由于轴突运输中断而出现聚集[9]。因此,GFAP和β-APP的表达成为衡量星形胶质细胞增生和轴突损伤的敏感指标。
已有研究表明,山奈酚能显著降低脂多糖(lipopolusaccharide,LPS)诱导的BV2小胶质细胞炎症反应,暗示其在神经炎症疾病的治疗具有潜在的可能性[10]。另外,山奈酚还能保护3-硝基丙酸引起的脑纹状体降解[11]。在脑缺血再灌注损伤中,山奈酚也显示其脑保护作用[12-13]。本实验进一步通过双侧颈总动脉结扎建立大鼠慢性脑缺血损伤模型并给予山奈酚处理,结果显示,山奈酚降低GFAP在慢性低灌注大鼠脑额叶的阳性表达,并抑制β-APP的表达,减少其在胼胝体的聚集,表明山奈酚对慢性脑缺血星形胶质细胞和轴突有保护作用,其保护机制有待进一步阐明。
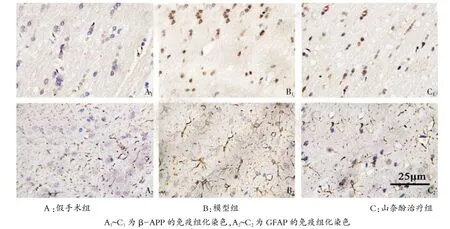
图1 GFAP和β-APP免疫组化(×400)
1.Wakita H,Tom imoto H,Akiguchi I,etal.Axonal damage and demyelination in thew hitematter after chronic cerebral hypoperfusion in the rat[J].Brain Research,2002,924(1): 63~70.
2.Nirmala P,Ramanathan M.Effect of kaempferol on lipid peroxidation and antioxidant status in 1,2-dimethyl hydrazine induced colorectalcarcinomain rats[J].Eur JPharmacol,2011,654(1):75~79.
3.Fang XK,Gao J,Zhu DN.Kaem pferoland quercetin isolated from Euonymusalatus improve glucose uptake of 3T3-L1 cellsw ithoutadipogenesisactivity[J].LifeSc,2008,82:615~622.
4.de la Torre JC,Fortin T,Park GA,etal.Chronic cerebrovascular insufficiency inducesdementia-likedeficitsin aged rats[J].Brain Res,1992,582(2):186~195.
5.W akitaH,Tom imoto H,Akiguchi I,et al.Protective effect of cyclosporinaonwhitematter changesin the ratbrain after chronic cerebralhypoperfusion[J].Stroke,1995,26:1415~1422.
6.滕厚军,赵瑛.慢性脑缺血神经胶质细胞损伤与血管性痴呆的研究进展[J].中国脑血管疾病杂志,2008,5(10): 473~476.
7.Medana IM,EsiriMM.Axonal damage:a key predictor of outcome in human CNS diseases[J].Brain,2003,126(3): 515~530.
8.Gomes FC,Paulin D,M ouraNV,etal.G lial fibrillary acidic protein(GFAP):modulation by grow th factorsand itsimp lication in astrocyte differentiation[J].Braz JMed BiolRes, 1999,32(5):619~631.
9.Gentleman SM,Nash MJ,Sweeting CJ,etal.Beta-amyloid precursorprotein(β-APP)asamarker foraxonalinjury after head injury[J].NeurosciLett,1993,160(2):139~144.
10.Park S,Sapkota K,Kim S,et al.Kaempferol acts through mitogen-activated protein kinasesand protein kinase B/Akt to elicit protection in amodelofneuroinflammation in BV2 microglialcells[J].Br JPharmacol,2011,164(3):1008~1025.
11.Lagoa R,Lopez-Sanchez C,Samhan-Arias AK,et al. Kaempferolprotectsagainst ratstriataldegeneration induced by 3-nitropropionic acid[J].J.Neurochem,2009,111(2): 473~487.
12.López-SánchezC,Martín-Romero FJ,Sun F,etal.Blood m icromolar concentrationsof kaempferol afford protection againstischemia/reperfusion-induced damage in ratbrain[J]. Brain Res,2007,1182(28):123~137.
13.何煜舟,丁美萍,汪云开,等.山萘酚对缺血再灌注脑损伤大鼠的保护作用[J].中华中医药学刊,2009,27(8):1673~1675.
(2013-10-24收稿)
Effectsofkaem p ferolon astrocytesand axonsof ratsw ith chronic cerebralischem ia
Yu Lu,HuGuangqiang1,LiYongjie2,Chen Biqiong
DepartmentofChemistry;1DepartmentofAnatomy;2DrugDiscoveryResearch Center,LuzhouMedicalCollege
Objective:Toexplore the effects of Kaempferolon astrocytesand axonsof ratswith chronic cerebral ischemia bymeasuring the expression of glial fibrillary acidic protein(GFAP)andβ-amyloid preeursor protein(β-APP).Methods:The ratswere random ly divided into sham operation group,model group and Kaempferol treated group.Chronic cerebral ischemiamodelwas performed by bilateral common carotid artery ligation(BCCAO),and the expression of GFAP andβ-APPwere observated by immunohistochemicalmethod.Resu lts:Compared with sham operation group,the expression of GFAP andβ-APP increased significantly in model group(P<0.01),while the expression ofGFAPandβ-APP in Kaempferol treated group was less than inmodelgroup(P<0.05).Conclusion: Kaempferolcan protectastrocytesand axonsof ratswith chronic cerebralischemia.
Kaempferol;Chronic cerebralischemia;Astrocytes;Axons
R741.05
A
10.3969/j.issn.1000-2669.2014.02.015
余录(1974-),女,实验师,E-mail:yulu863@sina.com

