Aβ1-42诱导HUVEC细胞凋亡最适浓度与时间选择*
蔡鹏飞,刘明华,冯林林,刘俊红,尤朝菲,章卓(泸州医学院:科技处;药学院药理教研室;中药学本科00级,四川泸州646000)
Aβ1-42诱导HUVEC细胞凋亡最适浓度与时间选择*
蔡鹏飞,刘明华1,冯林林2,刘俊红2,尤朝菲2,章卓1
(泸州医学院:科技处;1药学院药理教研室;2中药学本科2010级,四川泸州646000)
目的:探讨β样淀粉肽1-42(Aβ1-42)诱导人脐静脉血管内皮细胞株(HUVEC)细胞凋亡的最适浓度和时间。方法:体外培养HUVEC,将Aβ1-42分为5×10-4、5×10-3、5×10-2、5×10-1、5、5×10、5×102μmol/L 7个浓度,分别刺激0.5、2、6、12、24、48 h后,采用CCK-8法观察细胞活力,荧光显微镜观察Hochest33342/PI双染后细胞形态。结果:同阴性组比较,Aβ1-42浓度≥5μmol/L刺激48 h均可引起细胞活力明显下降(P<0.05)。5×10,5×102μmol/L刺激24 h可引起HUVEC细胞活力下降,但48h HUVEC细胞活力下降更明显(P<0.05)。Hochest33342/PI双染可见明显核浓缩和凋亡小体的产生,甚至出现死亡现象。结论:Aβ1-42刺激后引起HUVEC细胞活力下降呈时间与剂量依赖性,综合时间与剂量考虑,5×10μmol/L刺激24h可致理想的HUVEC细胞凋亡模型。
β样淀粉肽1-42;HUVEC细胞;细胞凋亡
β-淀粉样蛋白(β-amyloid protein,Aβ)异常沉积、细胞凋亡在阿尔茨海默病(Alzheimerdisease,AD)的发病中起着重要作用,β-淀粉样蛋白由39~43个氨基酸组成,聚集态的Aβ1-42可以导致神经细胞凋亡,损伤神经细胞[1]。血管内皮细胞衬覆于血管内壁,构成血管通透性的主要屏障,有调节细胞代谢产物、调节血管舒张、止血和趋化白细胞的作用[2]。β-淀粉样蛋白致阿尔茨海默病病人血管内皮产生炎症、凋亡在AD的发病中越来越受到重视[3],因此深入探索β-淀粉样蛋白致血管内皮细胞损伤与凋亡规律,寻找保护内皮的措施有重要意义。目前虽然有学者对Aβ1-42致人脐静脉血管内皮细胞(human umbilical vein endothelialcells,HUVEC)凋亡有少量研究,但是尚未对Aβ1-42引起HUVEC凋亡的最适时间和剂量进行研究,故本研究通过对体外培养的人脐静脉内皮细胞施以不同浓度Aβ1-42处理,检测在各时间点的细胞凋亡率,分析不同浓度Aβ1-42诱导内皮细胞凋亡的差异,为深入研究阿尔茨海默病血管内皮损伤的发病机理提供理论基础。
1 材料与方法
1.1 材料
1.1.1 试剂
Aβ1-42(北京奥普森有限公司);HUVEC细胞(泸州医学院功能性食品与药品研究中心惠赠);Annexin V-FITC细胞凋亡检测试剂盒(Keygen公司,批号20101202);Hoechst 33342以及PI(Sigma,USA);RPMI1640培养基,胎牛血清(hyclone,USA);CCK-8试剂盒(碧云天生物技术研究所)。
1.1.2 仪器
超净工作台(苏州净化设备有限公司,SW-CJ-1F型);倒置相差显微镜(日本Olympus公司,CKX41型);CO2培养箱(日本Sanyo公司,MCO-15AC型);离心机(北京医用离心机厂,LG10-3A型);酶标分析仪(北京普朗新技术有限公司,DNM-9602型);流式细胞仪(美国BD公司,SBK-YLQX-003552型)。
1.2 方法
1.2.1 CCK-8法检测HUVEC细胞活性
将Aβ1-42溶于超净水,配成500μmol/L母液分装,-20℃冻存,使用前于37℃孵育1周,使其变为聚集状态。HUVEC细胞株培养液为RPMI1640+10%胎牛血清+青链霉素,5%CO237℃培养箱中培养。每3~4 d传代1次。倒置显微镜观察细胞生长情况。
取对数生长期的HUVEC细胞,0.25%胰酶制成单个细胞悬液,细胞浓度为1×105/L接种于96孔板,每孔90μl,培养24h待其贴壁后加药。每个浓度3个复孔,Aβ1-42组(Aβ1-42+细胞)分为5×10-4、5×10-3、5×10-2、5×10-1、5、5×10、5×102μmol/L7个浓度,阴性组(细胞+培养基)加等体积RPMI1640培养基,培养时间为0.5、2、6、12、24、48h,之后每孔加入CCK-810μl继续培养1 h,酶标仪450 nm波长下检测各孔吸光度值,以OD值反应细胞活力情况,连续重复3次。
1.2.2 Hochest33342/PI双染检测HUVEC细胞凋亡
HUVEC细胞培养同1.2.1,根据1.2.1结果,选择Aβ1-425、5×10、5×102μmol/L处理24 h后Hochest33342/PI双染检测HUVEC细胞凋亡。收集细胞悬浮于1ml培养基中,加入10μl Hochest 33342储存液(100mg/L,蒸馏水溶解),染色15min;将细胞置于冰上冷却后,离心,去上清,将细胞重悬于1m lPBS中,加人5μlPI储存液(1g/L,蒸馏水溶解),混匀,荧光显微镜观察。
1.2.3 统计学处理
实验数据以x±s表示,数据分析采用单因素方差分析,组间均值比较采用SNK法。P<0.05表示差异有统计学意义。统计学数据用SPSS13.0软件分析处理。
2 结果
2.1 不同浓度Aβ1-42在不同处理时间对HUVEC细胞活力影响
不同浓度Aβ1-42处理0.5 h与2 h对HUVEC细胞活性没有明显影响,与阴性组比较无统计学差异(P>0.05);5×102μmol/LAβ1-42在处理6、12、24、48h后抑制HUVEC细胞活性,同阴性组比较有统计学意义(P<0.05),其中48 h同阴性对照组比较有显著意义(P<0.01);5×10μmol/LAβ1-42在处理24h,48h后抑制HUVEC细胞活性,同阴性组比较有统计学意义(P<0.05);5μmol/LAβ1-42处理48h抑制HUVEC细胞活性,同阴性对照组比较有统计学意义(P<0.05)。5×10-4、5×10-3、5×10-2、5×10-1μmol/LAβ1-42在各时间段对HUVEC细胞活性无明显影响(P>0.05),见图1。

图1 Aβ1-42不同浓度和不同处理时间对HUVEC细胞活力影响
2.2 不同浓度Aβ1-42诱导HUVEC细胞24 h后细胞形态变化
Hochest33342/PI双染显示,阴性对照组细胞形态呈圆形,淡蓝色,无凋亡细胞。Aβ1-425、5×10、5×102μmol/L三组细胞均可见部分呈凋亡特征性改变,细胞核呈亮蓝色染色,随浓度增加凋亡细胞较多,还可见死亡细胞(红色),见图2。
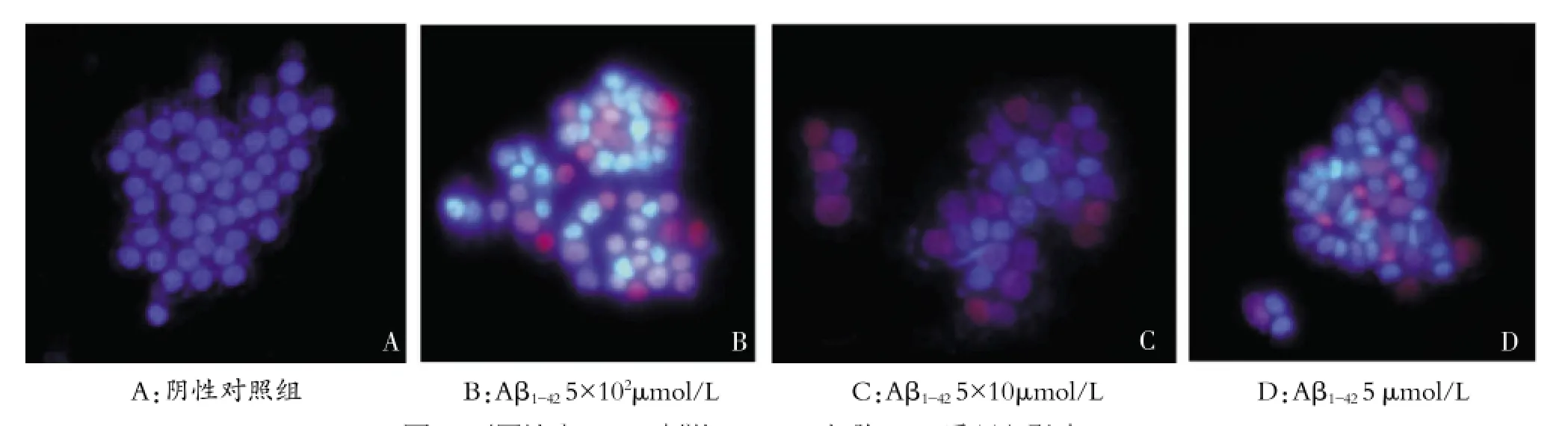
图2 不同浓度Aβ1-42刺激HUVEC细胞24 h后凋亡影响(×200)
3 讨论
阿尔茨海默病患者由于神经元营养的缺乏、缺氧、代谢物堆积、Aβ1-42沉积等出现血管内皮的损伤,Aβ1-42在毛细血管的沉积不仅造成毛细血管的闭塞,并可引起脑血流量的失调。用Aβ1-42损伤原代培养的脑微血管内皮细胞,可以造成内皮细胞连接遭到破坏,细胞连接蛋白受到损伤,毛细血管发生了变性和退化,失去了原来的形状[4-5]。Aβ1-42致HUVEC细胞凋亡可部分模拟阿尔茨海默病的血管内皮损伤,但是对于Aβ1-42刺激的时间与浓度却因实验室不同而存在差异,本实验目的在于筛选出Aβ1-42刺激HUVEC细胞建立损伤凋亡模型的最适浓度和时间。
在本实验中,选择了Aβ1-425×10-4、5×10-3、5×10-2、5×10-1、5、5×10、5×102μmol/L 7个浓度及0.5、2、6、12、24、48 h 6个时间点。实验结果显示随浓度增加和处理时间的延长,对HUVEC细胞活性影响较大。所有剂量在处理0.5h与2h后几乎对HUVEC细胞活性没有影响;5μmol/L处理48h可使HUVEC细胞活性受到影响。5×10μmol/L处理时间更短一些,24h可抑制HUVEC细胞生长;5×102μmol/L处理6 h即可抑制HUVEC细胞生长。从上述结果中我们可以看出,Aβ1-425×102μmol/L造模效果最佳,但剂量明显偏大,适合处理时间较短,经济充裕的实验;Aβ1-425×10μmol/L与5μmol/L较为合适,因此可以从经济和时间角度上可以考虑Aβ1-425×10μmol/L刺激24 h造模或者5μmol/L刺激48 h。从Hochest 33342/PI双染结果显示,Aβ1-425、5×10、5×102μmol/L刺激24 h后即可见部分呈凋亡特征性改变,5×10、5×102μmol/L凋亡细胞更多,5×102μmol/L则死亡细胞较多。
综上,Aβ1-42刺激后引起HUVEC细胞活力下降呈时间与剂量依赖性,本实验综合凋亡结果、经济性、时间等多种因素认为,Aβ1-425×10μmol/L刺激24h是致HUVEC细胞凋亡的理想剂量和时间。
1.Ma JF,W ang HM,LiQY,etal.Starvation triggersAbeta42 generation from humanumbilicalvascularendothelialcells[J]. FEBSLett,2010,584(14):3101~3106.
2.Yu H,Yang M,W ang Y,etal.p75NTR ismainly responsible for Aβtoxicity but not for its internalization:a primary study[J].NeurolSci,2012,33(5):1043~1050.
3.Belyaev ND,NalivaevaNN,Makova NZ,etal.Neprilysin gene expression requires binding of the amyloid precursor protein intracellular domain to itspromoter:implications for Alzheimerdisease[J].EMBO Rep,2009,10(1):94~100.
4.Thal DR,Capetillo-Zarate E,Larionov S,et al.Capillary cerebralamyloid angiopathy isassociated w ith vessel occlusionand cerebralblood flow disturbances[J].NeurobiolAging,2009,30(12):1936~1948.
5.SoniaM arco,Stephen D.Skaper Am yloid-peptide l-42 alters tight junction protein distribution and expression in brain m icrovessel endothelial cells[J].Neuroscience Letters,2006,401:219~224.
(2013-9-26收稿)
Screen of theoptim alconcentration and incubution tim eofAβ1-42in inducingapoptosisofHUVEC cell
CaiPengfei,LiuMinghua1,Feng Linlin2,Liu JunHong2,You Caofei2,Zhang Zhuo1
Department of Science and Technology;1Department of Pharmacology;2Undergraduate of Luzhou Medical CollegeChineseMateriaMedicaClass2010,LuzhouMedicalCollege
Objective:To screen the optimal concentration and incubation time ofβ-amyloid 1-42 in inducing apoptosis of Human umbilical vein endothelial cells(HUVEC).Methods:HUVEC were cultivated in vitro.β-amyloid 1-42 was diluted into 5×10-4,5×10-3,5×10-2,5×10-1,5,5×10,5×102μmol/L;the incubation time was set at 0.5,2,6,12,24 and 48 h.The cell viability was observed by CCK-8 and the cell morphology was observed by fluorescencemicroscopy after dyeing with Hochest33342/PI.Resu lts:Compared with negative control group,cell viability of all the groups with Aβ1-42≥5μmol/L after stimulating 48 hours was decreased significantly(P<0.05).The viability of HUVEC incubated with 5×10 and 5×102μmol/Lβ-amyloid 1-42 for 24 hours or 48 hourswas decreased significantly(P<0.05).The nuclear enrichmentand apoptotic body could be observed by Hochest33342/PI.Conc lusion:HUVEC cell viability decreased in a time and dose related way after incubated withβ-amyloid1-42.Considering of the time and dose comprehensively, incubation with 5×10μmol/Lβ-amyloid 1-42 for 24 hours can establish the idealmodel ofHUVEC apoptosis.
β-amyloid 1-42;HUVEC;Apoptosis
R967
A
10.3969/j.issn.1000-2669.2014.02.012
*四川省教育厅课题(102c099);泸州市科技局课题(2012s36)作者简介:蔡鹏飞(1981-),男,讲师,E-mail:35989298@qq.com
章卓(1979-),男,副教授,E-mail:zhhuozhang-100@163.com

