盐酸小檗碱-羟丙基-β-环糊精包合物的制备、表征及溶出度研究
张锴,陈小慧,杨群1,#(1.太极集团浙江东方制药有限公司,浙江 绍兴 31000;.绍兴文理学院元培学院,浙江 绍兴 31000)
盐酸小檗碱临床广泛用于治疗胃肠炎、细菌性痢疾、急性扁桃体炎等多种疾病。随着对盐酸小檗碱的药理研究日益深入,研究者发现盐酸小檗碱还具有治疗糖尿病、降血脂、抗肿瘤、抗抑郁等作用,其代表制剂有盐酸小檗碱片和盐酸小檗碱胶囊[1-7]。盐酸小檗碱微溶于水或乙醇,易溶于热水,味极苦,不利于口服,不利于临床应用[8]。羟丙基-β-环糊精(HP-β-CD)是β-CD的衍生物,比β-CD具有更高的水溶性、安全性和更低的肾毒性[9]。HP-β-CD较大的空穴结构,可使其依据范德华力将疏水性药物容纳在内,形成分子囊,增大难溶性药物溶解度,提高其生物利用度,掩盖药物的不良气味或味道,降低药物的刺激性及毒副作用等[10]。故本试验选择HP-β-CD作为包合材料制备盐酸小檗碱-HP-β-CD包合物,以提高其溶出度,并对其进行表征。
1 材料
1.1 仪器
UV-2102PCS型紫外-可见分光光度计[尤尼柯(上海)仪器有限公司];JSM-840型扫描电子显微镜(日本Jeol公司);D/MAX2500型X射线衍射仪(日本理学公司);ZRC-8ST溶出仪(天津创兴电子设备制造有限公司)。
1.2 药品与试剂
盐酸小檗碱对照品(中国食品药品检定研究院,批号:110713-200609,纯度:≥99.6%);盐酸小檗碱原料药(四川什邡华安药物原料有限公司,批号:110713-200910,纯度:99%);HP-β-CD(山东滨州智源生物科技有限公司,药用级);盐酸小檗碱-HP-β-CD包合物(绍兴文理学院元培学院药剂实验室自制,批号:131201,规格:0.17 g/g);水为蒸馏水,无水乙醇等为分析纯。
2 方法与结果
2.1 检测波长的选择
精密称取盐酸小檗碱对照品10 mg,置于10 ml量瓶中,用水溶解并稀释至刻度;精密量取1 ml,置于100 ml量瓶中,加水稀释至刻度,制得质量浓度为10µg/ml的溶液。同法配制HP-β-CD溶液。以水为空白,在200~400 nm波长范围内对盐酸小檗碱溶液、HP-β-CD溶液分别进行紫外扫描。结果盐酸小檗碱分别在226、263、344 nm波长处有较大吸收,而HP-β-CD在该波长范围内无吸收,因考虑226 nm有末端吸收误差,故选择263 nm作为检测波长。紫外吸收光谱图见图1。
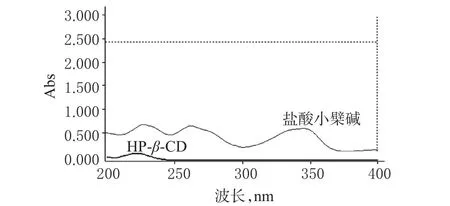
图1 紫外吸收光谱图Fig 1 UV absorbance spectrum
2.2 方法学考察
精密称取盐酸小檗碱对照品9 mg,置于100 ml量瓶中,加水溶解并稀释至刻度;精密量取1.0、1.5、2.2、2.5、3.0 ml,分别置于50 ml量瓶中,加水稀释至刻度,摇匀,在263 nm波长处测定吸光度。以吸光度(A)为纵坐标、质量浓度(c)为横坐标进行回归分析,得回归方程A=0.0551c+0.00154(r=0.9998),结果表明,盐酸小檗碱检测质量浓度的线性范围为1.8~5.4 μg/ml。取盐酸小檗碱10 mg,加入处方量HP-β-CD,测定吸光度,计算平均回收率为100.49%,RSD为0.25%(n=6)。
2.3 盐酸小檗碱与HP-β-CD的包合摩尔比的测定
精密称取HP-β-CD加水配制成浓度分别为0、1.74×10-4、3.45×10-4、6.93×10-4、13.81×10-4、27.6×10-4mol/L的溶液,分别量取适量置于锥形瓶中,加入过量的盐酸小檗碱,密闭,在30、40、50℃恒温空气震荡箱中震荡72 h,待固液平衡后,取上清液用0.45µm微孔滤膜滤过,滤液用水稀释适当倍数,在263 nm波长处测定吸光度,代入标准曲线计算盐酸小檗碱浓度。以HP-β-CD的浓度(x)为横坐标、盐酸小檗碱浓度(y)为纵坐标,绘制平衡相溶解度曲线,计算各包合温度下的回归方程。结果盐酸小檗碱的相溶解度方程分别为:30℃时y=0.05294x+0.0001(r=0.9970)、40 ℃时y=0.0563x+0.0001(r=0.9919)、50 ℃时y=0.116x+0.0002(r=0.9907),表明各温度下盐酸小檗碱溶解度随HP-β-CD浓度的增加均呈线性增加。该体系相溶解度曲线方程均为典型的AL型,即体系中形成了1∶1包合物。
2.4 包合过程中的热力学参数的测定
根据“2.3”项30、40、50℃下的平衡相图回归方程的截距和斜率可计算各温度下包合作用的表观稳定常数KC[KC=斜率/截距(1-斜率)]。根据Gibbs定律,lnKC=-ΔH/(RT)+ΔS/R,式中R为摩尔气体常数,T为热力学温度;以lnKC对1/T作回归方程,由斜率和截距计算包合反应的热焓值(ΔH)和熵值(ΔS),再根据公式ΔG=ΔH-TΔS,计算反应自由能,结果见表1。

表1 盐酸小檗碱与HP-β-CD包合过程的热力学参数Tab 1 The thermodynamic parameters of the inclusion reaction of berberine hydrochloride with HP-β-CD
KC是衡量包合物稳定性的重要参数,溶液中游离药物与被包合药物间存在动态平衡,KC越大,HP-β-CD对盐酸小檗碱稳定作用越强,因此本文选择50℃作为包合温度。
2.5 包合物的制备
用喷雾干燥法,按1∶1摩尔比分别称取盐酸小檗碱与HP-β-CD 30 g,加入适量热水使溶解,搅拌下将盐酸小檗碱溶液缓慢滴加到HP-β-CD溶液中,50℃下搅拌2 h,用0.45 μm微孔滤膜滤过。将滤液用喷雾干燥仪进行喷雾干燥(操作参数:进风温度170℃,喷雾速度10 r/min,喷雾压力0.8 MPa,出风温度70~80℃),得盐酸小檗碱-HP-β-CD包合物,置于干燥器中保存,备用。
2.6 物理混合物的制备
按1∶1摩尔比称取盐酸小檗碱与HP-β-CD适量,混合均匀,置于干燥器中保存,即为盐酸小檗碱与HP-β-CD的物理混合物,记为PM,备用。
2.7 包合物溶出度考察
精密称取盐酸小檗碱原料药、盐酸小檗碱-HP-β-CD包合物及PM(约相当于盐酸小檗碱20 mg),照溶出度测定法第二法[1],以1000 ml水为溶出介质,温度(37±0.5)℃,转速120 r/min,依法操作。在5、10、20、30、45、60 min时取样,每次5 ml(即时补充同温溶出介质5 ml),经0.45 μm微孔滤膜滤过,取续滤液3 ml,置于10 ml量瓶中,加水定容,摇匀。以水为空白,在263 nm波长处测定吸光度,代入回归方程计算各时间点盐酸小檗碱的含量,再计算累积溶出度,溶出曲线见图2。
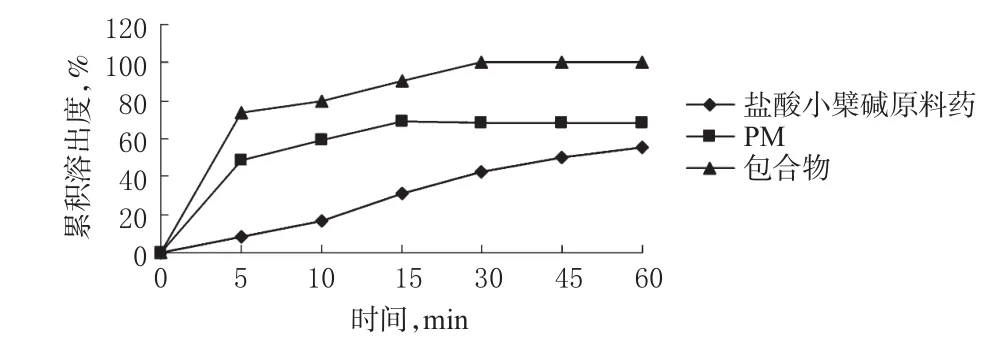
图2 3种样品的累积溶出曲线Fig 2 Accumulative release curves of 3 kinds of samples
从图2可知,盐酸小檗碱原料药在介质中的溶出度较差,60 min的溶出度仅为55.18%。PM中由于水溶性辅料的存在,改善了药物的表面润湿性,对药物的溶出有所改善,60 min的溶出度为68.11%。盐酸小檗碱-HP-β-CD包合物显著提高了药物的溶出度,30 min的溶出度已达到100%。
2.8 包合物的物相鉴定
2.8.1 X射线衍射法。将盐酸小檗碱原料药、HP-β-CD、盐酸小檗碱-HP-β-CD包合物及PM分别进行X射线衍射测试,得到X衍射图谱。工作条件:Cu-Ka,管电流40 mA,高压强度40 kV,衍射角2θ,扫描步距0.026°,测定范围3~60°,连续扫描。X射线衍射图见图3。
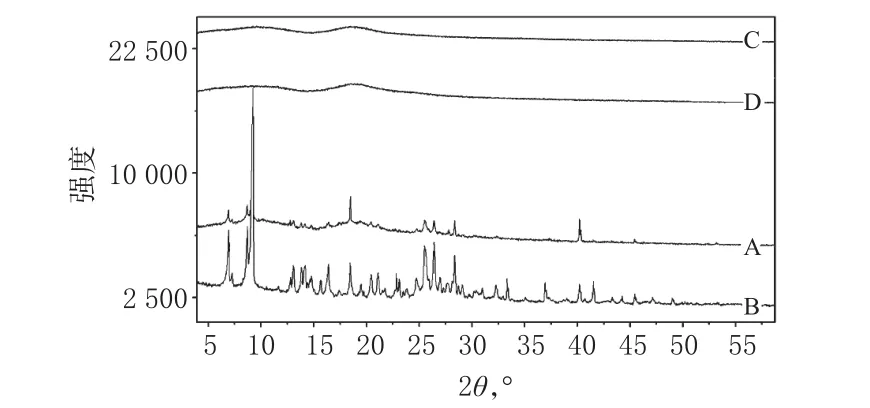
图3 4种样品的X射线衍射图A.PM;B.盐酸小檗碱原料药;C.HP-β-CD;D.包合物Fig 3 X-ray diffraction pattern of 4 kinds of samplesA.physical mixture;B.berberine hydrochloride raw material;C.HP-β-CD;D.inclusion compound
由图3可见,盐酸小檗碱以高结晶态存在;HP-β-CD为无定形粉末;PM为盐酸小檗碱和HP-β-CD二者峰的叠加;包合物中盐酸小檗碱的晶体衍射峰均消失,表明形成了一种新的物相,盐酸小檗碱分子进入HP-β-CD分子的空穴结构中,药物已经被包合,使药物结晶受到抑制,因此无结晶衍射峰。
2.8.2 扫描电子显微镜法。取盐酸小檗碱原料药、HP-β-CD、盐酸小檗碱-HP-β-CD包合物及PM,分别固定于样品台上,用扫描电子显微镜进行验证,观察并记录样品图像,结果见图4。

图4 4种样品的扫描电镜图A.盐酸小檗碱原料药;B.HP-β-CD;C.PM;D.包合物Fig 5 Scanning electron microscope of 4 kinds of samplesA.berberine hydrochloride raw material;B.HP-β-CD;C.physical mixture;D.inclusion compound
由图4可见,盐酸小檗碱呈柱状或片状结晶;HP-β-CD呈现带孔洞的圆球状结构;PM中盐酸小檗碱以结晶形式分散在载体材料HP-β-CD中,二者互不影响;盐酸小檗碱-HP-β-CD包合物中,包合物呈规则多面体,盐酸小檗碱的柱状或片状结晶和HP-β-CD的圆球状结构均消失,表明盐酸小檗碱被HP-β-CD包合后形成了新的物相,确证了包合物的形成。而且盐酸小檗碱制成包合物后粒径变小,小于盐酸小檗碱原料药及HP-β-CD的粒径,即表面积增大;同时由于药物晶体消失,主要以分子状态或无定形状态分散,药物溶出需要的能量少,这可能也是其体外溶出度提高的一个重要原因。
3 讨论
本试验选择喷雾干燥法制备盐酸小檗碱-HP-β-CD包合物,有其独特的优势。传统饱和水溶液法、研磨法、超声波法制得的包合物溶液浓缩过程中黏度较高,导致干燥温度较高、时间较长。冷冻干燥法周期长、能耗大。而喷雾干燥法具有以下优点:(1)避免高温操作,保护热敏性药物;(2)喷出雾滴瞬间干燥,保证了药物的高度分散性,增大制剂的比表面积,从而能更大程度地改善其溶出;(3)工艺重现性好,药物溶出快,直接获得疏松的干燥品,包合物粒子无需再粉碎过筛;(4)产量大,利于工业化大生产。故其是一种较理想的包合物的制备方法。
相溶解度结果表明,包合物相溶解度曲线为AL型,经计算KC均大于500 L/mol,表明HP-β-CD适宜于用来包合盐酸小檗碱。
本试验制备并鉴定了盐酸小檗碱-HP-β-CD包合物,结果表明可使盐酸小檗碱在水中溶出度大大增加。
[1]国家药典委员会.中华人民共和国药典:二部[S].2010年版.北京:中国医药科技出版社,2010:639、640-641、附录85.
[2]廖璞,马永鹏.盐酸小檗碱对表皮葡萄球菌生物被膜形成抑制的研究[J].临床检验杂志,2011,29(4):272.
[3]舒德忠,周岐新.盐酸小檗碱对小鼠实验性溃疡性结肠炎的作用研究[J].四川生理科学杂志,2004,26(4):188.
[4]呼自顺,陈宇洲,王垮.盐酸小檗碱泊洛沙姆188固体分散体的制备[J].中国药房,2010,21(11):990.
[5]韩有为,周苏宁.黄连素的心血管药理研究进展[J].中西医结合心脑血管病杂志,2010,8(3):340.
[6]尤静,余丽丽,杨黎燕.盐酸小檗碱-环糊精微球的制备及体外释药研究[J].应用化工,2013,42(3):447.
[7]Park KS,Kim JB,Bae J,et al.Berberine inhibited the growth of thyroid cancer cell lines 8505C and TPC1[J].Yonsei Med J,2012,53(2):346.
[8]许成山,周克元.小檗碱抗肿瘤作用研究进展[J].现代肿瘤医学,2009,17(1):147.
[9]陶涛.羟丙基-β-环糊精的特性及其药剂学应用[J].中国医药工业杂志,2002,33(6):304.
[10]崔福德.药剂学[M].7版.北京:人民卫生出版社,2011:356.

