松果菊苷对血管性痴呆大鼠氧化应激损伤的保护作用
马婧怡,张万鑫,陈 虹,姜 勇,屠鹏飞,丁 慧
(1.石河子大学药学院教育部新疆特种植物药资源重点实验室,新疆石河子 832002;2.北京大学中医药现代研究中心,北京 100083)
松果菊苷(echinacoside,ECH)是从新疆特色植物管花肉苁蓉中分离、纯化的一种苯乙醇苷类化合物。研究显示,松果菊苷醇提取物可刺激巨噬细胞产生大量免疫增效因子,如肿瘤坏死因子、白介素Ⅰ、白介素Ⅱ等。另外,松果菊苷对神经细胞、内皮细胞的缺氧性损伤亦有明显保护作用[1],能够改善学习记忆能力[2]、抗衰老[3]。血管性痴呆(vascular dementia,VD)是继阿尔采末病(Alzheimer′s disease,AD)之后导致痴呆的第二位常见原因,它是指脑血管病变引起脑损害后所导致的痴呆,以记忆、认知功能缺损为主,同时还伴有语言、运动、视空间障碍以及人格障碍[4]。随着VD发病率日益增高,给病人自身以及家属乃至社会都带来了沉重的负担。由于其病因的复杂性,至今尚无特效药物及治疗手段。本实验通过观察ECH对大鼠大脑皮层及海马组织匀浆中GSH、NO含量,GSH-Px、NOS活力以及海马组织CA1区组织结构的影响,旨在探讨其对抗VD,改善VD大鼠学习记忆能力的可能机制。
1 材料与方法
1.1 主要药品及试剂 ECH由北京大学药学院屠鹏飞教授提供(纯度95%以上),氢溴酸加兰他敏标准品(中国食品药品检定研究院,100050-200802),GSH、GSH-Px、NO、NOS试剂盒(南京建成生物工程研究所),水合氯醛(天津市福晨化学试剂厂),多聚甲醛(天津市科密欧化学试剂有限公司)。
1.2 主要仪器 十万分之一天平(日本A&G有限公司,HM-202型),Millipore超纯水系统,精密电热恒温水浴锅(江苏金坛市医疗仪器厂,HHS型),高速冷冻离心机(上海安亭科学仪器厂),Varioskan Flash 4.00.51酶标仪(美国Thermo electron公司),恒温冰冻切片机(德国Leica公司,CM3050型),倒置显微镜(德国ZEISS公司,MIC0266型)。
1.3 实验动物模型制备、分组及给药 ♂ SD大鼠,清洁级,体质量250~350 g,购自新疆维吾尔自治区实验动物研究中心,许可证编号SCXK(新)2011-0002。经Morris水迷宫筛选学习记忆能力正常的大鼠95只,其中随机选取80只采用间隔3d分2次永久性结扎大鼠双侧颈总动脉法(2-VO)制备VD模型大鼠[5];剩余15只剥离但不结扎双侧颈总动脉,作为假手术大鼠,其余步骤同模型大鼠操作。术后6周,进行水迷宫实验,筛选出50只成功的中度痴呆模型大鼠,即VD模型大鼠中各个大鼠各时段逃避潜伏期平均值与对照组大鼠逃避潜伏期平均值之差占该鼠的平均逃避潜伏期的比例在30%-40%之间的为中度痴呆大鼠[6],随机分为5组,每组10只:模型组、ECH低剂量组、ECH中剂量组、ECH高剂量组、阳性药加兰他敏组(Gal);再从15只假手术大鼠中筛选出10只作为假手术组。分组完成后,各组大鼠每天腹腔注射相应的药物或生理盐水,连续4周。① 模型组(Model):生理盐水1 ml·kg-1·d-1;②ECH低剂量组(Low dose):ECH 10 mg·kg-1·d-1;③ECH中剂量组(Middle dose):ECH 20 mg·kg-1·d-1;④ECH高剂量组(High dose):ECH 40 mg·kg-1·d-1;⑤阳性药加兰他敏组(Gal):3 mg·kg-1·d-1;⑥假手术组(Sham):生理盐水 1 ml·kg-1·d-1。
1.4 皮层与海马组织中GSH、NO含量及GSHPx、NOS活力的测定 各组随机选取8只大鼠,将大鼠断头取脑,去掉嗅球和小脑,在冰浴中迅速剥离出皮层及海马,用4℃预冷的生理盐水洗净组织表面的血液,吸干水分后分别称重,再加入4℃预冷的生理盐水经电动匀浆机于冰浴中分别制成质量分数为10%的皮层匀浆及海马匀浆。将制备好的质量分数为10%的组织匀浆于离心机2 500 r·min-1离心10 min,取上清液,采用生化方法,严格按照试剂盒说明书的要求测定GSH、NO含量及GSH-Px、NOS活力。蛋白定量采用考马斯亮蓝定量。
1.5 HE染色观察大鼠海马组织CA1区组织结构的变化 各组剩余的2只大鼠,腹腔注射质量分数为10%水合氯醛(3.5 ml·kg-1)麻醉后仰卧固定,左心室灌注生理盐水,剪破右心耳,直到右心耳流出清亮无色液体为止,后灌注质量分数为4%的多聚甲醛约500 ml。固定完毕后,迅速断头取脑,去掉嗅脑、小脑及低位脑干,取视交叉后4 mm与小脑前之间的部分,将脑组织置于质量分数为4%多聚甲醛中浸置4-6h(4℃)。将多聚甲醛浸置后的脑组织常规脱水、透明、浸蜡、包埋、连续冠状切片,每张切片厚约5μm,进行HE染色,具体过程如下:①二甲苯Ⅰ、Ⅱ分别浸泡3次,各5 min。②分别用体积分数为1,0.95,0.90,0.80的乙醇洗涤1~2 min,用自来水充分漂洗。③苏木精浸染5 min,取出,用自来水充分漂洗。④体积分数为0.01的盐酸乙醇分化15 s,自来水漂洗。⑤伊红染色3 min,自来水洗。⑥体积分数为0.80,0.90,0.95的乙醇冲洗1 min,体积分数为1的乙醇分别各浸泡3~5 min。⑦二甲苯Ⅰ、Ⅱ中分别各浸5 min,取出。⑧滴中性树胶,封片。⑨在倒置荧光相差显微镜下观察切片并拍照。1.6 统计学分析 运用SPSS 17.0软件进行统计学分析,计量数据用¯x±s表示。生化指标采用单因素方差分析后进行多组间两两比较。
2 结果
2.1 ECH对VD大鼠皮层与海马组织中 GSH、NO含量及GSH-Px、NOS活力的影响
2.1.1 ECH对各组大鼠皮层和海马中GSH含量及GSH-Px活性的影响 Tab 1结果显示:与假手术组相比,模型组、ECH低、中剂量及阳性药加兰他敏组大鼠的皮层和海马组织中的GSH含量明显降低(P<0.01),GSH-Px活性明显降低(P<0.05,P<0.01);与模型组相比,ECH中、高剂量组以及阳性药加兰他敏组大鼠的皮层和海马组织中的GSH含量明显升高(P<0.05,P<0.01),GSH-Px活性明显升高(P<0.05,P<0.01);与阳性药加兰他敏组比较,模型组及假手术组的GSH含量与GSH-Px活性均有明显变化(P<0.05,P<0.01)。
2.1.2 ECH对各组大鼠皮层和海马中NO含量及NOS活性的影响 Tab 2结果显示:NO的含量变化,仅模型组与假手术组间差异有显著性(P<0.05)。ECH对各组大鼠NOS活力的影响结果如下:与假手术组相比,模型组、ECH低、中剂量组大鼠的皮层和海马组织中的NOS活性明显升高(P<0.05,P<0.01),除此以外,阳性药加兰他敏组海马组织中的NOS活性也明显升高(P<0.05);与模型组相比,ECH高剂量及假手术组大鼠的皮层和海马组织中的NOS活性明显降低(P<0.05,P<0.01),除此以外,ECH中剂量及阳性药加兰他敏组海马组织中的NOS活性也明显降低(P<0.01);与阳性药加兰他敏组比较,仅模型组、假手术组海马组织中的NOS活性变化差异有显著性(P<0.05,P<0.01)。
Tab 1 Effect of ECH on content of GSH and activity of GSH-Px in cerebral cortex and hippocam pus

Tab 1 Effect of ECH on content of GSH and activity of GSH-Px in cerebral cortex and hippocam pus
*P<0.05,**P<0.01 vs sham;ΔP<0.05,ΔΔP<0.01 vs model;#P<0.05,##P<0.01 vs Gal.
Group Dose/mg·kg-1·d-1 Content of GSH/μmol·g-1Pro Activity of GSH-Px(activity unit )Cerebral cortex Hippocampus Model - 3.16±0.47**## 2.24±0.41**## 42.20±6.70**## 28.40±5.51**##Cerebral cortex Hippocampus Low dose ECH 10 5.07±1.02** 4.16±0.65** 64.20±6.18**# 49.40±8.57**Middle dose ECH 20 6.19±0.74**Δ 5.30±0.79**Δ 78.80±7.99**ΔΔ 64.50±7.68**Δ High dose ECH 40 8.47±0.99ΔΔ 7.65±1.17ΔΔ 100.80±9.06ΔΔ 86.10±11.38ΔΔ Gal 3 6.94±0.58**ΔΔ 6.10±0.72**ΔΔ 88.30±7.10*ΔΔ 74.60±11.30*ΔΔ Sham - 10.35±1.02ΔΔ## 9.55±1.01ΔΔ## 118.90±11.71ΔΔ# 105.40±11.68ΔΔ#
Tab 2 Effect of ECH on content of NO and activity of NOS in cerebral cortex and hippocampus
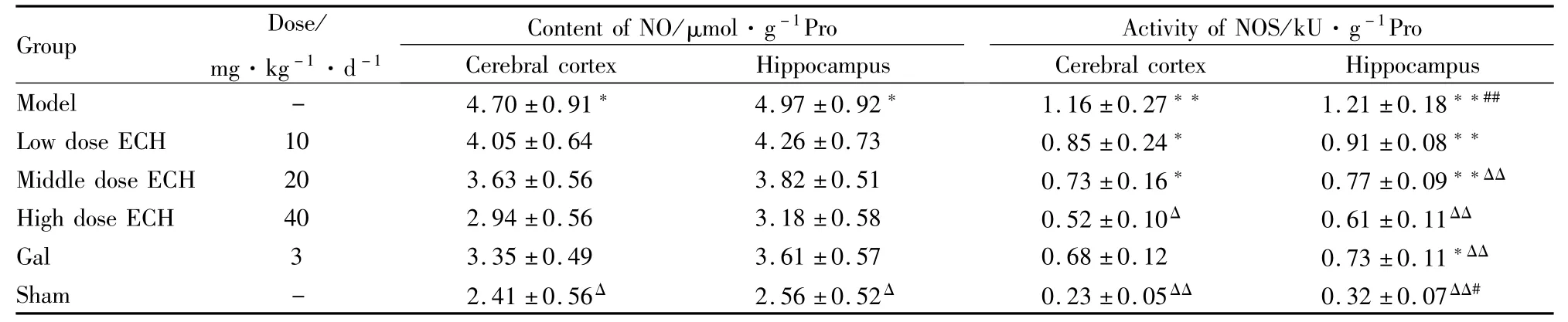
Tab 2 Effect of ECH on content of NO and activity of NOS in cerebral cortex and hippocampus
*P<0.05,**P<0.01 vs sham;ΔP<0.05,ΔΔP<0.01 vs model;#P<0.05,##P<0.01 vs Gal.
Group Dose/mg·kg-1·d-1 Content of NO/μmol·g-1Pro Activity of NOS/kU·g-1Pro Cerebral cortex Hippocampus Model - 4.70±0.91* 4.97±0.92* 1.16±0.27** 1.21±0.18**##Cerebral cortex Hippocampus Low dose ECH 10 4.05±0.64 4.26±0.73 0.85±0.24* 0.91±0.08**Middle dose ECH 20 3.63±0.56 3.82±0.51 0.73±0.16* 0.77±0.09**ΔΔ High dose ECH 40 2.94±0.56 3.18±0.58 0.52±0.10Δ 0.61±0.11ΔΔ Gal 3 3.35±0.49 3.61±0.57 0.68±0.12 0.73±0.11*ΔΔ Sham - 2.41±0.56Δ 2.56±0.52Δ 0.23±0.05ΔΔ 0.32±0.07ΔΔ#
2.2 ECH对VD大鼠海马组织CA1区组织结构的影响 HE染色后,假手术组(Fig 1F)大鼠的海马CA1区细胞数目多,排列整齐紧密,细胞形态完整,结构正常,胞质丰富,胞核与胞质界限清晰可见,核仁明显。模型组(Fig 1A)大鼠的海马CA1区细胞数目减少,细胞排列紊乱稀疏,细胞形态不完整,结构不正常,胞质稀少,胞核与胞质界限模糊,细胞核深染、固缩,呈三角形或不规则形,核仁不明显,并出现增生胶质细胞。相比之下,各给药组大鼠海马CA1区神经元排列较整齐,结构相对正常,核固缩现象减少,深染程度降低,且ECH高剂量组变化更为明显,接近于假手术组,ECH中剂量组及阳性药加兰他敏组次之,ECH低剂量组更为接近模型组,仍有严重的细胞核深染及固缩现象存在。
3 讨论
氧化应激损伤表现在机体遭受到各种有害刺激时,由于体内高活性分子如活性氧自由基(ROS)和活性氮自由基(RNS)产生过多,氧化程度远远超出了机体氧化物的清除能力,体内氧化系统和抗氧化系统失衡,导致了组织损伤。氧化应激损伤被认为是机体衰老的根本原因,同时,在多种退行性疾病,包括神经元缺血性损伤中起着关键作用[7]。GSH能够以非酶促反应的形式直接与氧自由基结合,达到清除自由基、抗氧化、抗衰老的目的,同时也可作为GSH-Px的底物,使有毒的过氧化物还原成无毒的羟基化合物,从而保护细胞膜的结构和功能不受过氧化物的干扰及损害。NO作为一种自由基气体,参与脑内许多生理过程,如脑血流调节学习记忆形成等[8]。研究表明,脑缺血时间增加,可使诱导型NOS(iNOS)激活,产生大量具有神经毒性的NO。而NO在VD的形成中发挥了重要作用,脑缺血时产生大量的NO与氧自由基反应生成过氧亚硝基阴离子,进而分解成毒性极强的氧化剂,导致脑组织的损伤加重[9]。大脑海马CA1区是参与信息贮存和记忆的重要部分,也是脑缺血的最敏感区域之一,有研究显示:海马CA1区神经元的迟发性死亡可能是缺血性脑血管病导致痴呆的主要病因[10]。
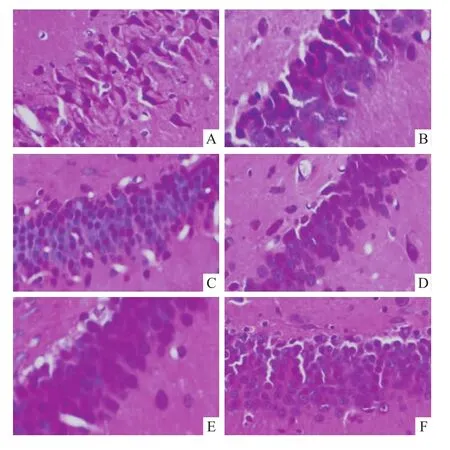
Fig 1 Effect of ECH on tissue structure changes in rat hippocam pus CA1 area by HE staining(×400)A:Model group;B:Low dose group;C:Middle dose group;D:High dose group;E:Gal group;F:Sham group
本实验研究结果显示:给药4周后,与假手术组比较,模型组大鼠皮层及海马组织中的GSH含量以及GSH-Px活力有不同程度的降低,NO含量及NOS活力有不同程度的升高。与模型组相比,各给药组大鼠皮层及海马组织中的GSH含量以及GSH-Px活力有不同程度的升高,NOS活力有不同程度的降低,这表明皮层及海马的氧化应激损伤参与了VD疾病的形成过程,ECH能够清除自由基,降低氧化应激引起的损伤。而各给药组的NO含量虽然降低,但与模型组比较差异并无显著性,推断可能是由于ECH对NOS的抑制量还不足以造成NO的减少量与模型组形成差异,或者是实验过程中的操作误差造成,为了进一步探讨,可以重新实验或者进行更进一步的同工酶测定,进一步准确说明ECH是否具有减少活性氮自由基NO的能力。由染色后各组大鼠海马CA1区组织结构的变化可知,ECH可以改善慢性低灌注对CA1区神经元的损伤状况。以上各试剂盒的测定以及组织结构的变化表明,ECH高剂量组与模型组差异最为明显,且接近于假手术组,甚至优于阳性药组,而ECH低剂量组接近于模型组。这表明ECH对VD大鼠的氧化应激损伤、海马神经元损伤确实有改善作用,且与ECH的给药量成线性相关,需要进一步探讨更为准确的量效关系。
综上所述,ECH对VD大鼠氧化应激损伤有较好的的保护作用。其抑制氧化应激损伤的作用是改善海马神经元损伤、防治VD认知功能障碍的可能机制之一。该结果为进一步研究ECH对VD大鼠的治疗作用及其机制奠定了基础,是否有其它作用机制还有待于进一步深入探讨。
参考文献:
[1] 邓 敏,赵金恒,屠鹏飞,等.松果菊苷对TNFα诱导的SHSY5Y细胞凋亡的保护作用[J].中国药理学通报,2005,21(2):169-74.
[1] Deng M,Zhao J H,Tu P F,et al.Echinacoside rescues the SSY5Y neuronal cells from TNFα-induced apoptosis[J].Chin Pharmacol Bull,2005,21(2):169-74.
[2] 皋 聪,王传社,巫冠中,等.苁蓉总苷对血管性痴呆大鼠学习记忆的影响及机制研究[J].中草药,2005,36(12):1852-5.
[2] Gao C,Wang C S,Wu G Z,et al.Mechanism and learning and memory effect on vascular dementia rats of glycosides of cistanche[J].Chin Tradit Herb Drug,2005,36(12):1852-5.
[3] 李 媛,宋媛媛,张洪泉.松果菊苷对衰老小鼠免疫功能和线粒体DNA相对含量的影响[J].中国药理学通报,2010,26(6):810-3.
[3] Li Y,Song Y Y,Zhang H Q.Effect of Echinacoside on immune function and mitochondrial DNA relative content of aging mice[J].Chin Pharmacol Bull,2010,26(6):810-3.
[4] 王明远,朱 沂,刘小莉.血管性痴呆的治疗进展[J].山东医药,2007,3(47):115-6.
[4] Wang M Y,Zhu Y,Liu X L.Treatment of vascular dementia[J].Shandong Pharmaceut,2007,3(47):115-6.
[5] 黄新武,李 华,秦大莲,等.不同时点分别结扎左、右颈总动脉建立大鼠血管性痴呆模型[J].中国老年学杂志,2010,30(14):2006-7.
[5] Huang XW,LiH,Qin D L,etal.Themodel of VD ratswas established by themethod of Ligationbilateral common carotid artery at two times[J].Chin JGerontol,2010,30(14):2006-7.
[6] 赵宪林,方秀斌,李东培.大鼠血管性痴呆模型制作[J].中国医科大学学报,2002,31(3):166-76.
[6] Zhao X L,Fang X B,Li D P.Establishing vascular dementia model in rats[J].JChin Med Univ,2002,31(3):166-76.
[7] 赵 玲,刘 丽,李雅莉,等.慢性脑低灌注状态对大鼠学习记忆功能及脑组织自由基代谢的影响[J].中国行为医学科学,2005,14(11):961-3.
[7] Zhao L,Liu L,Li Y L,et al.Effect of chronic brain hypoperfusion on cerebrbral free radical metabolism and learning-memory function[J].Chin JBehavioral Med Sci,2005,14(11):961-3.
[8] 赵平丽,吕 哲.中医药治疗血管性痴呆的临床与实验研究进展[J].中医学报,2010,25(3):565-7.
[8] Zhao P L,LüZ.Traditional Chinesemedicine clinical and experimental research progress for the treatment of vascular dementia[J].China JChin Med,2010,25(3):565-7.
[9] 汪远金,谢道俊,马克龙.黄蒲通窍胶囊对血管性痴呆大鼠学习记忆能力及NOS的影响[J].中国中医基础医学杂志,2005,11(5):333-4.
[9] Wang Y J,Xie D J,Ma K L.Effect of Huangputongqiao capsule on learning andmemory ability,cerebralNOSactivities in ratswith vascular dementia[J].Chin JBasic Med Tradit Chin Med,2005,11(5):333-4.
[10]赵建新,田元祥,李国明,等.脑缺血再灌注拟血管性痴呆小鼠皮层及海马细胞病理形态学动态观察[J].中风与神经疾病杂志,2000,17(4):200-2.
[10]Zhao JX,Tian Y X,Li G M,et al.Pathomorphology dynamic observation on cortex and ippocampal cell of cerebral ischemia reperfusion synthetic vascular dementiamodelmouse[J].JApopl Nerv Dis,2000,17(4):200-2.