Caspase-4活化参与TRAIL诱导的胃癌细胞凋亡
吴 萍,朱雪萍,张旭东,张林杰
(安徽医科大学免疫学教研室,安徽合肥 230032)
肿瘤坏死因子相关的凋亡诱导配体(tumor necrosis factor-related apoptosis-inducing ligand,TRAIL)是肿瘤坏死因子超家族的成员,自1995年被发现以来,由于其特异地杀伤肿瘤细胞而不损害正常细胞的特性受到了肿瘤研究领域的广泛关注。目前认为TRAIL诱导凋亡主要是通过caspase-8介导的外源性途径(或死亡受体途径)和caspase-9介导的内源性途径(或线粒体途径)。在caspases家族中还有一类炎性 caspases[1],在人类主要有 caspase-1、caspase-4和caspase-5,而在小鼠主要有caspase-1、capase-11和caspase-12。人的caspase-4与小鼠的caspase-12在序列上有48%的同源性,两者都定位在内质网外膜上,二者在内质网应激性凋亡中可能发挥着重要作用[2]。有研究表明,TRAIL也可以引起内质网应激[3-4],此外,caspase-4参与了 TRAIL诱导的凋亡过程[5-6]。本研究拟探索内质网应激在TRAIL诱导胃癌细胞凋亡中的作用,以及caspase-4在其中的参与情况,以更好地剖析TRAIL诱导胃癌细胞凋亡的过程。
1 材料与方法
1.1 材料 胃癌细胞SGC-7901和BGC-823购自中国科学院上海生命科学研究院细胞资源中心;RPMI 1640培养基和Opti-MEM低血清培养基购自Gibco公司;胎牛血清购自Hyclone公司;重组人可溶性TRAIL购自Immunex公司;衣霉素(tunicamycin,TM)和碘化丙啶(propidium iodide,PI)购自Sigma-Aldrich公司;caspase-4抑制剂(z-LEVD-fmk)购自BioVision公司;小鼠抗人caspase-4单克隆抗体购自Abcam公司;小鼠抗人caspase-3单克隆抗体及兔抗人GRP78多克隆抗体购自Santa Cruz公司;小鼠抗人β-actin单克隆抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗小鼠IgG及山羊抗兔IgG购自北京中杉金桥生物技术有限公司;人caspase-4 siRNA序列由广州锐博生物科技有限公司设计并合成;Lipofectamine 2000 Reagent购自Invitrogen公司。
1.2 方法
1.2.1 细胞培养 SGC-7901和BGC-823细胞培养于含10%胎牛血清的RPMI 1640培养基中,置于37℃、饱和湿度、5%CO2的培养箱中培养。
1.2.2 PI染色流式细胞术检测细胞凋亡情况 实验分4组:(1)对照组;(2)TRAIL(200μg·L-1)组;(3)z-LEVD-fmk(30μmol·L-1)组;(4)z-LEVD-fmk(30μmol·L-1)+TRAIL(200μg·L-1)组;每组设3个复孔。将细胞按1×105个/孔接种于24孔板上,次日待细胞处于对数生长期时,给予不同处理24 h。分别收集上清液,每孔加入质量浓度为0.05 g·L-1的 PI溶液750μl,于37℃条件下避光作用10~20 min,待孔内贴壁细胞完全消化后,也收集至相应流式管中,充分混匀,4℃避光过夜,次日上流式细胞仪(Becton Dickinson FACSVerse)检测细胞的凋亡情况,采用FCSExpress 4软件分析亚二倍体峰(sub-G1)所占的百分比即为细胞凋亡率。
1.2.3 siRNA转染胃癌细胞 从GeneBank中检索人caspase-4基因序列,根据siRNA设计原则,设计3对siRNA(Tab 1),将随机选取序列的siRNA作为阴性对照(negative control,NC)。转染前 1 d,接种细胞于6孔板,每孔2×105个细胞,次日细胞融合达30%~50%。实验分5组:(1)未转染组(Control);(2)转染 NC siRNA组;(3)转染 caspase-4 siRNA_101组;(4)转染 caspase-4 siRNA_102组;(5)转染caspase-4 siRNA_103组,每组设3个复孔。各转染组均用100μl的Opti-MEM稀释100 pmol siRNA,柔和混匀,再用100μl的Opti-MEM稀释7.5μl的Lipofectamine 2000 Reagent,轻轻混匀,室温放置5 min,将稀释好的siRNA和Lipofectamine 2000 Reagent混合,室温放置 20 min,形成 siRNA/Lipofectamine复合物,最后将 200μl siRNA/Lipofectamine复合物滴入到孔中,放入细胞培养箱中,4 h后换液。转染48 h后提取细胞总蛋白,用Western blot验证siRNA沉默效果。另外接种细胞于24孔板,按上述方法转染,转染24 h后,加入TRAIL(200 μg·L-1)继续处理24 h,PI染色流式细胞术检测细胞在转染siRNA caspase-4后的凋亡情况(方法同“1.2.2”)。

Tab 1 Sequences of caspase-4 siRNA
1.2.4 Western blot检测蛋白表达情况 收集细胞,加入100μl的RIPA裂解液,冰上裂解30 min,4℃14 000×g离心30 min后取上清液,此为细胞总蛋白。采用BCA法蛋白定量后,取20μg行SDS-PAGE电泳分离蛋白,随后将分离后的蛋白转移至硝酸纤维素膜上,用含质量浓度为50 g· L-1脱脂奶粉的TBST封闭2 h,然后加入一抗,4℃孵育过夜,次日用TBST洗3次,每次10 min,再加入相应的二抗,室温孵育1 h,TBST洗3次,每次10 min。电化学发光法显色,采用天能全自动凝胶图像分析系统(上海天能科技有限公司)照相并分析结果。
1.2.5 统计学方法 采用SPSS 11.5软件对数据进行统计学分析。计量资料以表示,组间比较采用t检验。
2 结果
2.1 z-LEVD-fmk能阻止TRAIL诱导的胃癌细胞发生凋亡 PI染色流式细胞术检测结果显示,TRAIL单独作用时,两株胃癌细胞都快速地发生凋亡,SGC-7901和BGC-823细胞在处理24 h的凋亡率分别为(68.77±4.05)%和(31.17±2.41)%。caspase-4的抑制剂 z-LEVD-fmk对细胞几乎无毒性,作用24 h的凋亡率和对照组相当,都在5%以下。而当细胞用 z-LEVD-fmk预处理1 h,再加入TRAIL继续作用24 h时细胞凋亡率分别为(1.67±0.65)%和(14.47±1.62)%,和单用 TRAIL相比,差异均有统计学意义(P<0.05),说明z-LEVD-fmk能很大程度上抑制TRAIL诱导的胃癌细胞凋亡(Fig 1)。
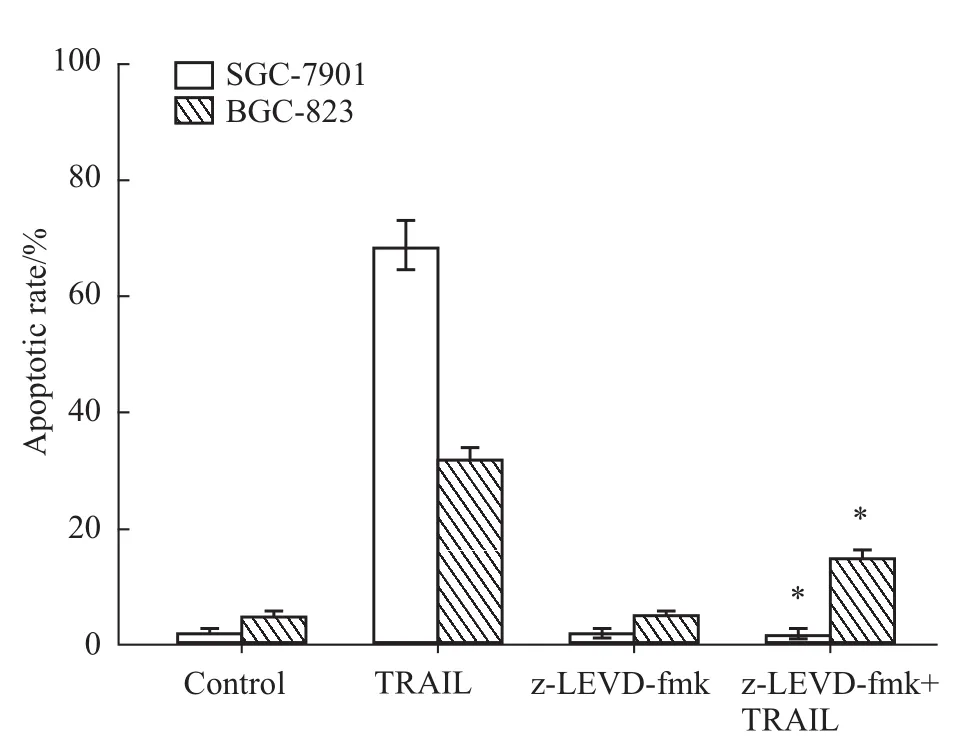
Fig 1 Inhibitory effect of caspase-4 inhibitor z-LEVD-fm k on TRAIL-induced apoptosisControl:untreated cells;TRAIL:cells treated with TRAIL(200μg·L-1)for 24 h;z-LEVD-fmk:cells treated with z-LEVD-fmk(30 μmol·L-1)for 24 h;z-LEVD-fmk+TRAIL:cells treated with z-LEVD-fmk(30μmol·L-1)1 h before the addition of TRAIL(200μg·L-1)for a further 24 h.*P<0.05 vs TRAIL
2.2 siRNA沉默 caspase-4基因能明显降低caspase-4蛋白的表达水平 利用3条caspase-4 siRNA分别转染胃癌细胞,Western blot验证caspase-4的沉默效果,发现和未转染组(Control)以及阴性对照组(NC)相比,3条 caspase-4的 siRNA序列都能降低细胞中caspase-4的蛋白表达水平,其中在SGC-7901细胞中103序列的沉默效果最好,而在BGC-823中101序列的沉默效果最好(Fig 2)。
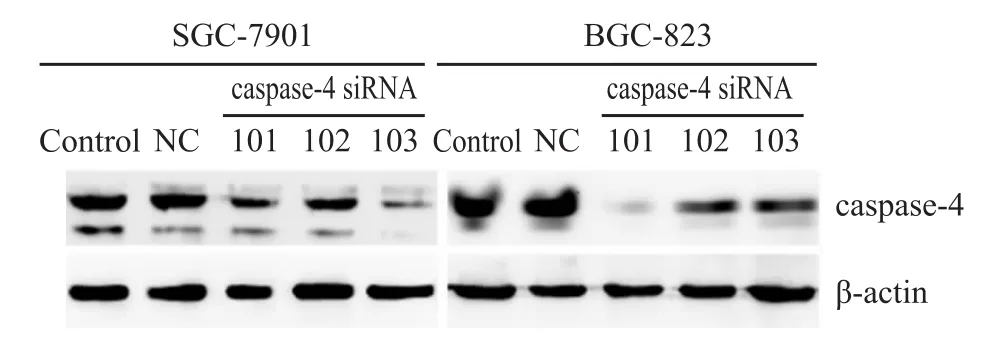
Fig 2 Knockdown efficiency of caspase-4 siRNACell lysates were collected 48 h posttransfection and aliquots of 20 μg were subjected to Western blot analysis of caspase-4 levels.
2.3 Caspase-4 siRNA对TRAIL诱导胃癌细胞凋亡的影响 根据上述转染效果,选择caspase-4 siRNA_103和101,分别转染SGC-7901和BGC-823细胞,流式细胞术检测其对TRAIL诱导凋亡的影响,结果发现转染caspase-4 siRNA可以部分地抑制胃癌细胞发生凋亡(Fig 3),和阴性对照组(NC)相比,差异有统计学意义(P<0.05)。

Fig 3 Im pact of caspase-4 siRNA on TRAIL-induced apoptosisCellswere transfected with either the negative control(NC)or the caspase-4 siRNA for 24 h before treatmentwith TRAIL(200μg·L-1)for another24 h and then the apoptotic ratewas detected by FCM.*P<0.05 vs NC
2.4 TRAIL诱导内质网应激反应 GRP78蛋白表达水平的上调被认为是内质网应激发生的金标准。Fig 4显示,正常情况下胃癌细胞中GRP78的表达水平很低,TRAIL处理后6 h和16 h有所升高,说明TRAIL能激发内质网应激反应的发生,但其增高的程度远不及内质网应激经典的诱导剂衣霉素(TM)的作用。
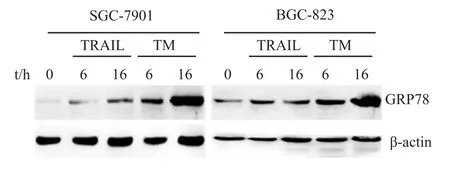
Fig 4 Upregulation of GRP78 by TRAILCells were treated with 200μg·L-1 TRAIL as indicated before measurement of the expression ofGRP78 byWestern blot.The classic ER stress inducer TM(3μmol·L-1)was used as a control.
2.5 TRAIL作用早期caspase-4发生活化 Western blot检测在TRAIL处理后不同时间caspase-4和caspase-3的活化情况,结果显示 Pro-caspase-4在TRAIL作用后120 min开始下降,到180 min时降低明显,而Cleaved-caspase-4最早出现在TRAIL作用后的 30 min。Caspase-3活化得更早,Cleavedcaspase-3出现在TRAIL作用10 min以后(Fig 5)。
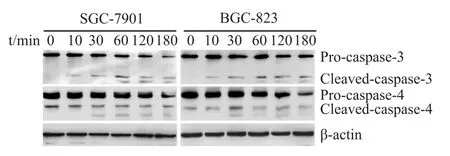
Fig 5 Activation of caspase-3 and caspase-4 after TRAIL treatmentCells were treated with TRAIL at 200μg· L-1 for the indicated time periods beforemeasurement of the expression level of caspase-3 and caspase-4 by Western blot.
3 讨论
既往我们对TRAIL诱导胃癌细胞凋亡的过程进行了深入的研究,发现除了死亡受体途径外,线粒体途径也参与其中[7]。但越来越多的证据表明,TRAIL诱导的凋亡可能还有其他细胞器的参与,如内质网[8]和溶酶体[9]。目前对内质网应激性凋亡途径还不十分清楚,一般认为主要是通过活化caspase-12、产生活性氧、激活JNK以及转录因子CHOP所介导[10]。其中caspase-12显得尤为重要,因为早期研究发现caspase-12缺陷的小鼠细胞对内质网应激性的凋亡完全抵抗[11],然而caspase-12只在啮齿类动物中表达,人类缺乏有功能的caspase-12[2]。近几年的研究认为,人的caspase-4能替代小鼠caspase-12的功能,二者在序列上相似,且都定位在内质网外膜上。Jiang等[12]发现,如果把GRP78的抑制作用去掉,caspase-4能明显地使黑色素瘤细胞发生内质网应激性的凋亡。此外caspase-4还参与了TRAIL诱导的人类风湿性关节炎滑膜成纤维细胞和黑色素瘤细胞的凋亡[5-6]。
本研究采用caspase-4特异的抑制剂z-LEVD-fmk在TRAIL作用之前1 h对细胞进行预处理,发现z-LEVD-fmk能明显降低TRAIL诱导的胃癌细胞凋亡,这种作用在SGC-7901细胞中尤为明显。此外利用 caspase-4 siRNA转染胃癌细胞,也使得TRAIL诱导的细胞凋亡受到部分抑制。以上两个结果充分说明caspase-4参与了TRAIL的凋亡信号转导。Western blot检测到GRP78蛋白表达水平上调,但是这种升高的程度有限,远低于经典的内质网应激诱导剂TM的作用,说明TRAIL激活了较低水平的内质网应激反应。另外TRAIL作用30 min起Cleaved-caspase-4即出现,而Cleaved-caspase-3出现得更早,说明caspase-4比caspase-3活化得晚。有报道称TM引起的caspase-4活化不依赖于caspase-8的活化,且在 caspase-9和 caspase-3活化的上游[12],而 TRAIL诱导的 caspase-4活化发生在caspase-3的下游[6],可见在TM和TRAIL诱导的不同程度的内质网应激性凋亡途径中,信号转导通路有很大的不同,但其中具体的分子机制仍不清楚。
综上所述,本研究显示caspase-4活化对TRAIL诱导胃癌细胞的凋亡是必需的,此外TRAIL激活caspase-4与中等程度的内质网应激反应有关。内质网应激性凋亡途径的参与将帮助我们更全面地了解TRAIL诱导胃癌细胞凋亡的调控机制,找到增加细胞对TRAIL敏感性的新靶点。
参考文献:
[1] Martinon F,Tschopp J.Inflammatory caspases and inflammasomes:master switches of inflammation[J].Cell Death Differ,2007,14(1):10-22.
[2] Hitomi J,Katayama T,Eguchi Y,etal.Involvementof caspase-4 in endoplasmic reticulum stress-induced apoptosis and Abeta-induced cell death[J].JCell Biol,2004,165(3):347-56.
[3] Inoue T,Suzuki-Karasaki Y.Mitochondrial superoxide mediates mitochondrial and endoplasmic reticulum dysfunctions in TRAIL-induced apoptosis in Jurkat cells[J].Free Radic Biol Med,2013,61C:273-84.
[4] Murai M,Inoue T,Suzuki-Karasaki M,et al.Diallyl trisulfide sensitizes human melanoma cells to TRAIL-induced cell death by promoting endoplasmic reticulum-mediated apoptosis[J].Int J Oncol,2012,41(6):2029-37.
[5] Yang X,Wang J,Liu C,etal.Cleavage of p53-vimentin complex enhances tumor necrosis factor-related apoptosis-inducing ligandmediated apoptosis of rheumatoid arthritis synovial fibroblasts[J].Am JPathol,2005,167(3):705-19.
[6] Mao ZG,Jiang CC,Yang F,et al.TRAIL-induced apoptosis of human melanoma cells involvesactivation of caspase-4[J].Apoptosis,2010,15(10):1211-22.
[7] 吴 萍,陈 思,程文晋,等.线粒体凋亡途径参与TRAIL诱导胃腺癌细胞凋亡[J].安徽医科大学学报,2007,42(6):599-603.
[7] Wu P,Chen S,Cheng W J,et al.The mitochondrial apoptotic pathway is involved in TRAIL-induced apoptosis of gastric adenocarcinoma[J].Acta UnivMed Anhui,2007,42(6):599-603.
[8] Boyce M,Yuan J.Cellular response to endoplasmic reticulum stress:amatter of life or death[J].Cell Death Differ,2006,13(3):363-73.
[9] Werneburg NW,GuicciardiM E,Bronk SF,etal.Tumor necrosis factor-related apoptosis-inducing ligand activates a lysosomal pathway of apoptosis that is regulated by Bcl-2 proteins[J].JBiol Chem,2007,282(39):28960-70.
[10]叶艳清,李国平,蒲泽锦,等.腺苷通过内质网应激途径诱导HepG2细胞凋亡的研究[J].中国药理学通报,2010,26(5):596-601.
[10]Ye Y Q,LiG P,Pu Z J,etal.The research ofadenosine induced HepG2 cells apoptosis through endoplasmic reticulum stress pathway[J].Chin Pharmacol Bull,2010,26(5):596-601.
[11]Nakagawa T,Zhu H,Morishima N,et al.Caspase-12 mediates endoplasmic-reticulum-specific apoptosis and cytotoxicity by amyloid-beta[J].Nature,2000,403(6765):98-103.
[12]Jiang CC,Chen LH,Gillespie S,etal.Inhibition ofMEK sensitizes human melanoma cells to endoplasmic reticulum stress-induced apoptosis[J].Cancer Res,2007,67(20):9750-61.

