激动ALDH2对抗糖尿病大鼠肝脏损伤的机制探讨
张冠军,康品方,宗巧凤,于 影,王芳芳,高 琴
(1.蚌埠医学院生理学教研室,安徽蚌埠 233030;2.蚌埠医学院第一附属医院心血管内科,安徽蚌埠 233004)
糖尿病是一种慢性进行性内分泌及代谢性疾病,随着生活水平的提高,其发病率越来越高,目前全球糖尿病患者已超过7亿。糖尿病作为一种慢性疾病严重危害着人们的身体健康。糖尿病的病程较长,在其病情不断加重的过程中伴有多种并发症,肝脏损伤是其中之一,主要表现为慢性炎症和肝功能的损伤[1]。
乙醛脱氢酶2(aldehyde dehydrogenase 2,ALDH2)是线粒体内重要的醛类氧化酶,与生物氧化关系密切,可防止乙醛对膜的脂质过氧化,是机体内重要的保护因子之一[2]。ALDH2广泛分布于肝脏、心脏、肺脏和脑等组织中。Murata等[3]观察到少量或适量的外源性乙醇可以激动ALDH2的表达。本实验室前期已观察到激动ALDH2可以减轻糖尿病大鼠心肌损伤[4]。氧化应激异常是糖尿病肝损伤发生慢性炎症和肝功能损伤的重要机制[1],糖尿病大鼠肝组织中由于过氧化氢酶、超氧化物歧化酶活性降低,不能及时清除氧自由基,引起肝细胞DNA损伤的发生[5]。大量研究显示,线粒体ALDH2具有抗氧化应激损伤的作用,但激动ALDH2是否对糖尿病大鼠的肝脏损伤有保护作用至今报道较少。Martinovic等[5]在对糖尿病大鼠肝脏的研究中观察到:在肝功能损害的过程中存在着JNK(c-Jun N-terminal kinase)通路的激活。Kaneto等[6]观察到 JNK抑制剂使小鼠血糖降低且并发症减少。激动ALDH2是否可通过抑制JNK通路减弱糖尿病诱导的肝脏的损伤呢?因此,本实验建立糖尿病大鼠肝脏损伤模型,应用低剂量乙醇激动ALDH2使之高表达,观察ALDH2高表达是否可对抗糖尿病肝脏损伤,并进一步观察激动ALDH2能否通过抑制JNK通路而对抗糖尿病肝脏损伤。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级健康♂SD大鼠,体质量200~220 g,苏州工业园区爱尔麦特科技有限公司提供,实验动物生产许可证号:SCXK(苏2009-001)。
1.1.2 仪器、药品和试剂 链脲佐菌素(streptozotocin,STZ)购自 Sigma公司,批号:905B0311;乙醇(ethanol,EtOH)购自安徽安特食品股份有限公司,批号:1212073601;ALDH2、β-actin抗体购自美国Santa Cruz公司;p-JNK、JNK抗体购自 Anbo公司;羊抗小鼠及羊抗兔二抗购自武汉博士德公司;ECL发光试剂盒购自Millipore公司。采用易速得血糖分析仪及配套的台欣试纸测定大鼠空腹血糖变化;立式超低温冰箱(海尔公司,中国),酶标仪(BioTek,美国),水平低温离心机(Centrifuge 5810R,美国),电泳仪(Bio-RAD,美国 ),电转槽(Bio-RAD,美国);全自动凝胶分析仪(Chmi DocTMXRS+,美国)。
1.2 方法
1.2.1 糖尿病模型复制及分组 ♂SD大鼠适应性喂养1周后随机分为3组,每组10只,分为正常对照组(Con组)、糖尿病组(DM组)、ALDH激动剂乙醇加糖尿病组(EtOH+DM组)。一次性腹腔注射STZ 55mg·kg-1复制糖尿病大鼠模型,72 h后尾静脉取血,测空腹血糖,以空腹血糖≥16.7 mmol·L-1且持续1周确定为模型复制成功[7]。DM组大鼠给予正常饮食,EtOH+DM组待大鼠糖尿病模型造模成功后给予体积分数为0.025的乙醇适应性喂养1周,体积分数为0.05的乙醇持续喂养至8周。正常对照组大鼠常规饮食,不做任何处理,持续喂养8周。
1.2.2 空腹血糖及糖化血红蛋白(HbA1c)检测 8周后,清晨称量大鼠空腹体重,尾静脉取血,测定空腹血糖(FBG)水平,水合氯醛麻醉后颈总动脉取血1.5 ml,置于肝素抗凝管中,室温静置30 min,离心4 000 r·min-1,5 min,分离红细胞,测定糖化血红蛋白(HbA1c)水平。
1.2.3 血清生化指标测定肝功能 麻醉状态下,颈总动脉取血3 ml至肝素抗凝管中,送至蚌埠医学院第一附属医院检验科,检测血清谷丙转氨酶(AST)、谷草转氨酶(ALT)的含量。
1.2.4 肝组织病理学检查 大鼠处死后,速取肝脏并称重,计算肝重指数(肝脏重量/体重)。于-80℃冰箱保存备用;取部分肝脏,用质量分数为0.04的多聚甲醛固定,石蜡包埋,HE染色,光镜下观察肝脏组织病理变化。
1.2.5 Western blot检测肝脏组织ALDH2、JNK蛋白表达 取0.1 g肝脏组织匀浆,4℃离心(12 000 r·min-1,30 min),BCA法测定蛋白浓度,以总蛋白0.08 mg上样,使蛋白变性,配胶,电泳后转PVDF膜,脱脂奶粉封闭 2 h,TBS稀释一抗 ALDH2(1∶500)、JNK、p-JNK(1∶1 000),加一抗,水浴摇床,4℃过夜。次日水浴摇床,TBS洗膜4次。ECL试剂显色,曝光成像。凝胶成像系统测量条带的灰度值,计算 ALDH2/β-actin,p-JNK/β-actin、JNK/βactin、p-JNK/JNK蛋白表达的相对量。
1.2.6 统计学分析 采用SPSS15.0统计软件,实验结果以表示,各组间采用One-way ANOVA进行统计学分析。
2 结果
2.1 各组大鼠空腹血糖(FBG)、糖化血红蛋白(HbA1c)水平、肝重指数(肝脏重量/体重)的变化与Con组大鼠相比,DM组和EtOH+DM组大鼠的FBG、HbA1c水平、肝重指数明显升高,差异有统计学意义(P<0.01);与DM组相比,EtOH+DM组的FBG、HbA1c水平、肝重指数明显降低(P<0.05~0.01),见 Tab 1。

Tab 1 Changes of fasting blood glucose(FBG)and glycosylatedhemoglobin(HbA1c)levels and LW/BW in different groups
2.2 各组大鼠肝功能的测定 与Con组比较,DM组和EtOH+DM组大鼠血清ALT和AST含量明显升高(P<0.05~0.01);与DM组比较,EtOH+DM组大鼠血清ALT、AST含量降低(P<0.01),见 Tab 2。

Tab 2 Changes of serum ALT and AST levels in different groups
2.3 各组大鼠肝脏病理形态学改变 HE染色结果显示:Con组大鼠肝组织中肝细胞形态正常,肝小叶结构清晰,肝细胞索整齐排列,偶见少量炎症细胞浸润。DM组大鼠肝小叶结构异常,肝细胞边界不清,细胞肿胀,细胞索排列紊乱,假小叶形成,间质内可见较明显的炎性细胞浸润。EtOH+DM组与DM组相比细胞形态尚正常,肝细胞肿胀、肝小叶的破坏和假小叶的形成均有明显的改善(Fig 1、2)
2.4 W estern blot检测肝脏组织 ALDH2、JNK、p-JNK蛋白表达 DM组大鼠肝脏ALDH2蛋白表达水平明显低于Con组(P<0.01),EtOH+DM组大鼠肝脏 ALDH2蛋白表达明显高于 DM组(P<0.01),见 Fig 3。
与Con组相比,DM组大鼠肝脏p-JNK、JNK蛋白的表达均明显增高,p-JNK/JNK比值增加(P<0.01);与 DM组相比,EtOH+DM组大鼠肝脏 p-JNK、JNK蛋白的表达均明显降低,p-JNK/JNK比值下降(P<0.01),见 Fig 4。
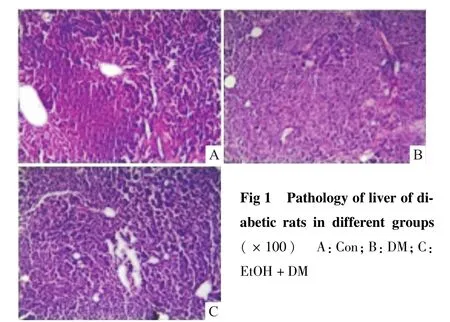
Fig 1 Pathology of liver of diabetic rats in different groups(×100) A:Con;B:DM;C:EtOH+DM
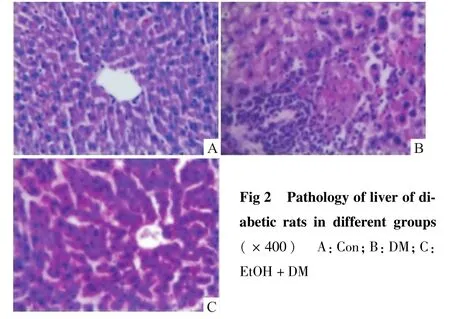
Fig 2 Pathology of liver of diabetic rats in different groups(×400) A:Con;B:DM;C:EtOH+DM
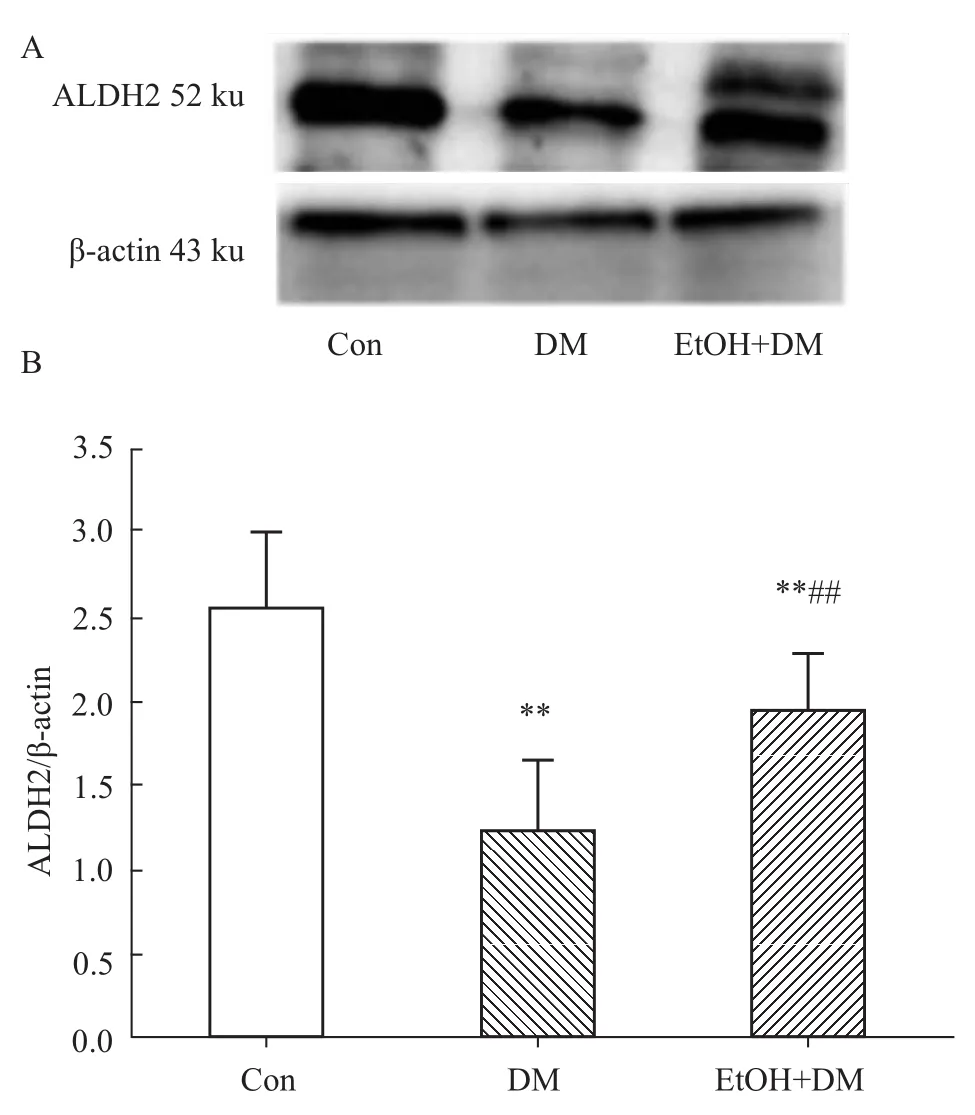
Fig 3 Representative W estern blot(A)and quantitative analysis of ALDH2/β-actin protein expression(B)in liver of diabetic rats**P<0.01 vs Con;##P<0.01 vs DM.
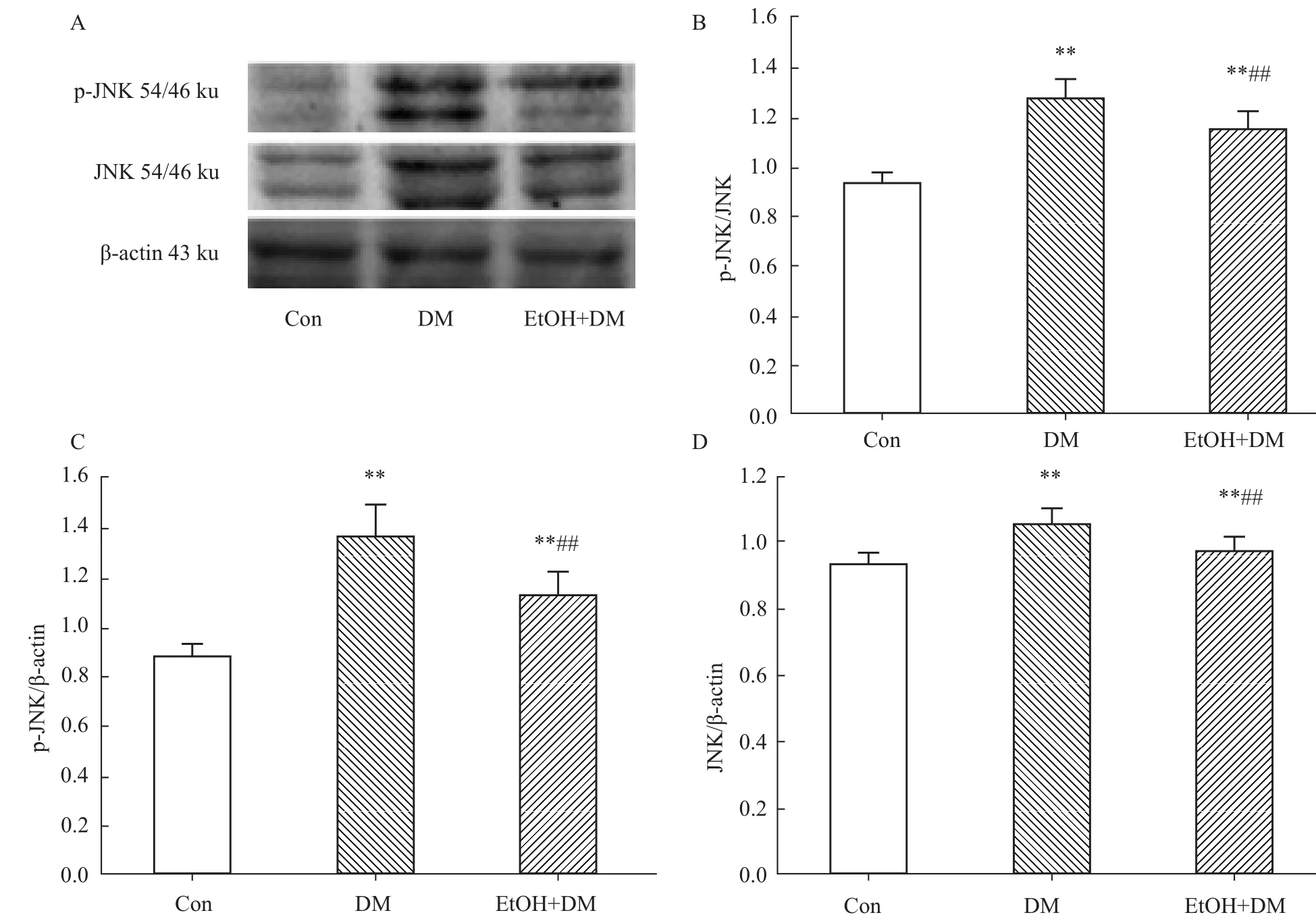
Fig RepresentativeW estern blot(A)and quantitative analysis of the ratio ofpan/β-actin(D)protein expression in liver of diabetic rats**P<0.01 vs Con;##P<0.01 vs DM.
3 讨论
糖尿病作为一种慢性进行性内分泌及代谢性病,主要表现为其复杂的并发症对身体健康造成严重的危害。糖尿病肝损伤是其慢性并发症之一,同时,在疾病的发展过程中慢性肝损伤也可以影响糖代谢,加重糖尿病病情,形成恶性循环。糖尿病肝病后期会增加肝硬化、肝癌的发生率。因此,探讨糖尿病肝病发生机制,研究其可能的治疗措施,对于改善糖尿病患者的预后具有重要意义。
临床了解肝功能主要是通过检测血清中ALT、AST、ALP、血清总胆红素(TB)等的水平。正常细胞由于细胞膜的包裹,ALT和AST不会释入血中。肝细胞受到损害后,细胞变性、坏死,细胞膜破碎或细胞膜的通透性增加,肝细胞中所含的ALT和AST就会被释放到血液中,使血中ALT、AST水平增加。本实验观察到DM大鼠空腹血糖和糖化血红蛋白水平均上升,血清ALT、AST水平增高,提示糖尿病诱发了肝功能损伤。
ALDH2是重要的内保护因子,与生物氧化关系密切。Ohta等[8]的研究发现,ALDH2活性缺失型PC12细胞更容易受到脂质过氧化的损伤,且细胞存活率低。俞佳艳等[9]也观察到ALDH2基因高表达可有效地抑制急性心肌梗死后心衰小鼠心肌细胞的凋亡。有文献报道,糖尿病引起代谢紊乱,会使糖原在肝组织堆积,游离脂肪酸过多进入肝组织,导致肝微血管病理性损伤,进一步可能会出现脂肪肝或肝硬化等一系列的肝损伤[10]。本研究中观察到糖尿病大鼠肝功能降低,HE染色显示小叶结构异常,肝细胞边界不清,肿胀,假小叶形成,可见明显的炎性细胞浸润,同时,肝脏ALDH2表达降低,提示糖尿病引起的肝脏损伤可能与肝脏ALDH2的表达降低有关。给予ALDH2激动剂低剂量乙醇干预后,血清中ALT、AST浓度降低,病理改变有所减轻,肝脏ALDH2的表达增加,提示激动ALDH2可改善糖尿病大鼠肝功能,对肝脏有保护作用。
JNK属于促分裂原活化蛋白激酶(mitogen-activatedprotein kinases,MAPK)一族。JNK可以被生长因子、细胞因子和细胞应激等激活。糖尿病代谢紊乱导致的高血糖、高血脂使细胞内活性氧生成增加或清除不足,机体出现氧化应激,进而激活JNK通路,使JNK磷酸化为p-JNK。Kohl等[11]在实验中观察到:糖尿病大鼠肝脏损伤的过程中JNK蛋白表达明显增加。本实验中我们观察到:与对照组相比,糖尿病组大鼠肝组织 ALDH2表达降低的同时,p-JNK、JNK蛋白的表达均明显增高,p-JNK/JNK比值增加,提示糖尿病引起肝脏ALDH2的降低可能导致氧化应激加重,使得JNK和p-JNK表达增加,加重糖尿病肝脏损伤;与糖尿病组相比,乙醇干预后大鼠肝脏ALDH2表达增加,p-JNK、JNK蛋白的表达均明显降低,p-JNK/JNK比值下降,提示激动ALDH2后可能通过降低JNK的活性,进而降低对糖尿病大鼠肝脏的损伤。
Moon等[12]对暴露在四氯化碳中的大鼠研究发现,四氯化碳可以通过活化JNK,进而抑制ALDH2的活性,并最终导致肝脏的严重损伤。其研究说明JNK与ALDH2之间确实存在一定关系,从另一角度也间接支持了本文观点。
当然,高浓度乙醇对肝脏的损伤作用更为大家熟识,报道甚多。邱萍等[13]研究指出,长期大量饮酒可增加体内ROS含量,从而加重肝脏氧化应激,并发生炎症、坏死和纤维化等病理改变。王喜军等[14]使用体积分数为0.5的乙醇诱导大鼠肝损伤模型。而本实验中我们采用体积分数为0.025和0.05的低剂量乙醇,结果显示,给予低剂量乙醇干预,糖尿病大鼠肝功能有所恢复,提示该浓度乙醇未加重肝脏损伤,反而起到保护作用。同时观察到肝脏ALDH2表达增高,p-JNK/JNK比值下降,提示低剂量乙醇作为ALDH2的激动剂对肝脏有一定的保护作用,后期实验中我们将选用利于临床应用的ALDH2特异性激动剂并进一步观察其保护作用,为临床糖尿病引起的肝损伤提供新的治疗手段。
因此,我们得出结论,ALDH2蛋白对糖尿病大鼠肝脏有保护作用;激动ALDH2的表达可能通过抑制JNK通路的活化,减轻肝脏损伤。ALDH2如何调控JNK通路发挥保护作用,有待进一步研究。
参考文献:
[1] Moriyama M,Hayashida JN,Toyoshim T,et al.Cytokine/chemokine profiles contribute to understanding the pathogenesis and diagnosis of primary Sjögren′s syndrome[J].Clin Exp Immunol,2012,169(1):17-26.
[2] Higuchi S,Matsushita S,Masaki T,et al.Influence of genetic variations ofethanolmetabolizing enzymes on phenotypes of alcoholrelated disorders[J].Ann NY Acad Sci,2004,10(25):472-80.
[3] Murata C,SuzukiY,Muramatsu T,etal.Inactive aldehyde dehydrogenase 2 worsens glycemic control in patientswith type2 diabetesmellitus who drink low to moderate amounts of alcohol[J].Alcohol Clin Exp Res,2000,24(4):5s-11s.
[4] Gao Q,Wang H J,Wang X M,et al.Activation of ALDH2 with ethanol attenuates diabetes inducedmyocardial injury in rats[J].Food Chem Toxicol,2013,56:419-24.
[5] Martinovic V,Grigorov I,Bogojevic D,et al.Activation level of JNK and Akt/ERK signaling pathways determinates extent of DNA damage in the liver of diabetic rats[J].Cell Physiol Biochem,2012,30(3):723-34.
[6] Kaneto H,NakataniY,Miyatsuka T,etal.Possiblenovel therapy for diabeteswith cell-permeable JNK-inhibitory peptide[J].Nature Med,2004,10(10):1128-32.
[7] 王洪巨,康品方,叶红伟,等.激动乙醛脱氢酶2对抗糖尿病大鼠心肌缺血/在再灌注损伤的作用[J].中国应用生理学杂志,2012,28(2):133-7.
[7] Wang H J,Kang PF,Ye HW,etal.Effectof ALDH2 activation against myocardial ischemia/reperfusion injury in diabetic rat[J].Chin JApplied Physiol,2012,28(2):133-7.
[8] Ohta S,Ohsawa I,Kamino K,et al.Mitochondrial ALDH2 Deficiency as an Oxidative Stress[J].Ann New York Acad Sci,2004,10(11):36-44.
[9] 俞佳艳,孙爱军,贾建国,等.转染乙醛脱氢酶2基因对心肌梗死后心衰小鼠心功能的影响[J].中国临床医学,2008,15(3):277-80.
[9] Yu JY,Sun AG,Jia JG,etal.Effectsof acetaldehyde dehydrogenase 2 transfection on acutemyocardial infarction induced heart failure in C57BL/6mouse[J].Chin JClin Med,2008,15(3):277-80.
[10]Menendez JA,Vazquez-Martin A,Ortega F J,Fernandez-Rea J M.Fatty acid synthase:association with insulin resistance,type 2 diabetes,and cancer[J].Clin Chem,2009,55(3):425-38.
[11]Kohl T,Gehrke N,Schad A,etal.Diabetic liver injury from streptozotocin is regulated through the caspase-8 homolog cFLIP involving activation of JNK2 and intrahepatic immunocompetent cells[J].Cell Death Dis,2013,4:e712.
[12]Moon K H,Lee YM,Song B J.Inhibition of hepaticmitochondrial aldehyde dehydrogenase by carbon tetrachloride through JNK-mediated phosphorylation[J].Free Radic BiolMed,2010,48(3):391-8.
[13]邱 萍,李 相,孔德松,等.酒精性肝病发展机制研究的新进展[J].中国药理学通报,2014,30(2):160-3.
[13]Qiu P,Li X,Kong D S,et al.Research progress on pathogenesis of alcoholic liver disease[J].Chin Pharmacol Bull,2014,30(2):160-3.
[14]王喜军,刘 莲,孙 晖,等.乙醇诱导大鼠肝损伤的代谢组学和陈蒿汤的干预研究[J].中国药理学通报,2008,24(4):452-7.
[14]Wang X J,Liu L,Sun H,et al.Studies on themetabonomics of rat liverinjury induced by ethanol and interfering effects of Y in Chen Hao Tang[J].Chin Pharmacol Bull,2008,24(4):452-7.

