PLCε对人骨肉瘤细胞迁移侵袭影响的实验研究
吴金霞,曹文嘉,桑苗苗,郑骏年,3,裴冬生
(徐州医学院1.肿瘤生物治疗实验室、2.生理学教研室、3.附属医院临床肿瘤中心,江苏徐州 221002)
磷脂酶Cε(phospholipase C epsilon,PLCε)是一种新型磷脂酰肌醇特异性磷脂酶C(phosphoinositide-specific phospholipase C,PI-PLC),于2001年由Song等[1]发现而获得。由于PLCε是近几年新发现的PLC家族成员,目前国外对PLCε的研究主要集中在其结构及结构域功能上,而对其在肿瘤学方面的研究较少。研究发现[2],PLCε因为同时具有RasGEF和RA结构域而作为Rho和Ras的小GTP酶类效应分子,在G蛋白偶联受体 (G protein-coupled receptors,GPCRs)参与溶血磷脂酸和凝血酶调控磷酸肌醇过程中发挥重要作用。在皮肤化学性致癌的两个阶段,佛波酯可启动携带活化ras癌基因的细胞进行克隆扩增,而缺乏Ras/Rap效应子PLCε-/-的小鼠则表现出对皮肤癌肿瘤形成的抵抗,佛波酯不能诱导基底细胞增殖和表皮增生[3]。这些现象提示PLCε可能参与肿瘤的发生发展。目前,PLCε与骨肉瘤的关系及对骨肉瘤细胞侵袭性研究尚未见报道。本研究拟探讨PLCε对U2OS细胞迁移侵袭能力的影响。
1 材料与方法
1.1 材料 骨肉瘤细胞株U2OS为本实验室保存,购自中国科学院上海细胞库。新生牛血清为杭州四季青公司,siRNA转染试剂SilectFect Lipid Reagent为美国Bio-Rad公司产品。Transwell小室购自美国Corning公司。PLCεsiRNA由上海吉玛制药技术有限公司合成。兔抗人PLCε抗体购自Upstate生物科技有限公司,抗人 β-actin一抗购自美国 Santa Cruz公司。荧光二抗羊抗鼠、羊抗兔IgG购自美国Licor公司,荧光二抗孵育后条带由Odyssey扫描仪扫描处理。
1.2 方法
1.2.1 细胞转染 待细胞处于50%~70%密度时进行,用SilectFect Lipid Reagent转染试剂进行转染。4~6 h后换成含10%新生牛血清的DMEM培养基。48 h后提蛋白进行Western blot检测。PLCε的siRNA序列如下:
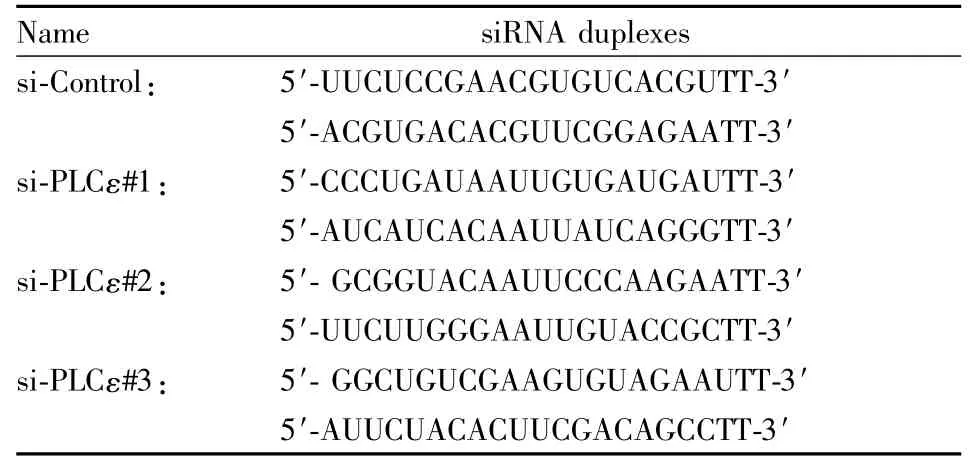
Name siRNA duplexes si-Control:5′-UUCUCCGAACGUGUCACGUTT-3′5′-ACGUGACACGUUCGGAGAATT-3′si-PLCε#1: 5′-CCCUGAUAAUUGUGAUGAUTT-3′5′-AUCAUCACAAUUAUCAGGGTT-3′si-PLCε#2: 5′-GCGGUACAAUUCCCAAGAATT-3′5′-UUCUUGGGAAUUGUACCGCTT-3′si-PLCε#3: 5′-GGCUGUCGAAGUGUAGAAUTT-3′5′-AUUCUACACUUCGACAGCCTT-3′
1.2.2 Western blot检测PLCε在U2OS细胞中的表达
1.2.2.1 细胞总蛋白的提取 取转染后的U2OS,加入冰浴的细胞裂解buffer(含20 mmol·L-1Tris-HCl,150 mmol·L-1NaCl,10 mmol·L-1KCl,0.5 mmol·L-1EDTA,1.5 mmol·L-1MgCl2,0.5 mmol·L-1PMSF,2 mmol·L-1DTT,2.5 mmol·L-1CaCl2及 NP-40、甘油等,pH 7.5),冰上孵育。每5 min用涡旋仪振荡1次,共振荡6次。4℃,15 000×g离心15 min,吸取上清。
1.2.2.2 Western blot检测 以上述细胞总蛋白为样品,配制6%的聚丙烯酰胺凝胶,每个加样孔中依次加入待测样品。电泳后转膜,脱脂奶粉封闭,用抗PLCε抗体4℃孵育过夜,加入荧光羊抗兔IgG的二抗,经Odyssey扫描仪检测PLCε在肿瘤细胞的表达。以siRNA-Control作为对照。
1.2.3 细胞增殖活性的检测 取转染PLCεsiRNA后的骨肉瘤细胞,制成单细胞悬液(1×104·L-1),接种至96孔板,每孔100μl,每组细胞设5个复孔。37℃和5%CO2实验条件下常规培养。于d 1、2、3、4各取出一块96孔板进行检测。每孔加入CCK-8 10μl,37℃培养2 h后,酶标仪上检测450 nm处的吸光度数值。实验重复3次。
1.2.4 划痕实验 转染PLCεsiRNA后的骨肉瘤细胞接种到6孔板中,控制密度在80%左右,待细胞完全贴壁后换用无血清的培养液培养过夜,使细胞休克,停止增殖。用2.5μl枪头在6孔板内划两条相互垂直的线,PBS洗去脱落的细胞,并在划痕旁边做标记,用无血清的培养液培养。选取0、6、12、18和24 h做为时间点,每隔6 h在倒置显微镜下拍照1次。
1.2.5 Transwell小室迁移实验 细胞转染同前,在超净台中将Transwell chamber下室背面均匀的铺上FN胶,风干2 h后置37℃,5%CO2培养箱中过夜。胰酶消化收集细胞,用无血清培养基制成6×104cells·L-1的细胞悬液150μl,加入Transwell小室的上室,下室加入600μl含有10%FBS的DMEM培养基,继续在孵育箱中培养12 h。然后,室温甲醇固定,PBS漂洗,结晶紫染色。用湿棉签小心擦去上室底部膜表面上的细胞后,显微镜下随机取5个视野拍照,计数并统计结果。
1.2.6 明胶酶谱实验 细胞转染同前,转染后48 h换成无血清培养基继续培养24 h。次日收集上清液,将上清液移入离心管,2 000 r·min-1离心10 min,BCA法测定各样品蛋白浓度。根据不同浓度确定样品的上样体积,保证各样品上样的蛋白质量相同,与4×上样缓冲液混合,电泳,分别置于孵育液、洗脱液、脱色液中处理,显现MMP2位于蓝色背景上的透亮带。用凝胶图像分析系统分析读取条带面积,宽度和灰度值,进行统计分析。
1.2.7 统计学处理 Western blot、Transwell小室实验及明胶酶谱实验各重复3次实验结果,采用t检验或单因素方差分析,假设检验水准按α=0.05判定。
2 结果
2.1 沉默 PLCε后 PLCε蛋白水平明显降低Western blot检测结果显示,与对照组相比,PLCε基因的特异性干扰片段si-PLCε#1、si-PLCε#2和si-PLCε#3均能使细胞PLCε蛋白表达量在一定程度上降低,而si-PLCε#3使PLCε蛋白下降的最为明显(Fig 1)。因此之后用于沉默PLCε的实验均选用si-PLCε#3。

Fig 1 Effect of PLCεknockdown on protein levels of PLCε**P<0.01 vs si-Ctrl(n=3)
2.2 PLCε沉默后对骨肉瘤细胞增殖活性的影响U2OS细胞转染si-PLCε#3后,使用CCK-8法检测siCtrl组和siPLCε组在不同时间点的增殖活性,结果发现,siPLCε组与siCtrl组相比,各个时间点细胞的增殖活性差异均无统计学意义(P>0.05,Fig 2)。
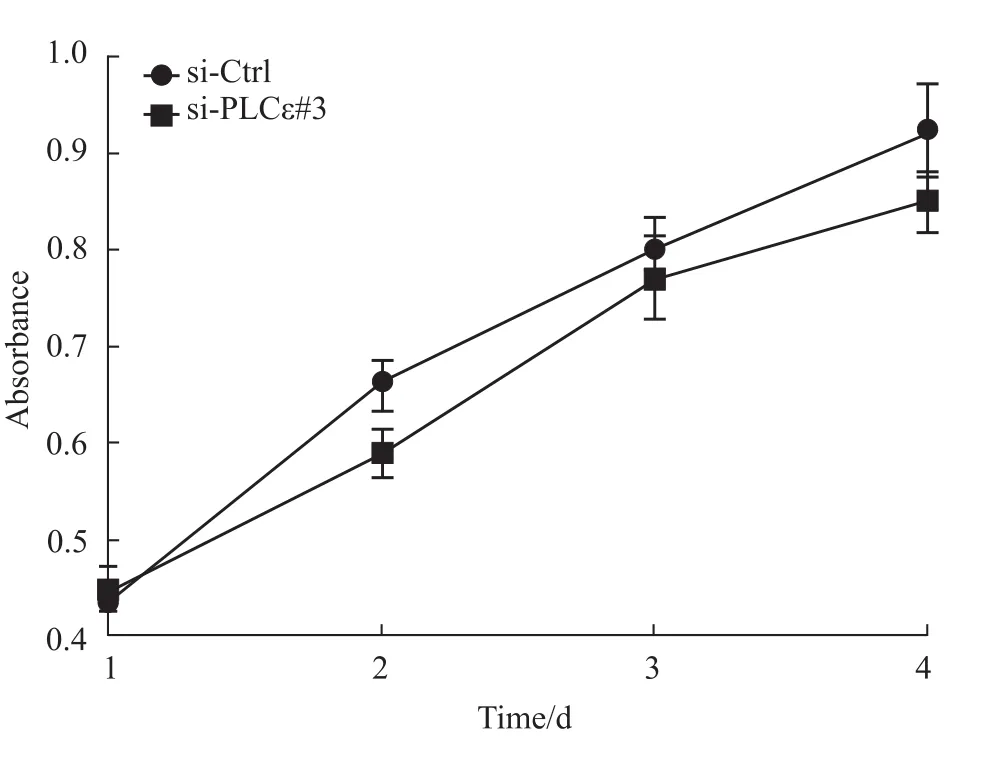
Fig 2 Effect of PLCεknockdown on U2OS cell proliferation
2.3 PLCε沉默后对细胞划痕愈合能力的影响 在转染si-PLCε#3 48 h后,用细胞划痕实验检测沉默PLCε对细胞划痕愈合速度的影响。结果显示,在0 h,siCtrl组和siPLCε组U2OS细胞的迁移距离无明显差异,而24 h后,siPLCε组相对于siCtrl组细胞迁移距离有所减慢,差异有统计学意义(P<0.05,Fig 3)。提示沉默PLCε能抑制细胞的迁移能力。
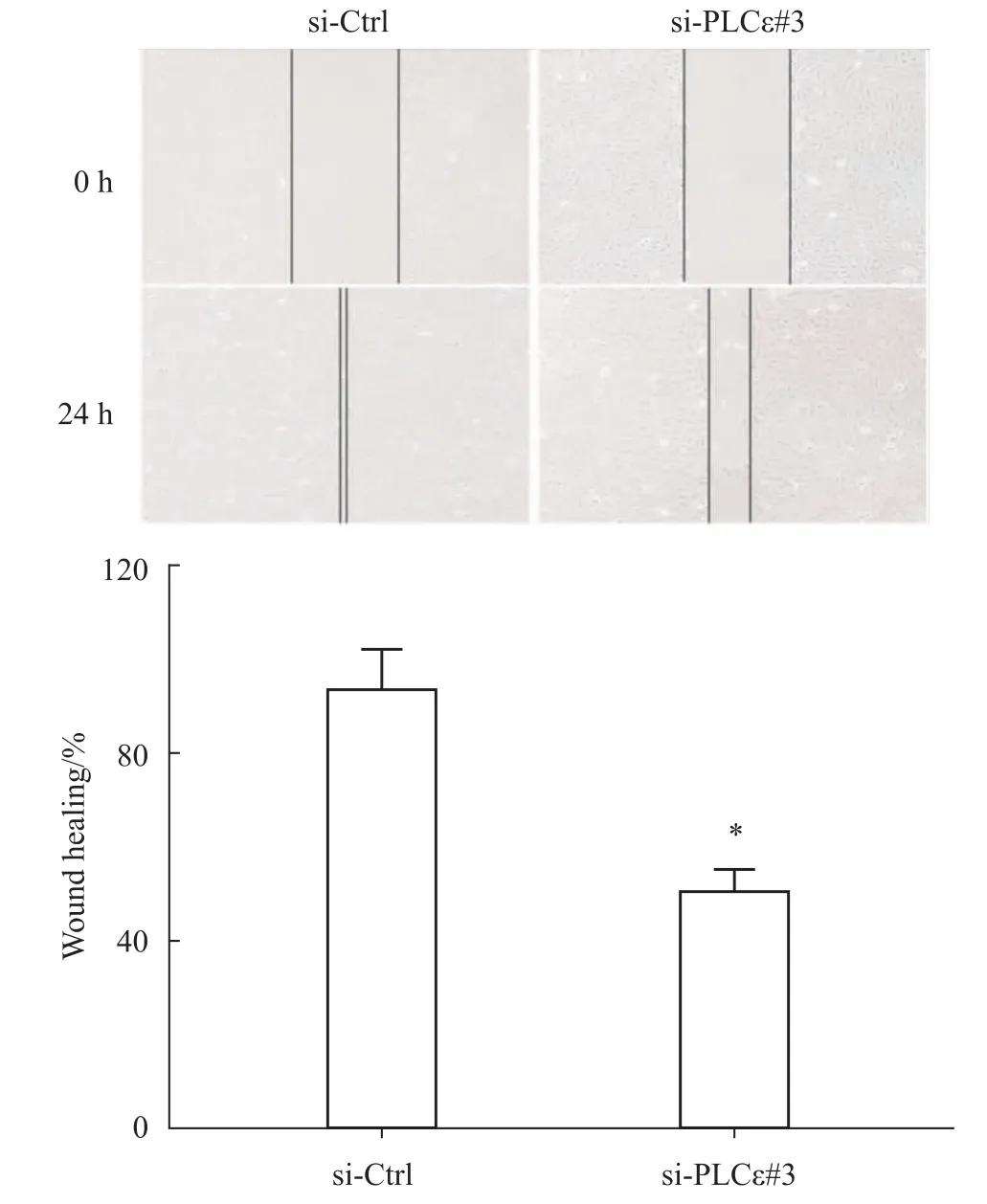
Fig 3 Effect of PLCεknockdown on wound healing ability of osteosarcoma cells(×100)*P<0.05 vs si-Ctrl(n=3)
2.4 PLCε沉默抑制细胞的迁移能力 实验结果显示,在沉默PLCε48 h后,沉默组迁移的细胞相对于siCtrl组明显减少,迁移细胞的百分比由100%下降到47.5%,差异有统计学意义(P<0.01)。提示PLCε对骨肉瘤细胞的迁移能力可能具有重要调节作用(Fig 4)。
2.5 沉默 PLCε降低细胞对基质金属蛋白酶MMP2的分泌 明胶酶谱实验检测结果显示,抑制PLCε的表达后骨肉瘤细胞分泌MMP2的量明显减少。灰度分析其MMP2表达量由100%减少到44%,差异有统计学意义(P<0.01)。说明沉默PLCε能下调细胞对MMP2的分泌(Fig 5)。
3 讨论
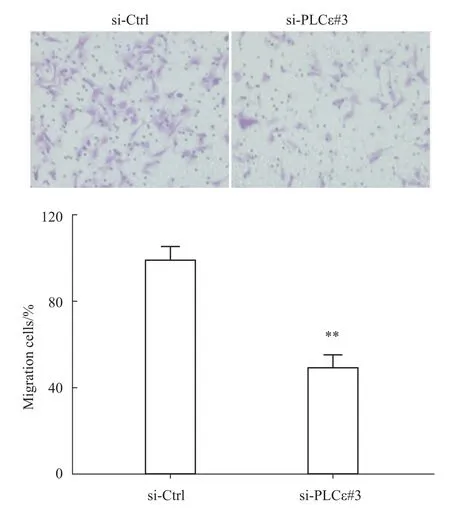
Fig 4 Effect of PLCεknockdown on cellm igration(×200)**P<0.01 vs si-Ctrl(n=3)
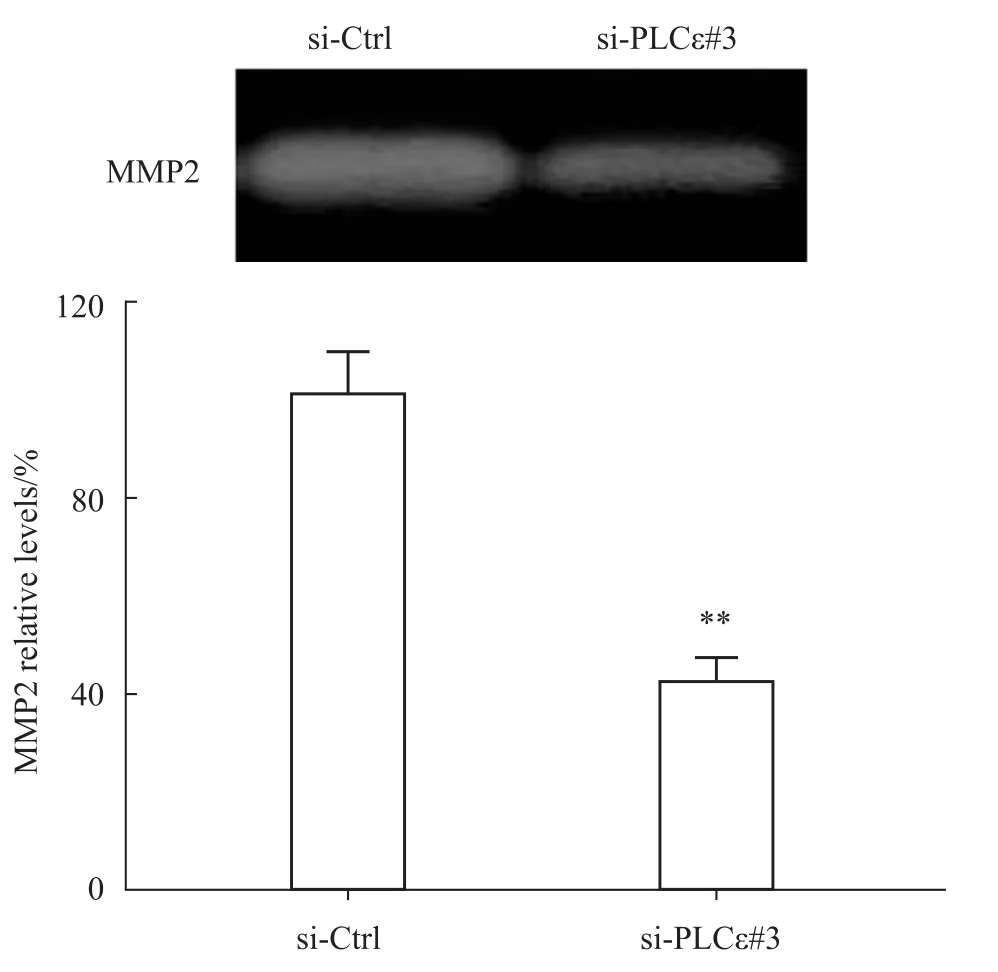
Fig 5 Effect of PLCεknockdown on secretion of MMP2 in osteosarcoma cells**P<0.01 vs si-Ctrl(n=3)
骨肉瘤是最常见的原发骨恶性肿瘤,多发于四肢长管状骨干骺端,尤其是股骨远端、胫骨近端和肱骨近端。肺转移是患者死亡的主要原因。近年来,虽然骨肉瘤的治疗技术和手段有了一定发展,但骨肉瘤的侵袭性生长和转移仍是导致患者死亡的重要原因之一[4]。
Shibatohge等发现一种能与Ras蛋白相结合的新型磷脂酶 C,相对分子质量为210 ku,命名为PLC210[5]。随后在哺乳动物中克隆出与PLC210同源序列的PLC,命名为PLCε。PLCε除具有与其它PLC家族成员典型的催化结构域(X,Y)和C2结构域外,还具有特异性RA结构域和CDC25结构域。CDC25结构域位于PLCε的N端,具有鸟嘌呤核苷酸交换活性,可通过 H-Ras激活 MAPK途径[6]。CDC25的鸟嘌呤核苷酸交换活性也能使Rap1A磷酸化,从无活性的 Rap1A-GDP变成有活性的Rap1A-GTP而被激活,活化的Rap1A进一步激活下游B-Raf和有丝分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK),引起酶促级联反应,最后激活ERK[7]。位于 PLCεC端两个并联排列的RA结构域(RA1和RA2),为Ras激活PLCε的作用区域。作为新发现的PLC的同工酶,PLCε在肿瘤中的研究报道较少。
Li等[8]报道PLCε可通过扩大炎症及血管形成促使Apc(Min/+)大鼠肠癌的发生。Bai和 Oka等[9,10]发现 PLCε可能与皮肤癌的增殖有关,此作用在星形胶质瘤细胞中也得到验证[2]。Bourguinon等[11]研究表明,CD44激活 RhoA-PLCε生成 IP3,引起细胞内 Ca2+释放以及 Ca2+/钙调蛋白激酶Ⅱ(CaMKⅡ)上调,从而导致细胞骨架蛋白丝蛋白磷酸化。丝蛋白磷酸化后可降低与丝状肌动蛋白的相互作用,而促进肿瘤的转移。Yu等[12]发现PLCε在胃癌中高表达,而且其表达量与肿瘤的恶性程度、侵袭能力、淋巴结转移和远处转移密切相关。在中国哈萨克族人群食管鳞状上皮癌的研究中也有类似发现[13]。由此推测,PLCε在肿瘤的迁移和侵袭中扮演着重要角色。
为研究PLCε下调对骨肉瘤细胞迁移侵袭的影响,本研究使用siRNA,将其转染入U2OS细胞发挥基因沉默的作用。对照组及PLCε沉默组分别检测其蛋白表达水平变化,同时检测细胞增殖能力、划痕愈合能力、迁移能力及分泌基质金属蛋白酶(matrix metalloproteinases,MMPs)的情况。结果显示siRNA成功转染入U2OS骨肉瘤细胞,能特异性使PLCε的蛋白表达量下降。PLCε的下调对肿瘤细胞增殖无明显影响,却可明显降低骨肉瘤细胞的划痕愈合能力和迁移能力。降解细胞外基质和破坏基底膜是恶性肿瘤向远端侵袭和转移的重要步骤。MMPs是这一过程中的关键性酶。MMP2属于MMPs家族成员,能降解细胞外基质中的各种蛋白成分,在肿瘤的浸润转移中发挥重要的作用[14-15]。而沉默 PLCε后骨肉瘤细胞分泌基质金属蛋白酶MMP2的水平明显下降。本研究显示PLCε下调对骨肉瘤细胞的迁移侵袭有明显的抑制作用,经PLCε沉默处理的细胞侵袭力和迁移力明显降低。其分子机制可能是通过减少U2OS细胞对MMP2的分泌,从而降低其对细胞外基质的降解,导致细胞迁移力降低。我们的实验结果提示PLCε参与调控骨肉瘤细胞的迁移侵袭,对人骨肉瘤细胞的侵袭及迁移能力可能存在一定正性调控作用。
参考文献:
[1] Song C,Hu C D,Masago M,et al.Regulation of a novel human phospholipase C,PLCepsilon,throughmembrane targeting by Ras[J].JBiol Chem,2001,276(4):2752-7.
[2] Citro S,Malik S,Oestreich E A,etal.Phospholipase Cepsilon is a nexus for Rho and Rap-mediated G protein-coupled receptor-induced astrocyte proliferation[J].Proc Natl Acad SciUSA,2007,104(39):15543-8.
[3] Ikuta S,Edamatsu H,Li M,et al.Crucial role of phospholipase C epsilon in skin inflammation induced by tumor-promoting phorbol ester[J].Cancer Res,2008,68(1):64-72.
[4] 王国红,郭直岳,石松林,李祺福.肉桂酸对人骨肉瘤MG-63细胞增殖和分化的影响 [J].中国药理学通报,2012,28(9):1262-6.
[4] Wang GH,Guo Z Y,ShiSL,LiQ F.Effectof cinnamic acid on proliferation and differentiation ofhuman osteosarcoma MG-63 cells[J].Chin Pharmacol Bull,2012,28(9):1262-6.
[5] Shibatohge M,Kariya K,Liao Y,etal.Identification of PLC210,a Caenorhabditis elegans phospholipase C,as a putative effector of Ras[J].JBiol Chem,1998,273(11):6218-22.
[6] Lopez I,Mak E C,Ding J,et al.A novel bifunctional phospholipase c that is regulated by Galpha 12 and stimulates the Ras/mitogen-activated protein kinase pathway[J].J Biol Chem,2001,276(4):2758-65.
[7] Jin TG,Satoh T,Liao Y,etal.Role of the CDC25 homology domain of phospholipase Cepsilon in amplification of Rap1-dependent signaling[J].JBiol Chem,2001,276(32):30301-7.
[8] Li M,Edamatsu H,Kitazawa R,et al.Phospholipase Cepsilon promotes intestinal tumorigenesis of Apc(Min/+)mice through augmentation of inflammation and angiogenesis[J].Carcinogenesis,2009,30(8):1424-32.
[9] Bai Y,Edamatsu H,Maeda S,et al.Crucial role of phospholipase Cepsilon in chemical carcinogen-induced skin tumor development[J].Cancer Res,2004,64(24):8808-10.
[10]Oka M,Edamatsu H,Kunisada M,etal.Enhancementof ultraviolet B-induced skin tumor development in phospholipase Cepsilonknockoutmice is associated with decreased cell death[J].Carcinogenesis,2010,31(10):1897-902.
[11] Bourguignon L Y,Gilad E,Brightman A,et al.Hyaluronan-CD44 interaction with leukemia-associated RhoGEF and epidermal growth factor receptor promotes Rho/Ras co-activation,phospholipase C epsilon-Ca2+signaling,and cytoskeleton modification in head and neck squamous cell carcinoma cells[J].J Biol Chem,2006,281(20):14026-40.
[12]Yu S,Wu F,Guo K,etal.Expression of phospholipase C epsilon-1 in gastric cancer and its association with prognosis[J].Zhonghua Wei Chang Wai Ke Za Zhi,2014,17(4):378-82.
[13]Chen Y Z,Cui X B,Hu JM,et al.Overexpression of PLCE1 in Kazakh esophageal squamous cell carcinoma:implications in cancer metastasis and aggressiveness[J].APMIS,2013,121(10):908-18.
[14]Shah F D,Shukla SN,Shah PM,et al.Clinical significance of matrixmetalloproteinase 2 and 9 in breast cancer[J].Indian J Cancer,2009,46(3):194-202.
[15]Roomi M W,Monterrey J C,Kalinovsky T,et al.Patterns of MMP-2 and MMP-9 expression in human cancer cell lines[J].Oncol Rep,2009,21(5):1323-33.

