5型腺病毒载体对人T淋巴细胞的转染及细胞毒性分析*
张文峰,张琼宇,邵红伟,吴凤麟,王腾,黄树林△
(1广东药学院生命科学与生物制药学院,2广东省生物技术候选药物研究重点实验室,广东广州 510006;3永州职业技术学院基础医学部,湖南永州 425100)
·短篇论著·
5型腺病毒载体对人T淋巴细胞的转染及细胞毒性分析*
张文峰1,2,张琼宇3,邵红伟1,2,吴凤麟1,2,王腾1,2,黄树林1,2△
(1广东药学院生命科学与生物制药学院,2广东省生物技术候选药物研究重点实验室,广东广州 510006;3永州职业技术学院基础医学部,湖南永州 425100)
目的:利用5型腺病毒载体转染人T淋巴细胞,对其转染T淋巴细胞的效率以及细胞毒性进行分析。方法:选取T淋巴瘤Jurkat细胞及原代T细胞,腺病毒按感染复数(multiplicity of infection,MOI)为20、50、100、200和400对其转染,转染48 h后利用流式细胞术检测转染效率;选取腺病毒转染后的不同时点,利用碘化丙啶染色法分析转染对于细胞周期的影响;利用Annexin V/7-AAD染色法分析转染诱导细胞凋亡情况;利用台盼蓝染色计数法分析转染对活细胞数目的影响。结果:5型腺病毒载体转染T淋巴瘤的效率最高,转染效率随着MOI值的增大而增加;CD8+T细胞和CD4+T细胞的转染效率大致相同,T细胞经刺激活化后,CD8+T细胞的转染效率下降;病毒转染未导致明显细胞凋亡;病毒转染对细胞周期与活细胞数目没有显著影响。结论:5型腺病毒载体转染T细胞呈现较低细胞毒性。
腺病毒载体;T淋巴细胞;细胞毒性
T细胞通过膜表面的T细胞受体(T-cell receptor,TCR)发挥抗原识别作用[1-2]。利用抗原特异性TCR基因修饰T细胞进行过继性移植/回输,在抑制肿瘤生长、控制病毒感染等方面具有良好的前景[3-4]。腺病毒载体因具有能感染增殖和非增殖细胞、无插入致突变性、能同时表达多个外源基因等优点,是基因治疗中的理想载体工具,有望在TCR基因修饰T细胞治疗中发挥重要作用。
目前主要使用的腺病毒载体为血清型5型腺病毒(adenovirus serotype 5,Ad5)载体,本实验利用Ad5转染人T淋巴瘤Jurkat细胞及原代T细胞,确定其转染效率;并在转染后的各个不同时点进行细胞周期、细胞凋亡和活细胞数目检测,评价Ad5转染的细胞毒性,为进一步研究腺病毒载体在TCR基因修饰T细胞的过继性治疗的临床应用奠定基础。
材料和方法
1 材料
Jurkat细胞为本实验室保存,腺病毒穿梭载体pDC315与骨架载体pBHGloxΔE1,3Cre购自Microbix。淋巴细胞分离液购自灏洋生物制剂技术公司,AIM-V无血清培养基和无血清RPMI-1640培养基购自Gibco,胰蛋白酶购自Amresco,胎牛血清购自Gibco,propidium iodide购自TaKaRa,流式细胞术检测抗体CD8-PE、CD4-PE-Cy5和Annexin V/7-AAD细胞凋亡检测试剂盒购自Ebioscience,Trypan blue购自广州威佳生物公司,CO2细胞培养箱购自Thermo,Coulter Elite流式细胞仪购自贝克曼公司。
2 方法
2.1 淋巴细胞的分离和培养取健康人外周血,Ficoll-Hapaque密度梯度离心法分离健康供血者外周血单个核细胞(peripheral blood mononuclear cells,PBMC),用RPMI-1640将细胞调至2×109/L。移至培养瓶中竖立培养(20 mL/瓶),再加入10%胎牛血清和2×104IU/L白细胞介素2(interleukin 2,IL-2),37℃培养。
2.2 病毒转染分离的PBMC以1×109cells/L在AIM-V无血清培养基中培养72 h,细胞刺激活化组则在培养基中补加有终浓度6×105IU/L IL-2和10 μg/L anti-CD3抗体;1 000×g离心5 min,弃上清,AIM-V无血清培养基重悬细胞为1×109cells/L,接种至12孔细胞培养板中,按不同感染复数(multiplicity of infection,MOI)加入腺病毒并置于细胞培养箱中培养12 h;1 000×g离心5 min,弃上清,加入新鲜AIM-V无血清培养基继续培养至不同时点。
2.3 细胞周期的测定取腺病毒转染后不同时点的T细胞,800×g离心10 min弃上清;PBS洗1次,800×g离心10 min弃上清;加0.5 mL PBS吹匀;用5 mL注射器将细胞吸起,用力打入5 mL 70%预冷乙醇中,4℃固定过夜;800×g离心15 min收集固定细胞,PBS洗2次;用0.4 mL PBS重悬细胞并转至tube中轻轻吹打;加RNase-A约3 μL至终浓度约为50 mg/L,37℃水浴消化30 min;加PI约50 μL至终浓度约为65 mg/L,在冰浴中避光染色30 min;经尼龙网过滤,上流式细胞仪检测。
2.4 细胞凋亡的检测取腺病毒转染后不同时点的Jurkat细胞,800×g离心10 min,弃上清;PBS洗1次,800×g离心10 min,弃上清;加2 mL结合缓冲液重悬细胞,800×g离心10 min,弃上清;加100 μL结合缓冲液重悬细胞,随后加入5 μL Annexin V-PE,室温避光孵育15 min;加入2 mL结合缓冲液重悬细胞,800×g离心10 min,弃上清;加500 μL结合缓冲液重悬细胞,随后加入5 μL 7-AAD,上流式细胞仪检测。
2.5 细胞计数选取生长状态良好的Jurkat细胞接种于12孔细胞培养板,每孔5×105细胞,按所选MOI值加入腺病毒,未经病毒转染组为对照组;放置37℃培养48 h和72 h后,经台盼蓝染色后计数活细胞数目,取4个孔的均值。
3 统计学处理
采用SPSS 17.0统计软件分析。数据用均数±标准差(mean±SD)表示,采用方差分析(ANOVA)对组间差异进行显著性检验。以P<0.05为差异有统计学意义。
结果
1 Ad5针对T细胞的转染效率
Ad5-GFP转染各种T细胞48 h后的效率见图1。在MOI值相同时,Ad5-GFP对T淋巴瘤细胞的转染效率最高,并且随着MOI值的升高,转染效率随之增加;当MOI为400时,大约60%的细胞表达绿色荧光蛋白(green fluorescent protein,GFP)。Ad5-GFP对原代CD8+T细胞和CD4+T细胞的转染能力大致相当,转染效率并未随MOI值的升高而显著增加;在MOI为400时,约15%的CD8+T细胞和约13%的CD4+T细胞表达GFP。当外周血T细胞预先用CD3抗体和IL-2、干扰素γ(interferon γ,IFN-γ)等细胞因子刺激活化后,CD8+T细胞和CD4+T细胞所占比例有所提高,CD8+T为50%,CD4+T为32%(结果未显示),在MOI为400时,约9%的CD4+T细胞被成功转染;经刺激活化后,Ad5-GFP针对CD8+T细胞的转染效率明显下降,在MOI为400时,仅4%的CD8+T细胞被转染。

Figure 1.The Ad5 transfection efficiencies for T cells.Mean±SD.n=3.*P<0.05,**P<0.01 vs MOI 20 group.图1 Ad5针对T淋巴细胞转染效率结果
2 Ad5转染T细胞诱导细胞凋亡情况
磷脂酰丝氨酸(phosphatidylserine,PS)位于细胞膜磷脂双分子层的内侧,当细胞发生早期凋亡时,PS会发生外翻到细胞膜脂双层外侧,外翻的PS会被Annexin V结合,而染料7-AAD无法通过细胞膜而进入到细胞内部,Annexin V+/7-AAD-细胞即为早期凋亡细胞;细胞发生晚期凋亡时,染料7-AAD会穿过凋亡细胞膜上小孔进入细胞内部,Annexin V+/7-AAD+细胞即为晚期凋亡细胞。Ad5-GFP转染Jurkat细胞后不同时点,利用Annexin V-PE/7-AAD检测细胞凋亡情况,如图2所示,相比未发生病毒转染的对照组细胞,病毒转染后早期凋亡细胞与晚期凋亡细胞所占的比例均没有出现明显增加。图2中还列出了病毒转染后细胞结合染料Annexin V-PE的平均荧光强度(mean fluorescent intensity,MFI),该值反映出每个细胞所结合染料Annexin V的情况,细胞膜上发生外翻的PS越多,其MFI值就越大。在病毒转染后的相同时点,随着病毒MOI值的增加,其MFI值出现递减的趋势。MFI值的减少也许与腺病毒通过细胞胞吞方式进入细胞内有关。
3 Ad5转染T细胞对细胞增殖能力的影响
经不同MOI值转染的Jurkat细胞,被植物血凝素刺激不同时间(48 h和72 h)后活细胞数目的变化情况见图3。随着刺激时间增加,所选MOI值转染条件下的细胞数目均有增加;在同一刺激时段,与未发生病毒转染的对照组相比较,各MOI值转染条件下的细胞数目未发现明显下降,表明Jurkat细胞在被腺病毒转染后,对外界刺激所具有的增殖能力并未受到影响。
4 Ad5转染T细胞对细胞周期影响
在病毒转染T细胞后48 h和72 h,相对于未发生病毒转染的阴性对照组细胞,处于G0/G1期、S期和G2/M期的细胞比例未见明显变化,没有出现细胞周期阻滞于某个时期,见表1。
讨论
Ad5利用病毒纤毛头节区结合细胞膜表面的柯萨奇-腺病毒受体(coxsackie-adenovirus receptor,CAR)完成病毒与靶细胞的吸附,然后通过病毒纤毛基底部五邻体与靶细胞膜表面的整合素相互作用内化到细胞中并进入溶酶体,最后腺病毒颗粒转位到细胞核,通过核孔将病毒DNA释放到细胞核内[5]。本实验发现Ad5-GFP转染Jurkat细胞的效率明显高于原代T淋巴细胞,也许和Jurkat细胞表面的CAR与整合素的表达有关;抗体和细胞因子刺激活化后的CD8+T细胞表现出更难以被Ad5-GFP转染,或许是刺激活化导致细胞CAR与整合素的表达水平发生变化,也可能与病毒颗粒在细胞内的运输效率有关[6],有关Ad5在T细胞中运输的分子机制有待进一步研究。

Figure 2.The apoptosis of Jurkat cells after Ad5 transfection detected by flow cytometry and Annexin V/7-AAD staining.Mean±SD.n=3.MFI:mean fluorescent intensity.图2 Ad5转染Jurkat细胞后不同时点细胞凋亡检测结果
在本实验所选择的MOI值条件下,磷脂酰丝氨酸外翻细胞的所占比例未显著提高,未发现Ad5转染导致T细胞的显著凋亡。实验中发现病毒MOI值的增加导致单个细胞上磷脂酰丝氨酸外翻数目减少的现象,可能与腺病毒诱导细胞胞吞进入细胞的方式有关。以往研究结果表明胆固醇在腺病毒的胞吞过程中发挥重要作用[7],磷脂酰丝氨酸是否在腺病毒的胞吞过程中起到重要作用以及具体参与方式等问题,有待进一步的研究。
逆转录病毒载体以及慢病毒载体是目前基因治疗中最常用的2种病毒载体,但由于其滴度偏低、可能在淋巴细胞基因组内随机插入产生致瘤的风险,因此并不是TCR基因修饰T细胞过继性治疗中的理想载体[8]。本研究对Ad5转染T淋巴细胞的效率以及细胞毒性进行了初步的分析,发现Ad5转染原代T淋巴细胞的效率偏低,以往研究结果表明增加病毒转染的MOI值将会有效提高病毒转染靶细胞的能力[9],因此可以采用提高MOI值的方法提高Ad5转染原代T细胞的效率;在细胞周期检测中,未发现Ad5转染引起细胞周期阻滞;在活细胞计数的实验中,T细胞对刺激的活化增殖能力未受到Ad5转染的影响,表明Ad5介导转染T细胞的低细胞毒性。综上所述,Ad5腺病毒载体是TCR基因治疗的一种合适载体,在以后的临床应用中具有广阔的前景。
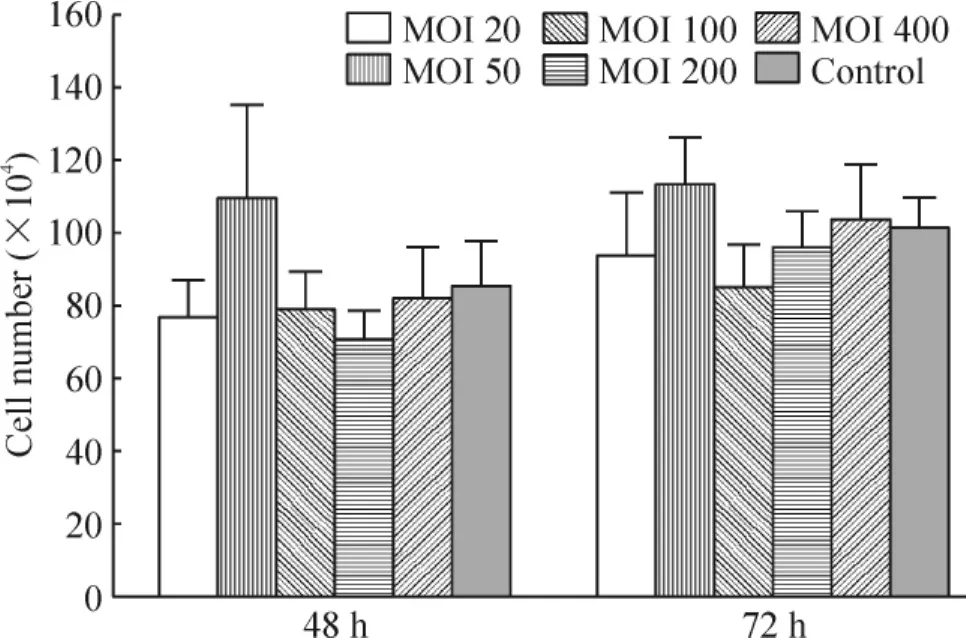
Figure 3.The effects of transfection with Ad5 on the proliferation of Jurkat cells.Mean±SD.n=5.图3 Ad5转染Jurkat细胞后不同时点细胞计数结果
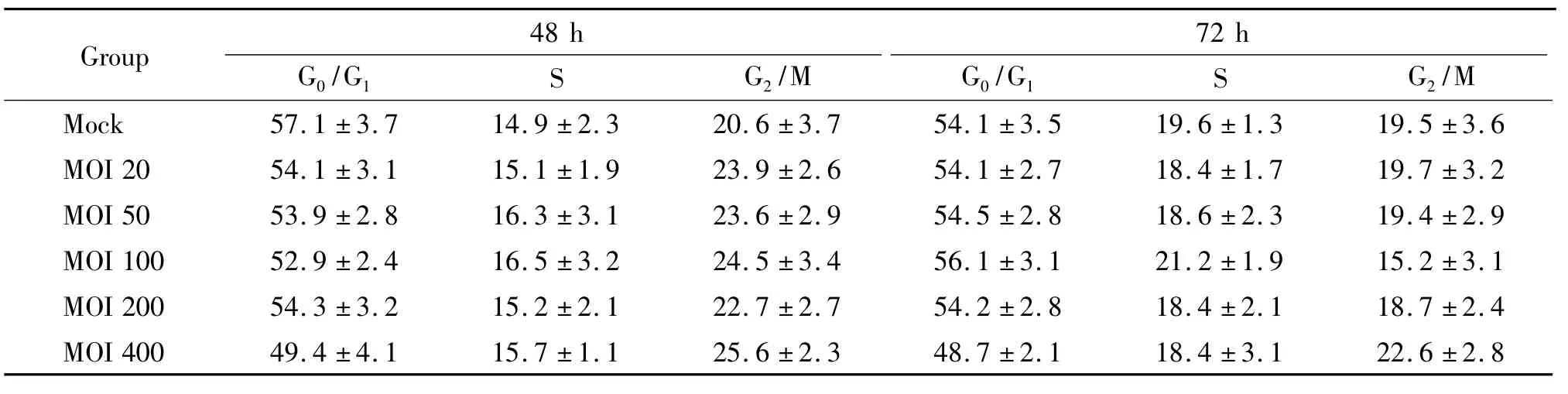
表1 Ad5转染T细胞后不同时点细胞周期分析结果Table 1.The effects of transfection with Ad5 on the cell cycle of T lymphocytes(Mean±SD.n=3)
[1]Bjorkman PJ,Saper MA,Samraoui B,et al.The foreign antigen binding site and T cell recognition regions of class I histocompatibility antigens[J].Nature,1987,329 (6139):512-518.
[2]张文峰,张巨峰,邵红伟,等.人TCA-12-2/TCB-7.1真核双表达载体的构建与表达[J].中国病理生理杂志,2008,24(3):527-531.
[3]Clay TM,Custer MC,Sachs J,et al.Efficient transfer of a tumor antigen-reactive TCR to human peripheral blood lymphocytes confers anti-tumor reactivity[J].J Immunol,1999,163(1):507-513.
[4]Morgan RA,Dudley ME,Wunderlich JR,et al.Cancer regression in patients after transfer of genetically engineered lymphocytes[J].Science,2006,314(5796): 126-129.
[5]Nicklin SA,Wu E,Nemerow GR,et al.The influence of adenovirus fiber structure and function on vector development for gene therapy[J].Mol Ther,2005,12(3):384-393.
[6]Drouin M,Cayer MP,Jung D.Adenovirus 5 and chimeric adenovirus 5/F35 employ distinct B-lymphocyte intracellular trafficking routes that are independent of their cognate cell surface receptor[J].Virology,2010,401(2):305-313.
[7]Imelli N,Meier O,Boucke K,et al.Cholesterol is required for endocytosis and endosomal escape of adenovirus type 2[J].J Virol,2004,78(6):3089-3098.
[8]Hacein-Bey-Abina S,von Kalle C,Schmidt M,et al.A serious adverse event after successful gene therapy for X-linked severe combined immunodeficiency[J].N Engl J Med,2003,348(3):255-256.
[9]Chen Z,Ahonen M,Hamalainen H,et al.High-efficiency gene transfer to primary T lymphocytes by recombinant adenovirus vectors[J].J Immunol Methods,2002,260 (1-2):79-89.
Transfection efficiency and cytotoxicity in human T lymphocytes infected with Ad5 adenoviral vector
ZHANG Wen-feng1,2,ZHANG Qiong-yu3,SHAO Hong-wei1,2,WU Feng-lin1,2,WANG Teng1,2,HUANG Shu-lin1,2
(1School of Life Science&Biopharmacology,2Guangdong Provincial Key Laboratory of Biotechnology Candidate Drug Research,Guangdong Pharmaceutical University,Guangzhou 510006,China;3Department of Basic Medical Science,Yongzhou Vocational Technical College,Yongzhou 425100,China.E-mail:shulhuang@sina.com)
AIM:To determine the transfection efficiencies and to evaluate the cytotoxicity of infection with Ad5 adenoviral vector in human T lymphocytes.METHODS:The T-lymphoma Jurkat cell line,normal CD3+T cells and pre-stimulated CD3+T cells were transfected with Ad5 adenovirus at multiplicities of infection(MOI)ranging from 20 to 400.GFP expression was analyzed by flow cytometry 48 h after transfection.The cells were harvested 24 h,48 h and 72 h after transfection.The cell cycle was analyzed using propidium iodide staining and the apoptosis of T lymphocytes was detected by annexin V/7-AAD staining.Trypan blue exclusion assay was used to determine the survival cell numbers after 48 h or 72 h of transfection.RESULTS:The transfection of primary human T cells by the Ad5 virus was less efficient than that of a T-lymphoma cell line.Similar transfection efficiency was observed in both CD4+T lymphocytes and CD8+T lymphocytes.The activation of T lymphocytes resulted in a decrease in Ad5 transfection efficiency in CD8+T cells.Following transfection(24 h,48 h and 72 h),the percentages of G0/G1-phase cells,S-phase cells,G2/M-phase cells and apoptotic cells at all MOI did not change significantly.Therefore,transfection by the Ad5 adenoviral vector did not influence the cell cycle and survival cell numbers.CONCLUSION:The Ad5 adenoviral vector,which shows little cytotoxicity to T lymphocytes,may be a valuable tool for T cell receptor gene therapy.
Adenoviral vector;T lymphocytes;Cytotoxicity
1000-4718(2014)02-0318-05
R363
A
10.3969/j.issn.1000-4718.2014.02.022
2013-09-05
2013-12-23
科技部“重大新药创制”科技重大专项“十一五”计划项目(No.2009ZX09103-708);国家自然科学基金资助项目(No.31100664;No.31300737;No.81303292);东莞市科技计划项目(No.2011105102027)
△通讯作者Tel:020-39352201;E-mail:shulhuang@sina.com

