高血尿酸与胰岛素抵抗及血脂指标的相关性研究
宋丹丹,张 川,杨 杰,张小平,李艳华,孙立娟*
高血尿酸与胰岛素抵抗及血脂指标的相关性研究
宋丹丹1,张 川2,杨 杰1,张小平3,李艳华1,孙立娟1*
(1.吉林大学中日联谊医院内分泌科,吉林长春130033;2.吉林大学第二医院内分泌科;3.吉林大学中日联谊医院妇产科)
尿酸是嘌呤代谢的最终产物,高尿酸血症(HUA)是一种嘌呤代谢障碍性疾病。HUA是痛风发生的病理基础,其患病率受到多种因素的影响,与遗传、性别、年龄、生活方式、饮食习惯、药物治疗和经济发展程度等有关。HUA患者多数无症状,近年来研究发现其常与高血压、糖尿病、肥胖、血脂异常、代谢综合征等疾病密切相关,根据近年各地HUA患病率的报道,目前我国约有HUA者1.2亿,约占总人口的10%,高发年龄为中老年男性和绝经后女性,但近年来有年轻化趋势[1]。本研究探讨HUA患者的血糖、HbA1c、血脂及胰岛功能等指标的变化。
1 资料和方法
1.1 对象 选取我院收治的120例患者,男83名,女37名,年龄平26-68(平均48.3±11.2)岁,其中HUA组(HUA组)56例,余64例为血尿酸正常组,以上所选患者均为近2个月未服用降尿酸药物,B超检查已排除泌尿系结石,无泌尿系结石及血尿史,未服用水杨酸制剂、利尿剂及糖皮质激素等影响尿酸代谢与清除的药物,HUA组血尿酸以男性≥420μmol/l,女性≥360μmol/l[2]为阳性。
1.2 方法
1.2.1 体质量指数(BMI)测定 采用标准体质量称,去鞋后测量体质量(kg)和身高(m),均测2次,取平均值。BMI=体质量(kg)/[身高(m)]2。
1.2.2 胰岛素抵抗(IR) 胰岛素抵抗指数可反应IR情况,IR可按照HOMA-IR公式计算,HMOAIR=FPG×FINS/22.5,(HOMA-IR)≥2.69(据全国糖尿病协作组调查数据,中国人群的HMOA-IR上四分位数)考虑存在IR[3]。
1.2.3 生化检测 所以研究对象于清晨禁食12h后取静脉血,检测空腹血糖(FPG)、糖化血红蛋白(HbA1c)、尿酸(UA)、甘油三酯(TG)、总胆固醇(CH)、低密度脂蛋白胆固醇(LDL)、高密度脂蛋白胆固醇(HDL)、空腹胰岛素(FINS)。血液生化指标测定采用本院Backman CX9自动生化仪器检测;FPG采用葡萄糖氧化酶-过氧化酶法;HbA1c利用层析法,仪器使用日本东曹株式会社生产TOSOHG7自动糖化血红蛋白分析仪及其配套试剂。用放射免疫法测定FINS,依据检测值计算HOMA-IR指数,进而评价IR[4]。
1.3 统计学方法 应用SPSS17.0统计软件处理,计量资料均以_x±s表示,差异检验采用t检验,进行相关分析,P<0.05表示差异具有统计学意义;计数资料采用χ2检验,检验水准为0.05,相关分析用Pearson相关分析。
2 结果
2.1 HUA组与正常对照组BMI、血生化指标及FINS比较(见表1)
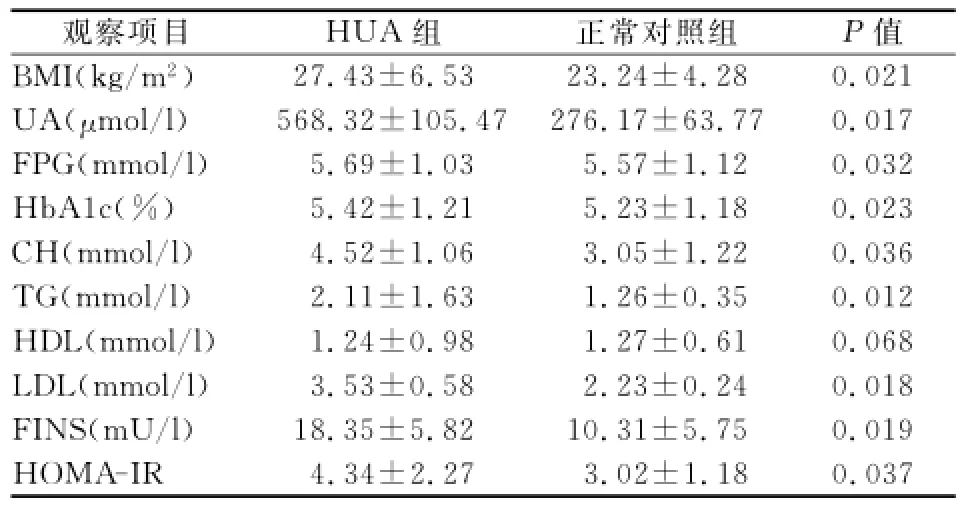
表1 HUA组与正常对照组BMI、血生化指标及FINS比较
HUA组BMI、FPG、UA、HbA1c、CH、TG、LDL、FINS及HOMA-IR水平明显高于对照组(P<0.05);HDL水平两组差异无统计学意义(P>0.05)。
2.2 UA与HOMA-IR、CH、TG、HDL、LDL相关性分析 (见表2)
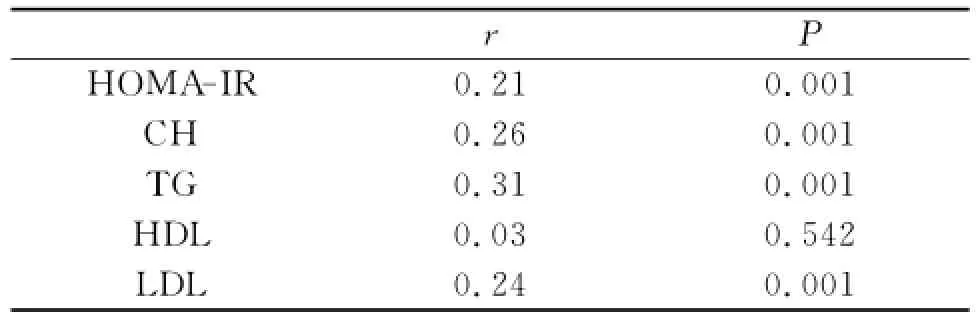
表2 UA与各生化指标的相关性分析
可以看出除HDL外(P>0.05),HOMA-IR、CH、TG、LDL与UA存在相关性(P<0.05)。
3 讨论
本研究发现,高尿酸患者易于发生高血糖、脂代谢紊乱、IR,提示HUA与肥胖、血脂异常、糖尿病等的发生具有潜在的相互致病机制。研究中发现具有HUA组BMI比尿酸正常者高,差异具有统计学意义,这表明高血尿酸与代谢综合征相关,反过来也一样,具有HUA的患者更常有代谢综合征。代谢综合征的发生率随着血尿酸的水平升高而显著升高[5]。有调查研究显示,HUA的患病率为19.1%,且血尿酸水平与与脂质代谢异常呈正相关(P<0.01)[6]。有研究通过调查7887例病人发现HUA患者TG和BMI均显著升高,HUA伴发肥胖的发病率高达55.3%(OR=2.568,95%CI:2.795-3.729),且HUA人群肥胖的发病率的危险性是正常尿酸人群的2.568倍[7]。其机制可能是由于脂质代谢异常及肥胖患者中门静脉游离脂肪酸增加,低密度脂蛋白产生过多,引发高甘油三酯血症,增加经NADP-NADPH普通代谢通路的核糖-5-磷酸到磷酸核糖焦磷酸的从头合成,尿酸的产生增加[8,9],同时导致尿酸排出减少有关[10]。此外肥胖患者往往伴随IR,导致高胰岛素血症,胰岛素一方面能够干扰脂质代谢,加重血脂紊乱,还能作用于泌尿小管降低尿中尿酸的排出导致HUA[11]。另外脂质代谢紊乱患者血清脂联素的降低致使肾脏对尿酸排出减少,亦是导致HUA的重要因素[12]。IR指胰岛素抑制释放葡萄糖的能力下降及胰岛素敏感细胞对胰岛素介导的葡萄糖摄取利用障碍,主要发生在脂肪细胞、肌肉细胞及肝细胞。IR引起血中高胰岛素及高血糖,这种病理生理状态是糖耐量异常、2型糖尿病、脂代谢紊乱、痛风、肥胖、原发性高血压等疾病的共同基础。目前尽管许多研究证明高血尿酸与IR具有相关性,但两者之间的因果效应并没有被明确阐述。一个大样本的流行病学研究[13]发现高血尿酸与快速血胰岛素水平呈正相关。在一项随访研究中[14]揭示:随着非糖尿病参与者的基础尿酸水平升高,其高胰岛素血症的发生风险将明显增高。通过一项15年的随访研究发现具有高尿酸血症的人发展成IR的风险比无HUA高1.36倍[15]。HUA导致IR的机制可能是由于高尿酸能够增加胰岛β细胞对各个时期胰岛素的分泌[16],而长期的高胰岛素血症一方面能够干扰机体糖代谢,导致GA3PDH(glyceraldehyde-3-phosphate dehydrogenase)活性减弱,糖酵解代谢的中间体向核糖-5-磷酸(R-5-P),磷酸核糖焦磷酸(PPRP)及尿酸合成方向进行转移[17]。另一方面通过胰岛素作用于肾小管降低尿酸的排出,反过来导致HUA[18]。以上表明,HUA与IR两者之间关系密切,HUA可能成为IR的独立预测因素,IR也可能促进HUA的发生及进展。糖代谢异常可以分为血糖调节受损及糖尿病,前者往往是后者的早期阶段。通过对1690例HUA患者及778例尿酸正常患者调查研究发现高血尿酸组空腹血糖调节受损(IFG)发病率为14.85%远远高于正常组的2.24%[19],说明HUA是IFG的高危险因素。
HUA不仅在发达国家发病率高,发展中国家随着经济的发展HUA发病率亦明显上升,有研究表明[20-22]证明,血尿酸升高、HUA或者痛风,与2型糖尿病的发展均密切有关,各疾病之间能够相互影响、相互促进,其核心机制在于机体的IR。因此,尽早干预HUA,调整个人生活饮食习惯,将为预防IR,控制及延缓HUA相关伴发疾病的发生及发展提供可能。
[1]中国医师协会心血管内科医师分会.无症状高尿酸血症合并心血管疾病诊治建议中国专家共识[J].中国医学前沿杂志,2010,2(3):49.
[2]陆再英,钟南山.内科学[M].第7版.北京:人民卫生出版社.2010:830-834.
[3]Sato T,Takeda H,Sasaki Y,et al.Increased homeostasis model assessment-insulin resistance is a risk factor for colorectal adenoma in Japanese males[J].Tohoku Exp Med,2011,223(4):297.
[4]杨文英,杨兆军,李光伟,等.联合测量腰臀围比值(或腰围)和血压可预测代谢综合征[J].中华内分泌代谢杂志,2005.21(3):227.
[5]Rodrigues SL,Baldo MP,Capingana P,et al.Gender distribution of serum uric acid and cardiovascular risk factors:population based study[J].Arquivos Brasileiros De Cardiologia,2012,98:13.
[6]邹贵勉,车文体,眭维国等.城市社区居民高尿酸血症与脂质代谢异常的关系[J].中华保健医学杂志,2009,11(4):259.
[7]邵继红,沈 霞,李东野等.高尿酸血症与代谢综合征组分关系的研究[J].中华流行病学杂志,2007,28(2):180.
[8]Matsubara K,MatsuzawaY,Jiao S,et al.Relationship between hypertriglyceridemia and uric acid produc-tion in primary gout[J].Metabolism,1989,38:698.
[9]Fabregat I,Revilla E,Machado A.Short-term control of the pentose phosphate cycle by insulin could be modulated by NADPH/NADP ratio in rat adipocytes and hepatocytes[J].Biochem Bio-phys Res Commun,1987,142:920.
[10]Cardona F,Tinahones JF,Collantes E,et al.Contribution of polymorphisms in the apolipoprotein AI-CIII-AIV cluster to hyperlipidaemia in patients with gout[J].Ann Rheum Dis,2005,64:85.
[11]Quinones Galvan A,Natali A,Baldi S,et al.Effect of insulin on uric acid excretion in humans[J].AmJPhysiol,1995,268:E1.
[12]Choi HK,Mount DB,Reginato AM.Pathogenesis of gout[J].Ann Intern Med,2005,143:499.
[13]Yoo TW,Sung KC,Shin HS,et al.Relationship between serum uric acid concentration and insulin resistance and metabolic syndrome[J].Circ J,2005,69:928.
[14]arnethon MR,Fortmann SP,Palaniappan L,et al.Risk factors for progression to incident hyperinsulinemia:the Atherosclerosis Risk in Communities Study,1987-1998[J].Am J Epidemiol,2003,158:1058.
[15]Krishnan E,Pandya BJ,Chung L,et al.Hyperuricemia in young adults and risk of insulin resistance,prediabetes,and diabetes:a 15-year follow-up study[J].Am J Epidemiol,2012,176:108.
[16]Robles-Cervantes JA,Ramos-Zavala MG,Gonzalez-Ortiz M,et al.Relationship between serum concentration of uric acid and in-sulin secretion among adults with type 2diabetes mellitus[J].Int J Endocrinol,2011,2011:107904.
[17]Bosello,O.,Zamboni,M.,2000.Visceral obesity and metabolic syndrome.Obes.Rev.,1(1):47.
[18]Quinones Galvan A,Natali A,Baldi S,et al.Effect of insulin on uric acid excretion in humans[J].Am J Physiol,1995,268:E1-E5.
[19]韦 华,王民登,李凤玲,等.高尿酸血症人群空腹血糖受损特点及其危险因素研究[J].当代医学,2010,16(30):8.
[20]Krishnan E,Pandya BJ,Chung L,et al.Hyperuricemia in young adults and risk of insulin resistance,prediabetes,and diabetes:a 15-year follow-up study[J].Am J Epidemiol,2012,176:108.
[21]Lai HM,Chen CJ,Su BY,et al.Gout and type 2diabetes have a mutual inter-dependent effect on genetic risk factors and higher incidences[J].Rheumatology(Oxford),2012,51:715.
[22]Chien KL,Chen MF,Hsu HC,et al.Plasma uric acid and the risk of type 2diabetes in a Chinese community[J].Clin Chem,2008,54:310.
对拙稿《简化OGTT不宜广泛推广》的一点重要补充
很感谢《中国实验诊断学》杂志在2013年第8期刊发了我于2011年4月投寄去的拙稿《简化OGTT不宜广泛推广》。经核,刊文漏排了作者重要发现及因此而得出的新观点,这涉及中国医生的辛勤劳动、创新以及有益于早期发现糖耐量减退病人。特望将这一段落刊出。
漏排段落是:“笔者早在1994年的糖尿病与糖耐量减退的全国性流行病学调查时,假定在服糖后30与60min这两点当作一点,定他们的血糖诊断值均为11.1mmol/L,发现一批被检者临床既无糖尿病症状,而FBG和2hBG也正常,但其1/2hBG和/或1hBG都≧11.1mmol/L,因此受到了我们重视。在《甘肃省城乡糖尿病和糖耐量低减的流行病学调查》文中进行了报道和讨论,认为这也是一种特殊的糖耐量减退。令人受到鼓舞的是,北京协和医院内分泌学者编著的《协和内分泌和代谢学》也和我们的见解不约而同,亦认为这也是一种耐糖耐量减退。”
凡临床医生无不知道WHO和ADA所定IGT的诊断标准为:OGTT的2hBG为>7.8mmol/L,而<11.1mmol/L者,但对于如笔者等中国医生的新发现和所提新增标准还鲜为人知,为其严重不足,应借助《中国实验诊断学》杂志等大平台扩大宣传和影响。对此,我们寄有莫大的希望。
宋丹丹(1986-),女,在读硕士,主要从事内分泌疾病研究。
2013-02-26)
1007-4287(2014)02-0302-03
*通讯作者

