金茵清热口服液稳定性考察
刘泽干,黄良永,朱海涛,杜士明
(1.湖北中医药大学药学院,武汉 430065;2.湖北医药学院附属太和医院药学部,十堰 442000)
金茵清热口服液稳定性考察
刘泽干1,黄良永2,朱海涛2,杜士明2
(1.湖北中医药大学药学院,武汉 430065;2.湖北医药学院附属太和医院药学部,十堰 442000)
目的 考察金茵清热口服液的稳定性。方法依据《药物制剂稳定性实验指导原则》,观察金茵清热口服液的性状、pH、相对密度,采用高效液相色谱(HPLC)法测定样品中栀子苷、绿原酸、丹酚酸B在实验条件下的含量变化,色谱条件:AtlantisT3色谱柱(150 mm×4.6 mm,3 μm),流动相A:0.05%磷酸溶液,流动相B:乙腈,梯度洗脱,流速: 0.8 mL·min-1,柱温:35℃,检测波长:254 nm。结果影响因素实验和加速实验中口服液的性状、pH和相对密度均未发生明显变化,而药效成分栀子苷、绿原酸、丹酚酸B的平均含量随存放时间的延长出现不同程度的降低。结论光照和高温对金茵清热口服液的稳定性有一定影响。
金茵清热口服液;稳定性;影响因素实验;加速实验
金茵清热口服液是湖北医药学院附属太和医院协同湖北中医药大学联合研制的中药复方制剂,处方由金银花、茵陈、大黄、栀子、连翘、黄芪、丹参、甘草8味中药组成。临床主要用于治疗感染、创伤、肠源性内毒性移位和功能性病变引起的内毒素血症[1]。为考察金茵清热口服液的稳定性,笔者依据《中华人民共和国药典》2010年版二部《药物制剂稳定性实验指导原则》,通过影响因素实验、加速实验,观察金茵清热口服液的性状、pH、相对密度、有效成分含量的变化评价制剂的稳定性[2-3],以期为工艺改进、质量控制、包装材料选择、运输储存条件的设定等后续研究提供参考。
1 仪器与试药
1.1 仪器 DIONEEX Ultimate3000高效液相色谱仪(美国戴安公司);变色龙色谱工作站(美国戴安公司);PHSJ-4A pH计(上海雷磁仪器公司);微电脑光照箱(型号:SPX-2501-G,上海博讯实业有限公司);隔水式恒温箱(型号:PYX-DHS,上海医疗器械七厂); UP5200H超声清洗机(熊猫集团电子计量有限公司); AUW120D电子分析天平(十万分之一,日本岛津公司);比重瓶(上海崇明建设玻璃仪器厂)。
1.2 试药 绿原酸对照品(批号:110753-200413,含量>99.9%)、栀子苷对照品(批号:10749-200714,含量>99.9%)、丹酚酸B对照品(批号:11562-201110,含量:98.0%)均购于中国食品药品检定研究院。金茵清热口服液(湖北医药学院附属太和医院自制,规格:每支10 mL,批号:20120220,20120425,20120820, 20120912)。试剂均为色谱纯;水为超纯水。
2 方法与结果
2.1 测定方法
2.1.1 性状、pH、相对密度测定 参照《中华人民共和国药典》2010年版一部附录Ⅶ,在自然光条件下白色背景中通过肉眼直接观察口服液性状;使用酸度计测量口服液pH;采用比重瓶法测定口服液的相对密度。
2.1.2 含量测定
2.1.2.1 色谱条件 AtlantisT3色谱柱(150 mm× 4.6 mm,3 μm),流动相A:0.05%磷酸溶液,流动相B:乙腈,按表1梯度洗脱,流速:0.8 mL·min-1,柱温: 35℃,检测波长:254 nm,理论板数以栀子苷峰计应不低于5 000。
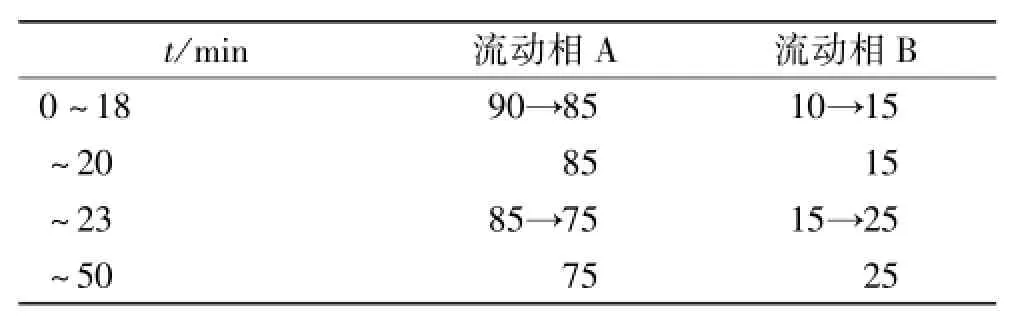
表1 洗脱梯度Tab.1 Gradient elution %
2.1.2.2 样品溶液的制备 对照品溶液的配制:取干燥至恒重的栀子苷对照品16.42 mg,绿原酸对照品12.80 mg,丹酚酸B对照品13.01 mg精密称定,分别置10 mL量瓶中,加甲醇溶解并稀释至刻度,得栀子苷贮备液1.642 mg·mL-1、绿原酸贮备液1.28 mg·mL-1、丹酚酸B贮备液1.301 mg·mL-1,再分别取3种对照品贮备溶液各1 mL,加甲醇稀释至5 mL,即得混合对照品溶液。
供试品溶液的配制:取金茵清热口服液5支,混合均匀,精密量取2 mL,置50 mL量瓶,加甲醇至刻度,摇匀,取适量用0.2 μm孔径滤膜过滤,取续滤液,即得供试品溶液。
2.1.2.3 标准曲线的绘制 分别精密量取混合对照品贮备液5.0,2.0,1.5,1.0,0.5,0.2,0.1 mL置于5 mL量瓶,加甲醇稀释成含栀子苷328.4,131.36,98.52, 65.68,32.84,13.136,9.852 μg·mL-1;含绿原酸256, 102.4,76.8,51.2,25.6,10.24,7.68 μg·mL-1;含丹酚酸B 260.2,104.08,52.04,26.03,10.408, 7.806 μg·mL-1的系列对照品溶液,经孔径0.2 μm滤膜过滤,精密取20 μL,注入色谱仪检测,以对照品质量(μg)为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线,经线性回归,得标准曲线方程为:Y栀子苷= 27.519 9X栀子苷-0.054 8,r=0.999 9,线性范围0.197 1~6.568 μg;Y绿原酸=18.089 5X绿原酸-1.142 6,r=0.999 8,线性范围0.153 6~5.120 0 μg;Y丹酚酸B= 12.613 4X丹酚酸B-1.752 1,r=0.999 7,线性范围0.156 1~5.204 0 μg。
2.1.2.4 系统适应性实验 取“2.1.2.3”项栀子苷对照品溶液(98.52 μg·mL-1)、绿原酸对照品溶液(76.8 μg·mL-1)、丹酚酸B对照品溶液(52.04 μg·mL-1)混合对照品溶液20 μL,在“2.1.2.1”项色谱条件下,连续进样5次,记录3种成分的峰面积,并计算5个峰面积值的RSD。结果栀子苷峰面积的RSD为0.19%,绿原酸峰面积的RSD为0.23%,丹酚酸B峰面积的RSD为0.64%。表明色谱系统的重复性能够满足当前分析的要求。
2.1.2.5 重复性实验 取同一批号的样品(批号: 20120425),按照“2.1.2.2”项方法,制备6份供试品溶液,按“2.1.2.1”色谱条件进行含量测定,以外标法计算3种成分的含量。结果栀子苷平均含量为4.23 mg·mL-1,RSD为0.80%;绿原酸平均含量为3.47 mg·mL-1,RSD为0.97%;丹酚酸B平均含量为2.09 mg·mL-1,RSD为1.02%。表明该测定方法重复性较好。
2.1.2.6 加样回收实验 精密量取6份已知含量的样品(批号:20120425)各2 mL,分别精密加入“2.1.2.2”项下3种成分对照品贮备液各2 mL;按“2.1.2.1”色谱条件测定样品中栀子苷、绿原酸、丹酚酸B含量,计算加样回收率。结果栀子苷平均回收率98.43%,RSD为0.10%;绿原酸的平均回收率为97.72%,RSD为1.12%;丹酚酸的平均回收率为97.08%,RSD为1.38%。
2.1.2.7 稳定性实验 取同一供试品溶液,分别于配制后0,2,4,8,10,24 h进样分析,测定峰面积。结果栀子苷、绿原酸、丹酚酸B峰面积的RSD分别为1.13%, 0.89%,1.34%,表明供试品溶液在24 h内稳定。
2.1.2.8 含量测定 取各实验条件下的供试品适量,按“2.1.2.2”项,制成供试品溶液,在“2.1.2.1”项色谱条件下,取对照品混合溶液和样品溶液各20 μL,进样,测定3种成分的峰面积,以外标法计算栀子苷、绿原酸、丹酚酸B的含量。
2.2 影响因素实验
2.2.1 影响因素实验方法
2.2.1.1 高温实验 取供试品(批号:20120220)20支,除去包装纸,(60±2)℃恒温箱放置10 d,分别于第0,第5,第10天各取5支,按稳定性重点考察项目(性状、相对密度、pH、含量)进行检测。
2.2.1.2 强光实验 取供试品(批号:20120220)20支,除去包装纸,放置于光照箱内,于照度为4 500 Lx(勒克斯Luminous flux)的条件下放置10 d,分别于第0,第5,第10天各取5支,按稳定性重点考察项目(性状、相对密度、pH、含量)进行检测。
2.2.2 影响因素实验结果 在强光和高温的影响下,金茵清热口服液性状、pH、相对密度未发生明显变化,而有效成分(绿原酸、栀子苷、丹酚酸B)的含量随存放时间的延长而明显降低,且出现新的色谱峰。见图1和表2。
2.3 加速实验
2.3.1 加速实验方法 供试品3批(批号:20120425, 20120820,20120912)不拆除包装,放入温度(40± 2)℃、相对湿度75%的恒温箱中,分别于0,1,2,3,6个月取样,按稳定性考察项目(性状、相对密度、pH、含量)进行检测。
2.3.2 加速实验结果 在(40±2)℃、相对湿度75%条件下放置6个月,3批口服液的性状、pH、相对密度均未发生明显变化,而有效成分(绿原酸、栀子苷、丹酚酸B)的含量随存放时间的延长而明显降低,且3批口服液显示相同趋势的变化。见表3。
3 讨论
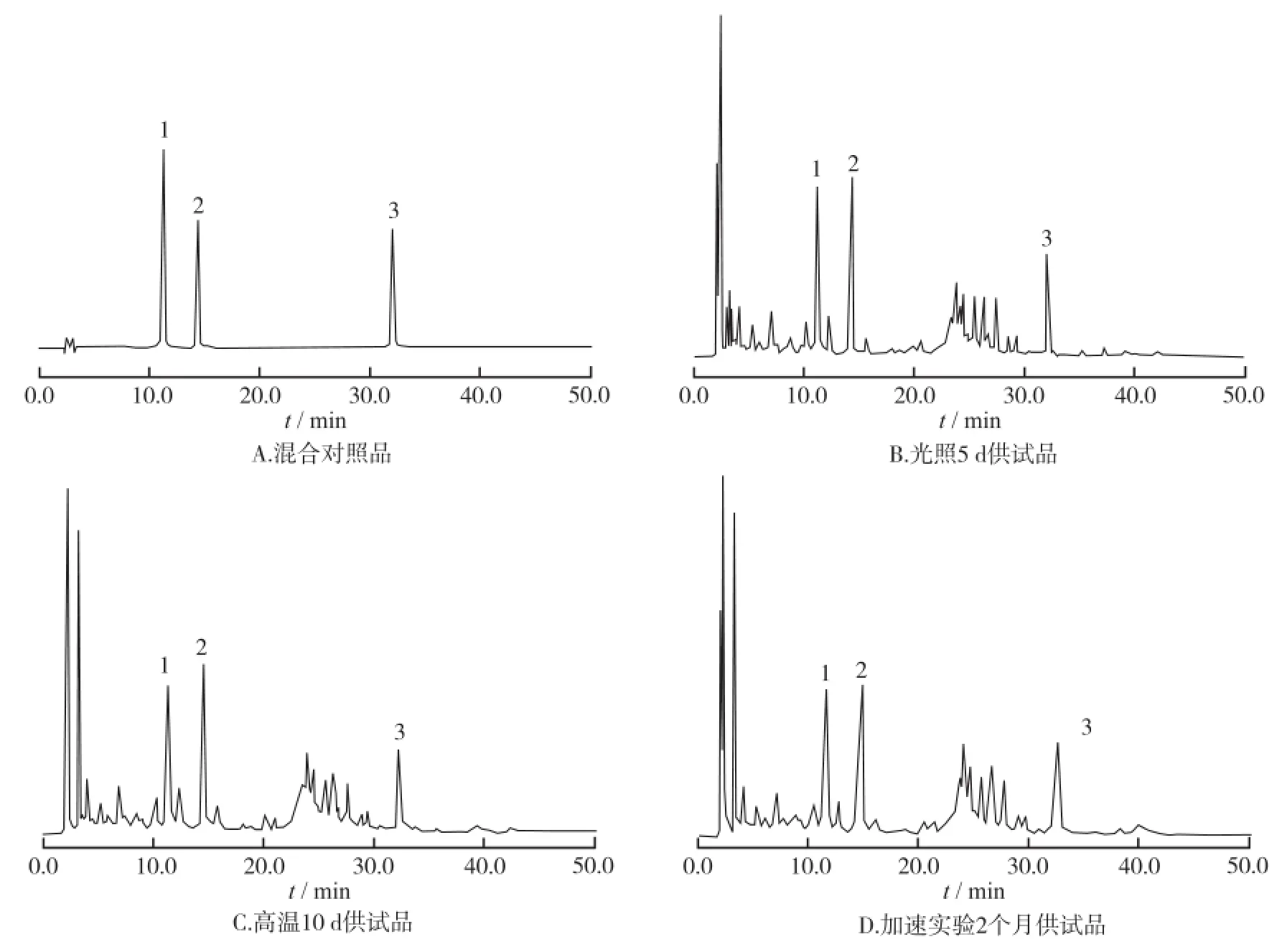
1.绿原酸;2.栀子苷;3.丹酚酸B图1 对照品和3种方法处理供试品的HPLC色谱图1.chlorogenic acid;2.geniposide;3.salvia acid BFig.1 HPLC Chromatogram map of reference and three kinds of samples

表2 影响因素实验结果Tab.2 Results of influence factor experiment

表3 加速实验结果Tab.3 Results of accelerating experiment
金茵清热口服液采用经典的水提醇沉工艺制备,可保留较全的有效成分,口服液性状棕色澄清,并通过栀子苷、绿原酸、丹酚酸B的含量以控制口服液的质量[3]。口服液制剂进行影响因素实验和加速实验的目的是考察制剂处方与生产工艺及包装条件的合理性。参照《中华人民共和国药典》2010年版二部《药物制剂稳定性实验指导原则》,影响因素实验中应考察强光、高温和高湿对制剂稳定性的影响,因本制剂为口服液,含水量较大,因此无需考察高湿的影响。
通过影响因素实验和加速实验发现口服液性状未发生变化,pH保持在4.10~4.20,相对密度在1.06~1.08,说明高温、强光对本口服液的性状、pH、相对密度影响不明显;但在影响因素实验和加速实验中绿原酸、栀子苷、丹酚酸B的含量都有不同程度下降,上述3种成分在强光和高温条件下容易分解,其中高温对绿原酸和丹酚酸B的影响较大[4-5]。在一定实验温度下,3种有效成分含量随着存放时间延长降低。另外,在相同的实验时间点上温度越高有效含量下降速度越快,在加速实验条件下第1个月,口服液中绿原酸、栀子苷、丹酚酸B含量下降接近30%,说明高温和强光是影响本品稳定性的主要因素,因此在提取、浓缩灭菌等生产环节需注意对温度和时间的控制,以及运输、存放时需注意强光和高温对本品的稳定性影响。结合实验结果,本课题组拟采用深棕色的玻璃瓶装放口服液,存放阴凉处;通过进一步在常温下进行长期稳定性实验验证该制剂的稳定性,并作另文报道。
研究中发现强光和高温影响绿原酸和丹酚酸B的稳定性,另文献报道,绿原酸易降解为奎宁酸和咖啡酸[6],丹酚酸B易降解为丹参素和咖啡酸[7];金茵清热口服液中除绿原酸、栀子苷、丹酚酸B外,还有其他成分对本制剂的疗效起着关键作用,这些成分在强光和高温的条件下也可能降解,这些降解成分对本制剂的疗效及毒理影响还需进一步研究。
[1] 常明向,吴梅梅,刘浩.利胆排毒口服液对大鼠胆汁及尿液中内毒素含量的影响[J].环球中医药,2010,3(5):349 -351.
[2] 国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2010,附录199-附录201.
[3] 黄良永,郑江萍,雷震.HPLC法同时测定利胆排毒口服液中绿原酸、栀子苷和丹酚酸B的含量[J].中国药师, 2012,15(11):13-15.
[4] 江滨,王风云,曾元儿,等.绵茵陈药材提取液中绿原酸稳定性影响因素考察[J].中成药,2007,29(3):359-362.
[5] 刘东文,蔡丽云,李子鸿,等.新伤去瘀口服冻干颗粒中丹酚酸B稳定性研究[J].中药材,2009,32(4):613-615.
[6] 康雨彤,贺金华,毛艳,等.芩榆烧伤凝胶制备工艺优选[J].医药导报,2013,32(8):1085-1088.
[7] 顾利红,朱品业.日光和温度对绿原酸供试液稳定性的影响[J].中成药,1999,21(11):58-59.
DOI 10.3870/yydb.2014.11.028
Stability of Jinyin Qingre Oral Liquid
LIU Ze-gan1,HUANG Liang-yong2,ZHU Hai-tao2,DU Shi-ming2
(1.College of Pharmacy,Hubei University of Chinese Medicine,Wuhan 430065,China;2.Department of Pharmacy,Taihe Hospital Affiliated with Hubei University of Medicine,Shiyan 442000,China)
ObjectiveTo investigate the stability ofjinyin qingreoral liquid.MethodsAccording to the stability test guidelines for pharmaceutical preparations,the appearance,pH and relative density ofjinyin qingreoral liquid were detected, the contents of geniposide,chlorogenic acid and salvia acid B were determined by HPLC.The chromatographic conditions were as follows:AtlantisT3 column(150 mm×4.6 mm,3 μm),mobile phase A:0.05%phosphoric acid,mobile phase B:acetonitrle, gradient elution at the flow rate of 0.8 mL·min-1,and column temperature at 35℃.The detection wavelength was set at 254 nm.ResultsThe appearance,pH,and relative density ofjinyin qingreoral liquid did not change significantly with the acceleration test,but the contents of geniposide,chlorogenic acid and salvia acid B decreased time dependently.ConclusionLight and high temperature could decrease the stability of thejinyin qingreoral liquid.
Jinyin qingreoral liquid;Stability;Stress test;Accelerated test
R286;R927.1
B
1004-0781(2014)11-1502-04
2013-09-05
2013-10-12
刘泽干(1987-),男,湖北鄂州人,在读硕士,研究方向:药物制剂新剂型开发及质量控制。
杜士明(1964-),男,湖北十堰人,主任药师,硕士生导师,博士,研究方向:医院药学。电话:0719-8801393,E-mail:dsmch@sina.com。

