3种头孢呋辛酯干混悬剂体外溶出行为比较*
林的仕,余楚钦,林华庆,陈洁,邓艳斌,林苏娜,吴丽花
(广东药学院广东省药物新剂型重点实验室,广州 510006)
3种头孢呋辛酯干混悬剂体外溶出行为比较*
林的仕,余楚钦,林华庆,陈洁,邓艳斌,林苏娜,吴丽花
(广东药学院广东省药物新剂型重点实验室,广州 510006)
目的 考察3种头孢呋辛酯干混悬剂(原研、国产、自制)在4种不同溶出介质中的溶出行为,并对其进行相似性评价。方法分别以水、pH 1.2氯化钾/盐酸溶液、pH 4.5醋酸盐缓冲溶液、pH 7.0磷酸盐缓冲溶液为溶出介质,采用桨法,50 r·min-1进行溶出度实验。采用紫外分光光度法分别测定不同时间点的溶出量,绘制溶出曲线。以原研头孢呋辛酯干混悬剂(GlaxoSmithKline)为参比制剂,采用美国食品和药品管理局(FDA)推荐的相似因子比较法对溶出曲线进行相似性比较。结果自制头孢呋辛酯干混悬剂在介质为水、pH 1.2氯化钾-盐酸溶液、pH 4.5醋酸盐缓冲溶液、pH 7.0磷酸缓冲溶液中的相似因子分别为74,92,77,75,国产头孢呋辛酯干混悬剂在以上4种介质中的相似因子分别为40,32,49,50。结论自制头孢呋辛酯干混悬剂在4种溶出介质中溶出曲线与参比制剂相似,而国产市售头孢呋辛酯干混悬剂仅在pH 4.5醋酸盐缓冲溶液和pH 7.0磷酸盐缓冲溶液中与参比制剂的溶出曲线相似。
头孢呋辛酯干混悬剂;体外溶出行为;相似性
头孢呋辛酯(cefuroxime axetil)为第二代头孢菌素头孢呋辛的前体药物。头孢呋辛酯本身并不具有抗菌活性,口服吸收后迅速被体液和血液中的非特异性酶水解生成头孢呋辛而发挥抗菌作用[1]。临床主要用于呼吸道感染、尿道感染、肾盂肾炎、脑膜炎、败血症、淋球菌感染等疾病[2]。为满足临床上婴儿、儿童、老年人等不能吞服患者的用药需要,药剂科研人员已运用现代制剂技术成功将其制成掩味的干混悬剂,并成功上市。自制头孢呋辛酯的处方工艺较市售产品有改进,头孢呋辛酯干混悬剂的标准收载于国家药品标准WS1-(X-391)-2004Z中[3],但该标准并未涉及溶出度检查。本品属低溶解性-高渗透性药物,溶出是其体内吸收的限速步骤,其与生物利用度密切相关。为评价国产市售头孢呋辛酯干混悬剂(某医药公司)及自制头孢呋辛酯干混悬剂的内在品质,按照仿制药一致性评价要求,参考有关文献及资料[4-6],分别绘制原研(GlaxoSmithKline)、国产、自制3种头孢呋辛酯干混悬剂在4种不同溶出介质中的溶出曲线,并评价其相似性。
1 仪器与试药
1.1 仪器 ZRS-8G智能溶出仪(天津市天大天发科技有限公司),ZKT-18F真空脱气仪(天津市天大天发科技有限公司),UV-1700紫外分光光度计(日本岛津公司),KQ-300DA型医用超声波清洗机(昆山超声仪器有限公司),CP225D型、BS224S型电子分析天平[赛多利斯科学仪器(北京)有限公司]。
1.2 试药 头孢呋辛酯对照品(中国食品药品检定研究院,纯度80.8%,批号:130492-200402),头孢呋辛酯原料药(广东立国制药有限公司,含量:84.1%,批号:FZ41204071),国产头孢呋辛酯干混悬剂[某医药有限公司,规格:0.125 g(C16H16N4O8S),批号: 12060142],原研头孢呋辛酯干混悬剂[商品名: CEFTIN®,英国GlaxoSmithKline公司,规格:0.250 g (C16H16N4O8S),批号:C600383],自制头孢呋辛酯干混悬剂[规格0.125 g(C16H16N4O8S),批号: 2013040101]。其他试剂均为分析纯。
2 方法与结果
2.1 溶出介质的配制 ①水:为双蒸水。②pH 1.2氯化钾/盐酸溶液:取0.2 mol·L-1的氯化钾溶液250 mL和0.2 mol·L-1盐酸溶液425 mL,加水稀释至1 000 mL,即得。③pH 4.5醋酸盐缓冲溶液:称取三水合醋酸钠2.99 g,加水适量溶解,加2 mol·L-1冰醋酸溶液14.0 mL,并定容至1 000 mL,即得。④pH 7.0磷酸盐缓冲溶液:称取无水磷酸氢二钠5.7 g和磷酸二氢钠3.7 g,加水溶解并稀释至1 000 mL,即得。
2.2 对照品溶液的配制 精密称取头孢呋辛酯对照品15 mg,置10 mL量瓶中,加甲醇使溶解并稀释至刻度,摇匀。精密量取1 mL置于100 mL量瓶中,分别加对应溶出介质稀释至刻度,摇匀,即得。
2.3 专属性实验
2.3.1 检测波长的选择 取“2.2”项下的对照品溶液,按紫外分光光度法,分别以溶出介质为空白对照,在200~400 nm波长范围内扫描,绘制对照品溶液紫外扫描图谱。称取头孢呋辛酯干混悬剂适量,置于100 mL量瓶中,加溶出介质适量超声10 min并稀释至刻度,摇匀,过滤,取续滤液按紫外分光光度法,分别以溶出介质为空白对照,在200~400 nm的波长范围内扫描,绘制样品溶液的紫外扫描图谱。结果表明,4种不同介质中,对照品与样品均在280 nm波长处有最大吸收峰出现,故选择280 nm作为主成分的测定波长。
2.3.2 辅料干扰实验 按处方量比例,称取混合辅料适量,以溶出介质为溶剂,制成相当于测定浓度的溶液,过滤,取续滤液,按紫外分光光度法,以溶出介质为空白对照,在200~400 nm的波长范围内扫描。结果表明,混合辅料在280 nm波长处吸收度干扰不超过2%,可忽略不计。
2.4 线性关系考察 精密称取头孢呋辛酯对照品22 mg,置于10 mL量瓶中,加甲醇使溶解并稀释至刻度,摇匀。精密量取1 mL,置4个10 mL量瓶中,分别用“2.1”项下4种溶出介质稀释至刻度,摇匀,作为储备液。分别精密量取储备液0.2,0.4,0.5,0.6,0.8, 1.0 mL置于10 mL量瓶中,加溶出介质稀释至刻度,摇匀。按紫外分光光度法,以溶出介质为空白,于280 nm处测定吸光度。以吸光度(A)对浓度(C)进行线性回归。结果表明,头孢呋辛酯在3.61~18.05 μg·mL-1范围内,在280 nm处吸光度与浓度呈良好线性关系。见表1。
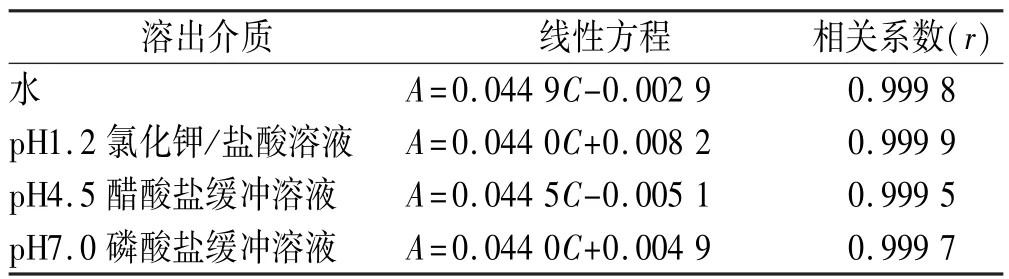
表1 头孢呋辛酯在4种不同pH介质下的线性方程与相关系数
2.5 滤膜吸附实验 工作中常用的滤膜分为水系和有机系两种,因选取的4种介质均不含有机溶剂,根据《中华人民共和国药典》2010年版二部相关要求并结合样品实际情况,确定选取水系膜,孔径为0.8 μm (φ=25 mm)进行滤膜吸附验证实验。取“2.2”项下的对照品溶液适量,将其分为两份,一份不过滤,另一份用滤膜过滤,在280 nm处测定两者的吸光度。结果表明,滤膜吸附量均<2%,可忽略不计[7]。
2.6 精密度实验 分别精密量取“2.4”项下的储备液0.4,1.2,2.0 mL,置于20 mL量瓶中,加溶出介质稀释至刻度,摇匀。以溶出介质为空白,于280 nm波长处测定吸光度,各连续测定6次。见表2。
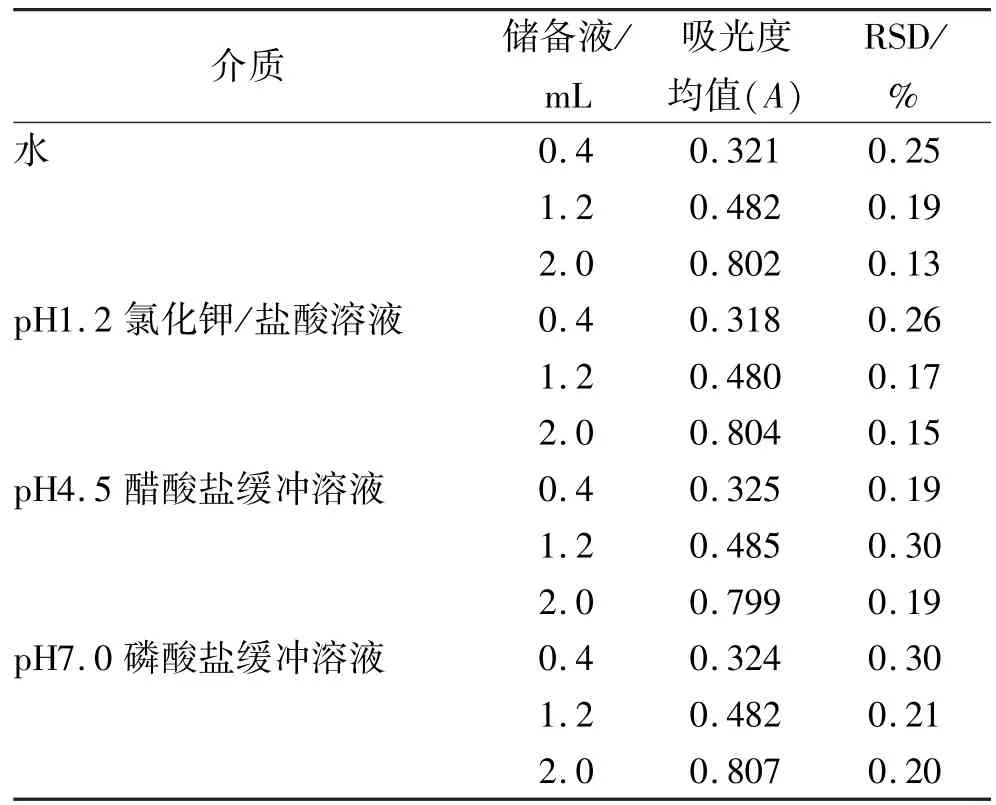
表2 4种介质精密度实验结果
2.7 重复性实验 取头孢呋辛酯干混悬剂(批号: 2013040101)加水适量配制成规格为25 mg·mL-1(以头孢呋辛计)的混悬液,取以上混悬液5 mL,每次6份,共测定3次。依溶出度测定法(浆法),实验温度: 37℃,分别以水、pH 1.2氯化钾/盐酸溶液、pH 4.5醋酸盐缓冲溶液、pH 7.0磷酸盐缓冲溶液900 mL为溶剂,转速为50 r·min-1,依法操作,经5,15,90 min时(其中水、pH4.5的介质取样点为5,30,360 min),取溶液5 mL滤过,弃去初滤液,精密量取续滤液适量,加对应溶出介质稀释制成每毫升中含11 μg的溶液,作为供试品溶液。取上述溶液及“2.2”项下的对照品溶液,照紫外-可见分光光度法,分别在280 nm波长处测定吸光度,计算不同时间的溶出量。见表3。
2.8 溶液稳定性实验 取头孢呋辛酯干混悬剂置研钵充分研磨,分别称取4份置于100 mL量瓶中,分别加溶出介质适量,超声15 min使溶解并稀释至刻度,摇匀,过滤,各取滤液适量,于室温放置,并于0,0.5, 1,2,3,4,5和6 h测定吸光度。结果表明,测定溶液在室温下,6 h内的RSD均<2%,溶液基本稳定。
2.9 加样回收率实验 精密称取已知含量(31.25 mg·g-1,以头孢呋辛计)的头孢呋辛酯干混悬剂样品9份,每份0.1 g,置100 mL量瓶中,分别精密加入头孢呋辛酯对照品适量(以头孢呋辛计),先加甲醇适量超声溶解,再加溶出介质稀释至刻度,摇匀,滤过,精密量取2 mL置于100 mL量瓶中,分别加对应溶出介质稀释至刻度,摇匀,照紫外分光光度法,在280 nm处测定吸光度。另取“2.2”项下对照品溶液,同法测定,计算回收率。见表4。
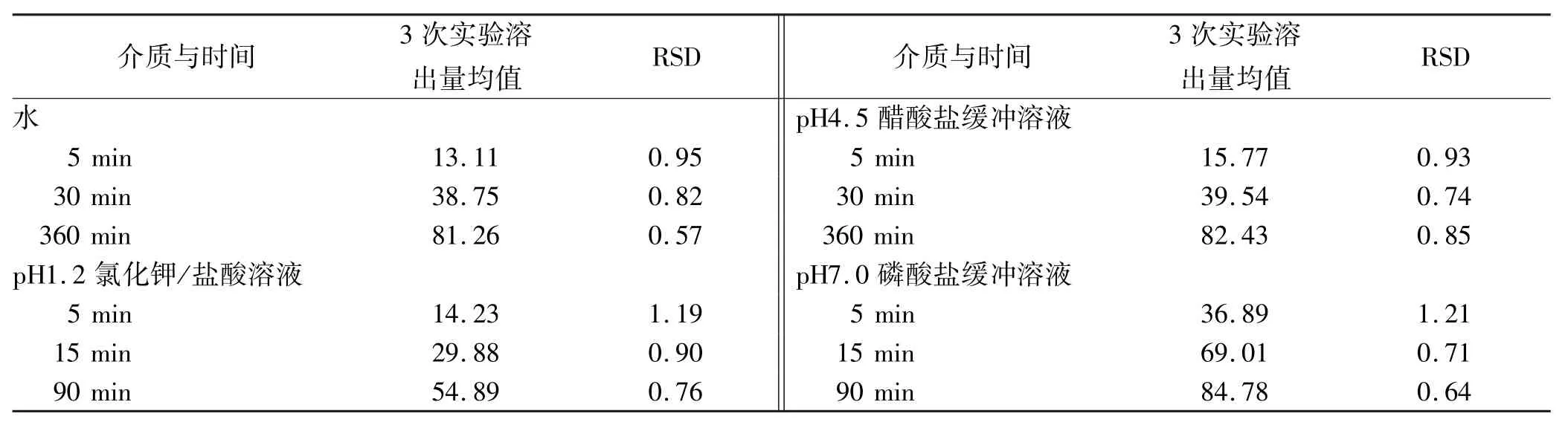
表3 4种介质重复性实验结果 %
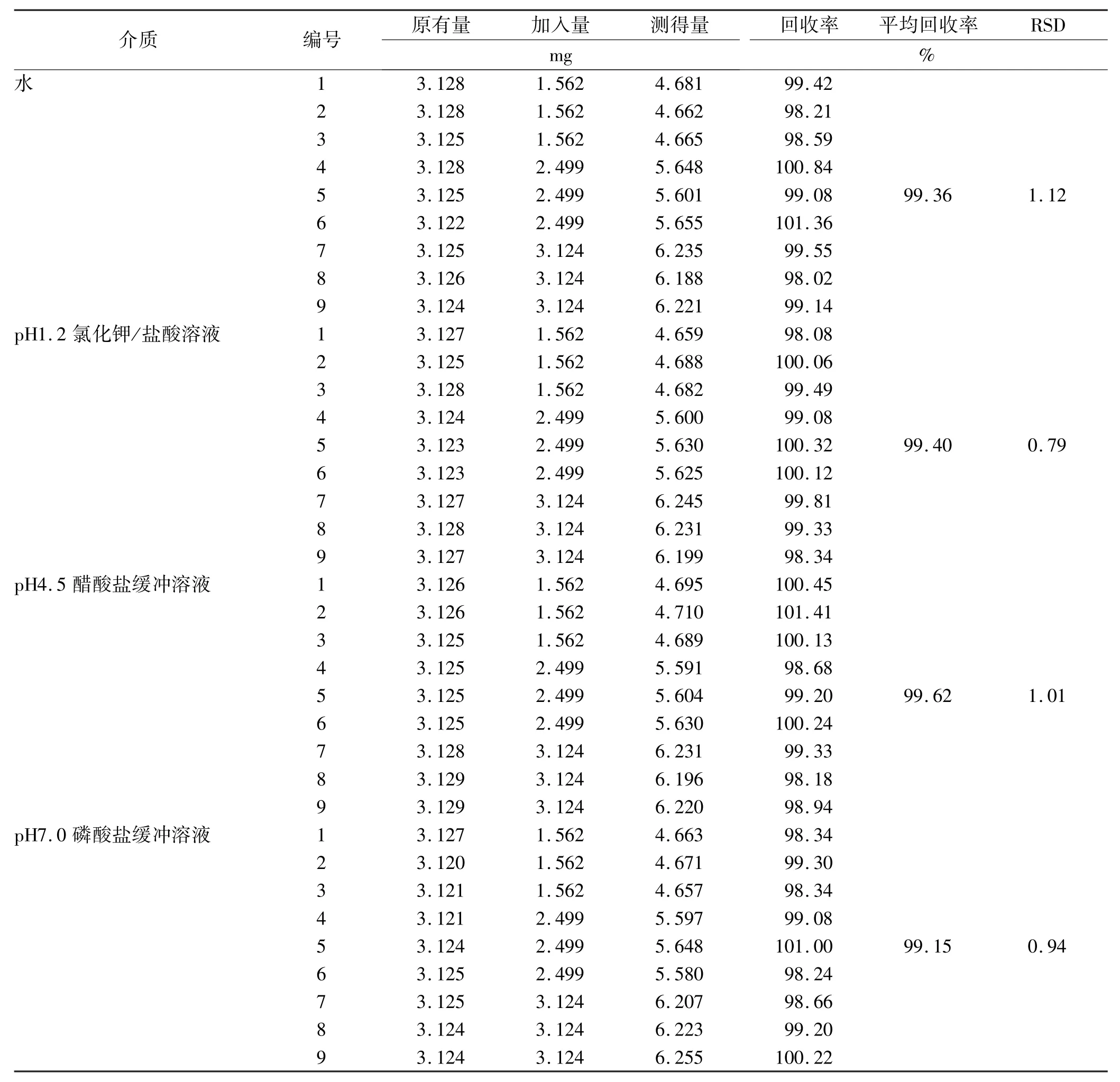
表4 头孢呋辛酯在4种介质下的加样回收率实验结果
2.10 溶出曲线绘制 按如下方法[4]分别测定原研、国产、自制3种头孢呋辛酯干混悬剂在不同pH的溶出介质中的溶出曲线,各测定3次:取头孢呋辛酯干混悬剂加水适量配制成规格为25 mg·mL-1(以头孢呋辛计)的混悬液。取上述混悬液照溶出度测定法(浆法),实验温度:37℃,分别以水、pH 1.2氯化钾/盐酸溶液、pH 4.5醋酸盐缓冲溶液、pH 7.0磷酸盐缓冲溶液900 mL为溶剂,转速为50 r·min-1,依法操作,经5,10,15,30,45,60,90,120,180,240,300,360 min时 (pH1.2、pH7.0的介质则取样至120 min时结束实验),取溶液5 mL滤过(同时补充同温介质5 mL),弃去初滤液,精密量取续滤液适量,加溶出介质稀释制成每毫升中含11 μg的溶液,作为供试品溶液。取上述溶液及“2.2”项下的对照品溶液,照紫外-可见分光光度法,分别在280 nm波长处测定吸光度,计算不同时间的累积溶出百分率。以时间对溶出百分率作图,绘制溶出曲线。见图1。
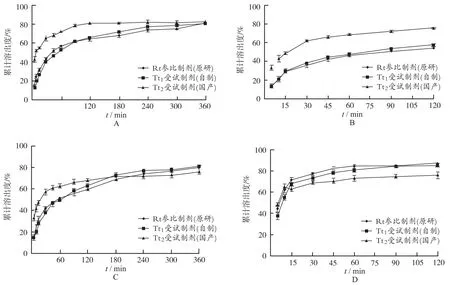
A.水;B.pH 1.2氯化钾/盐酸溶液;C.pH 4.5醋酸盐缓冲溶液;D.pH 7.0磷酸盐缓冲溶液图1 头孢呋辛酯干混悬剂在4种介质中的溶出曲线(n=3)
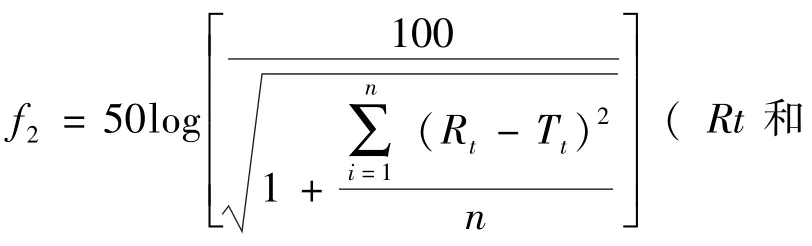
结果可见与参比制剂相比自制头孢呋辛酯干混悬剂在4种不同pH介质条件下相似因子f2均>46,说明体外溶出行为相似。而国产头孢呋辛酯干混悬剂在pH4.5醋酸盐缓冲溶液条件下相似因子f2>46,在 pH7.0的磷酸盐缓冲溶液条件下相似因子f2>42,说明在这两种溶出介质中溶出行为相似。在水、pH1.2氯化钾/盐酸溶液中溶出行为不相似。见表5。

表5 4种溶出介质条件下溶出曲线相似因子f2
3 讨论
头孢呋辛酯干混悬剂的国家药品标准WS1-(X-391)-2004Z中并未有溶出度质量标准,根据《普通口服固体制剂溶出度实验技术指导原则》,采用《美国药典》中该品种的溶出测定方法进行不同溶出介质条件下溶出曲线的比较[8]。结果显示溶出较为缓慢,但在规定时间内已有一定落差,不影响溶出曲线的相似性评价,且由于该品种主要是婴儿、儿童、老年人以及其他不能吞服的患者服用,一般认为桨法50 r·min-1与这类患者消化道的蠕动强度相当,故不再放宽实验条件。
文献[9]指出参比制剂溶出率在规定时间内达85%以上,以参比制剂平均溶出率达85%的时间点为Ta,比较1/4Ta、1/2Ta、3/4Ta和Ta 4个时间点的两者平均溶出率f2因子>42;达50%~85%或85%以上的,以参比制剂在结束时间点平均溶出率的85%的时间点作为Ta,比较1/4Ta、1/2Ta、3/4Ta和Ta 4个时间点,f2因子>46,则可判定为相似。本研究中各计算时间点数据偏离度均符合要求。
国内已有溶出度标准的干混悬剂溶出实验时,多采用直接投入干混悬剂的方法。笔者也尝试该投样方法进行实验,发现除在pH 7.0磷酸盐缓冲溶液中头孢呋辛酯干混悬剂在转浆搅动下能分散在介质中外,其他3种溶出介质均是漂浮在液面,影响溶出。故最终采取第35版《美国药典》中该品种的投样方法。相比之下,采取投入混悬液的方法更能真实模拟服药过程,有助于建立体内外相关性。
国产上市头孢呋辛酯干混悬剂批内均一性和批间重复性均良好,与参比制剂的溶出曲线却存在差异,说明其内在品质与参比制剂仍存在差异。参比制剂与自制制剂两者在4种溶出介质条件下溶出曲线均相似,初步认定自制制剂处方、工艺合理,具有与与参比制剂相当的内在品质,但它仅在一定程度上预测生物等效性的研究情况及指导生物等效性实验受试者的选择,其生物等效性和临床疗效有待生物等效性实验和临床实验验证。
[1]HARDING S M,WILLIAMS P E O,AYRTON J.Pharmacology of cefuroxime as the 1-acetoxyethylester in volunteers[J].Antimicrob Agents Chemother,1984,25 (1):78-82.
[2] GOOCH W M,SWENSON E,HIGBEE M D,et al.Cefuroxime axetil and penicillin V compared in the treatment of group A beta-hemolytic streptococcal pharyngitis[J].Clin Ther,1987,9(6):670-677.
[3] 国家药典委员会.国家药品标准新药转正标准第60册[S].北京:人民卫生出版社,2005:44-45.
[4] U.S.Pharmacopeia 35/National Formulary 30[S].The United States Pharmacopeial Convention,2011:2579.
[5] 潘强,潘智鹏,徐秋阳,等.头孢呋辛酯干混悬剂溶出度测定方法的建立[J].中国药事,2012,26(1):66-67.
[6] PMDA.後発医薬品の生物学的同等性試験ガイドラインについて[EB/OL].http://www.pmda.go.jp,2013-01-10.
[7] 康建磊,徐冰珠.速释口服固体制剂溶出度研究验证中需注意的问题[J].解放军药学学报,2010,26(4):369-373.
[8] 谢沐风.溶出曲线的测定与比较[R].上海:上海市药品检验所,2008.
[9] 谢沐风.溶出曲线相似性的评价方法[J].中国医药工业杂志,2009,40(4):308-310.
DOI 10.3870/yydb.2014.04.028
R978.11;TQ460.6
A
1004-0781(2014)04-0503-05
2013-06-05
2013-09-28
*药物制剂关键技术研发及产业化示范项目(2008A1-E4101)
林的仕(1988-),男,广东揭阳人,硕士,主要从事缓控释制剂的研究。电话:(0)13450207406,E-mail:lindishi1988@163.com。
林华庆(1964-),男,广东湛江人,教授,硕士生导师,学士,主要从事缓控释制剂和中药新剂型的研究。电话: 020-39352502,E-mail:huaqing_@vip.tom.com。

