HPLC-UV-ELSD测定复方丹参滴丸中6种成分含量
张振军
(承德医学院附属医院药学部,承德 067000)
HPLC-UV-ELSD测定复方丹参滴丸中6种成分含量
张振军
(承德医学院附属医院药学部,承德 067000)
目的 同时测定复方丹参滴丸中丹参素、原儿茶醛、丹参酮ⅡA、三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1的含量,为完善复方丹参滴丸质量标准提供依据。方法采用HPLC-UV-ELSD法,Waters symmetry C18(250 mm× 4.6 mm,5 μm)色谱柱,流动相为乙腈(A)∶0.1%磷酸水溶液(B),梯度洗脱(0 min→10 min→15 min→30 min→50 min→60 min,A为10%→10%→20%→25%→60%→85%),流速1 mL·min-1,柱温30℃,紫外检测器参数:检测波长280 nm,蒸发光检测器参数:雾化管温度36℃,漂移管温度70℃,载气压强170 kPa。结果丹参素、原儿茶醛、丹参酮ⅡA、三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1依次在24.4~488.0 ng(r=0.999 5)、4.2~84.0 ng(r=0.999 4)、1.0~20.0 ng(r=0.999 3)、30.6~612.0 ng(r=0.999 4)、26.8~536.0 ng(r=0.999 5)、41.2~824.0 ng(r=0.999 5)范围内呈良好的线性关系;平均回收率依次为98.58%(RSD=2.18%)、100.54%(RSD=1.98%)、100.55%(RSD=2.36%)、99.55%(RSD=1.59%)、99.43%(RSD=2.16%)、99.23%(RSD=2.49%)。结论该方法快速、准确,无内源物质干扰,可为完善复方丹参滴丸的质量标准提供参考。
丹参滴丸,复方;检测器,紫外;检测器,蒸发光;色谱法,高效液相
复方丹参滴丸由丹参、三七、冰片组成,应用现代制剂技术制成的新剂型,具有剂量小、服用方便、溶出速度快、起效迅速、可直接经黏膜吸收、生物利用度高、疗效高及无胃肠刺激、无明显的毒副作用等特点[1-2]。其主要有效成分为丹参素、原儿茶醛、丹参酮ⅡA、三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1等,上述有效成分的测定方法目前主要采用高效液相色谱法(紫外检测器)进行测定[3-5]。由于三七中的皂苷类成分在采用紫外检测器(UV)测定时受到干扰较多,不利于进行准确的定性、定量分析。通过紫外检测器和蒸发光散射检测器(ELSD)联用,既能对复方丹参滴丸丹参中的主要成分进行紫外检测,也能对三七的主要成分进行蒸发光检测,有利于对复方丹参滴丸进行准确的定性定量分析。同时,结合中药有效组分理论对复方丹参滴丸中与临床疗效相关的6种中药有效组分进行测定分析,为完善复方丹参滴丸质量评价标准提供依据。
1 试药与仪器
1.1 试药 丹参素钠(批号:110855-200806)、原儿茶醛(批号:110810-200502)、丹参酮ⅡA(批号:110736-200620)、三七皂苷R1(批号:110745-200609)、人参皂苷Rg1(批号:110703-201008)、人参皂苷Rg1(批号: 110703-200316)、人参皂苷Rb1(批号:110704-200314),供HPLC含量测定用,均由中国食品药品检定研究院提供。甲醇为色谱纯,水为超纯水,其他试剂均为分析纯。复方丹参滴丸由天津天士力制药股份有限公司生产,批号:101001,101004,101006。
1.2 仪器 Waters 2695高效液相色谱仪,2998 PDA检测器及2424蒸发光散射检测器,四元梯度泵,Empowers 3色谱工作站;KQ-100型超声清洗器(昆明市超声仪器有限公司);Sartorius BP211D分析天平(德国赛多利斯)。
2 方法与结果
2.1 色谱条件 采用Waters symmetry C18(250 mm× 4.6 mm,5 μm)色谱柱,流动相为乙腈(A)-0.1%磷酸水溶液(B),梯度洗脱(0 min→10 min→15 min→30 min→50 min→60 min,A为10%→10%→20%→25%→60%→85%),流速为1 mL·min-1,柱温为30℃,紫外检测器参数:检测波长为280 nm,蒸发光检测器参数:雾化管温度36℃,漂移管温度70℃,载气压力25 psi。理论板数按丹参酮ⅡA峰计算不低于2 000。
2.2 对照品溶液的制备 分别取丹参素钠、原儿茶醛、丹参酮ⅡA、三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1对照品适量,精密称定,加甲醇溶解并稀释至刻度,摇匀,得到混合对照溶液(每毫升含丹参素12.2 μg、原儿茶醛2.1 μg、丹参酮ⅡA 0.5 μg、三七皂苷R115.3 μg、人参皂苷Rg113.4 μg、人参皂苷Rb120.6 μg)。
2.3 供试品溶液的制备 取本品100粒,研细成粉末(过三号筛),取约0.3 g,精密称定,置具塞锥形瓶中,精密加入甲醇50 mL,精密称定,加热回流1 h,放冷,再称定质量,用甲醇补足减失的质量,摇匀,用筛孔内径0.45 μm滤膜过滤,即得。
2.4 系统适应性实验 分别精密量取对照品溶液和供试品溶液,按照“2.1”项色谱条件进样,分别以紫外检测器和蒸发光检测器检测,结果见图1,2。
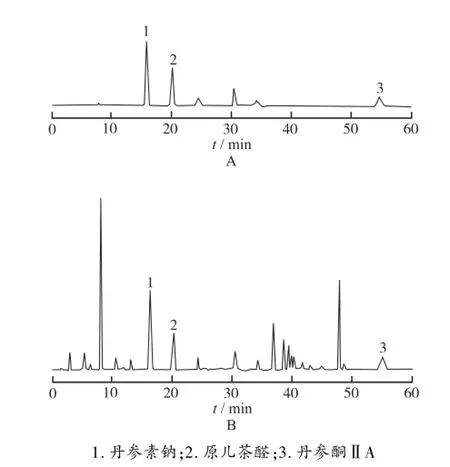
图1 对照品溶液(A)、供试品溶液(B)的高效液相色谱图(UV检测)
{L-End}
2.5 线性关系考察 精密吸取上述各对照品溶液2, 5,10,20,40 μL,注入色谱仪,丹参素、原儿茶醛、丹参酮ⅡA以进样量(μg)为自变量,色谱峰面积(A)为因变量,而三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1以进样量(μg)的对数为自变量,色谱峰面积(A)对数为因变量绘制标准曲线,建立回归方程,见表1。可见该方法在较大范围内线性关系良好。
2.6 精密度实验 精密吸取各对照品溶液连续进样5次,并连续7 d进样,按丹参素、原儿茶醛、丹参酮ⅡA以峰面积,三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1以峰面积对数分别计算,结果显示精密度符合要求,见表2。

图2 对照品溶液(A)、供试品溶液(B)的高效液相色谱图(ELSD检测)
{L-End}

表1 6种成分的回归方程及线性范围
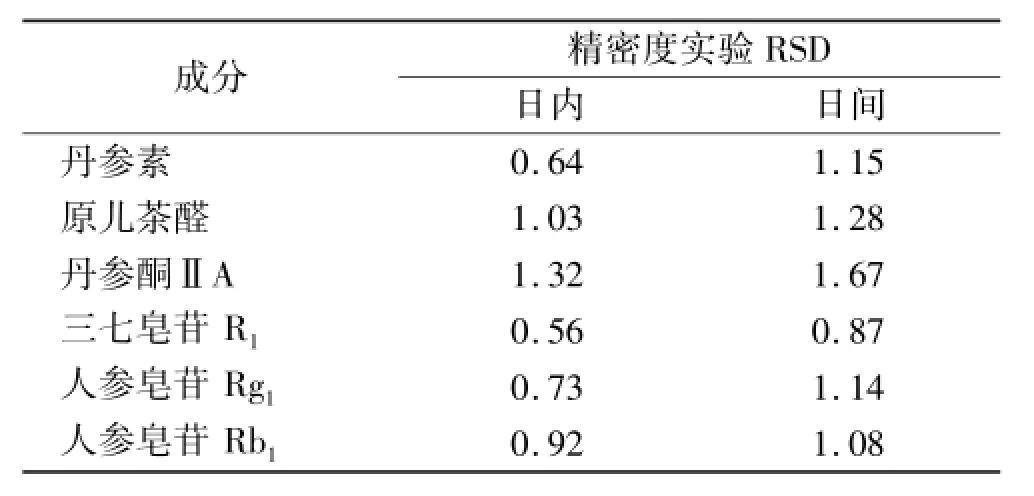
表2 6种成分精密度实验结果 %
2.7 稳定性实验 取同一供试品溶液(批号:101001),按相应的色谱条件,分别于配制后0,1,2,4,6,8,12,24 h进样,按照丹参素、原儿茶醛、丹参酮ⅡA以峰面积,三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1以峰面积对数分别计算,结果:各成分峰面积的RSD分别为1.93%, 1.56%,0.57%,2.69%,1.44%,1.93%。
2.8 重复性实验 取同一批样品,共6份,按“2.3”项下方法制备供试品溶液,按相应的色谱条件进样,按丹参素、原儿茶醛、丹参酮ⅡA以外标一点法,三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1以对数外标两点法分别计算含量,丹参素、原儿茶醛、丹参酮ⅡA、三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1的平均含量分别为11.31,1.53,0.06,2.11,2.16,3.89 mg·g-1,RSD分别为1.33%,0.79%,1.28%,2.59%,1.98%, 1.76%。
2.9 加样回收率实验 取已经确定含量的样品(批号:101001)6份,约0.25 g,精密称定,精密加入对照品适量,按相应的色谱条件进样,计算回收率,结果:丹参素、原儿茶醛、丹参酮ⅡA、三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1的回收率分别为98.58%, 100.54%,100.55%,99.55%,99.43%,99.23%,RSD分别为2.18%,1.98%,2.36%,1.59%,2.16%, 2.49%。见表3。
2.10 含量测定 按照供试品制备方法对3批样品处理,按照相应的色谱条件下进样测定,计算各成分的含量。结果见表4。
3 讨论
采用反相高效液相色谱法,多指标分析测定复方丹参滴丸与临床疗效相关的有效成分的含量,包括测定丹参的丹参素、原儿茶醛、丹参酮ⅡA,三七的三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1含量,与选用单种或两至三种成分作为中药复方的质量控制指标相比较,更能够全面地控制复方丹参滴丸的质量。通过对方法考察,结果表明,所建立的检测方法中,各成分精密度、稳定性、重复性良好,加样回收率实验结果也符合规定,提示本方法可以用于复方丹参滴丸的质量控制。
本实验在流动相系统的考察中,参考文献[6-7]比较流动相甲醇-水和乙腈-水,发现乙腈-水效果较为理想,另外复方丹参滴丸中的丹参素及原儿茶醛均属于邻二酚羟基结构,容易氧化导致含量测定不准确,故在流动相中加入0.1%磷酸溶液,目的是抑制丹参素及原儿茶醛的氧化。故笔者采用乙腈-0.1%磷酸作为流动相,通过梯度洗脱,各组分能有效地分离,无干扰。本研究中6种有效成分均能达到基线分离,此测定方法能较好对丹参素、原儿茶醛、丹参酮ⅡA、三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1进行定性和定量分析,系统适用性较好。
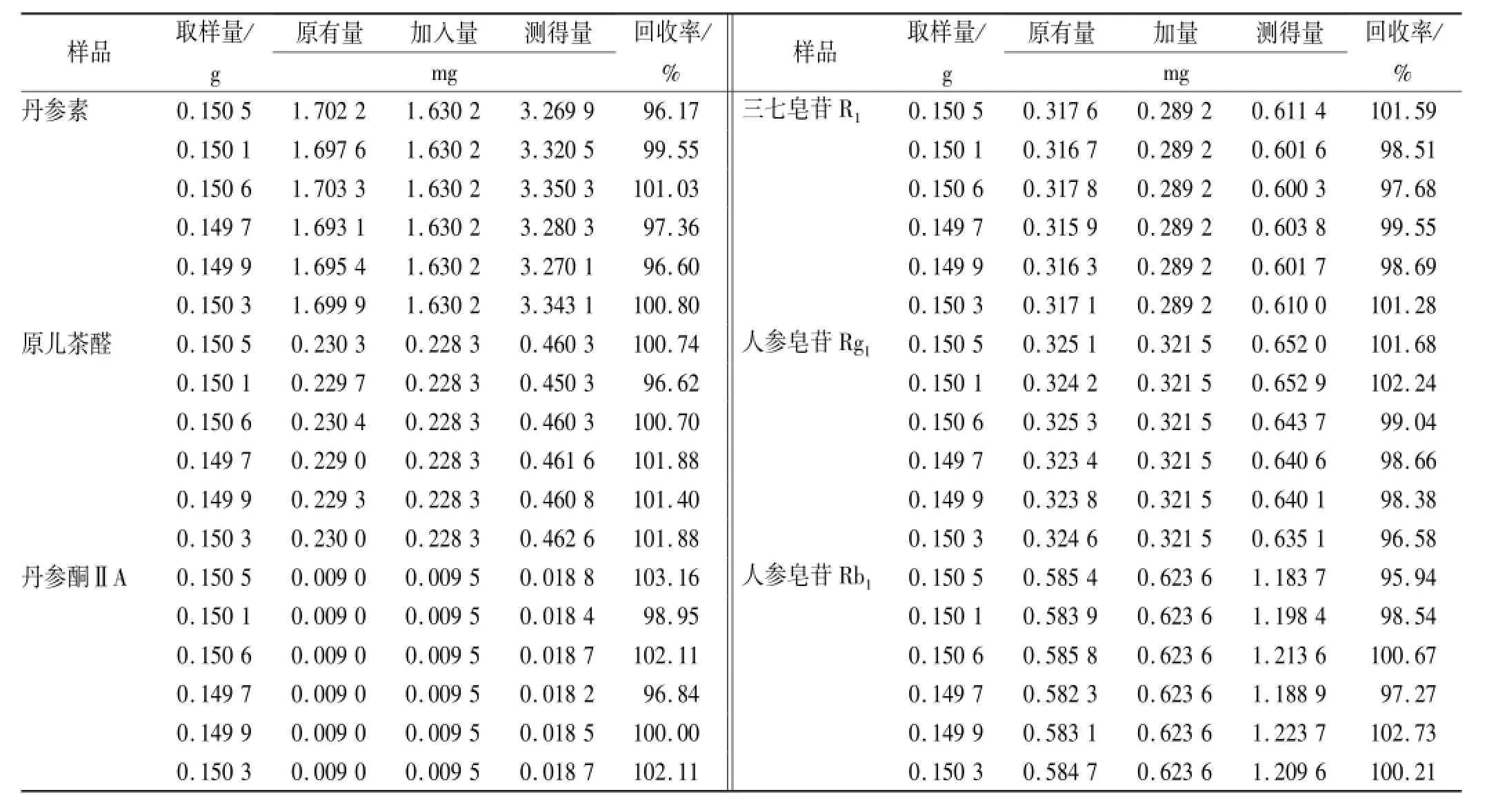
表3 6种成分加样回收率实验结果
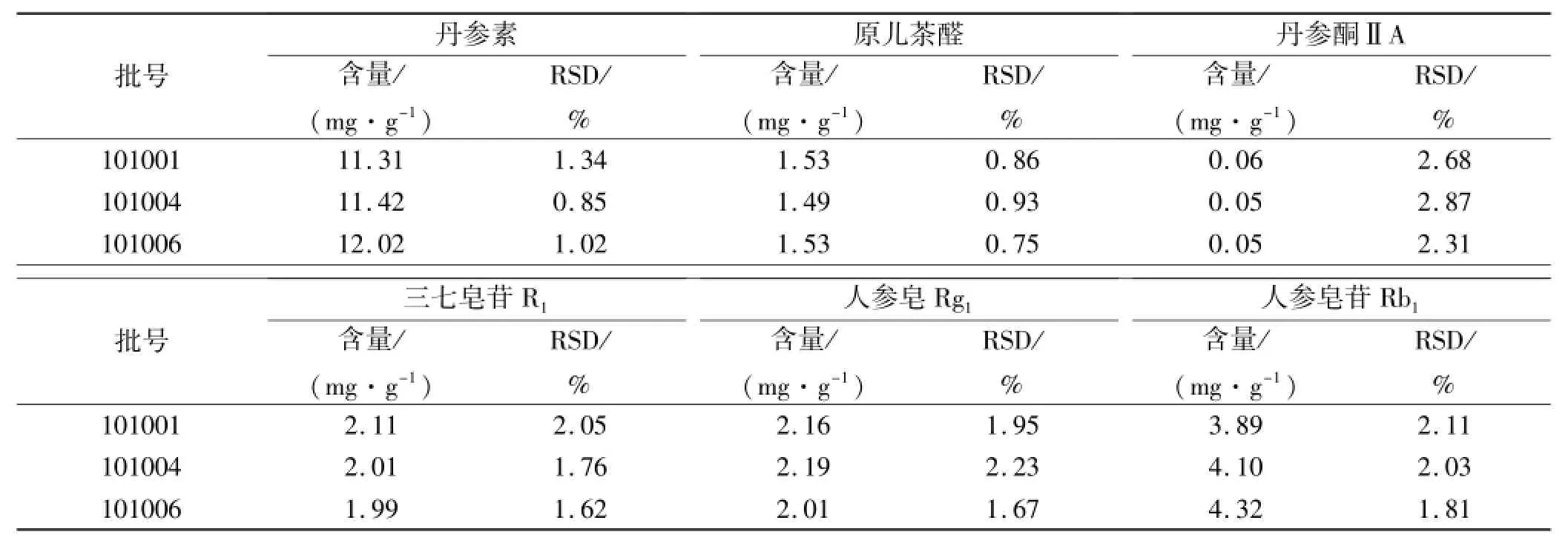
表4 3批样品中6种组分含量测定结果(n=3)
在复方丹参滴丸样品制备中,由于采用甲醇溶液超声提取时,有效成分提取不够充分,故改用甲醇回流提取。采用紫外检测器和蒸发光检测器联合检测,先通过紫外检测器,设定吸收波长280 nm,对丹参素、原儿茶醛、丹参酮ⅡA进行检测,再通过蒸发光检测器对三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1进行检测,很多文献对皂苷类的成分也用紫外检测器检测,设定波长约为203 nm,但是在这个范围波长时,图谱容易出现一些干扰峰,通过蒸发光检测器单独对皂苷类的成分检测,避免由于末端吸收而产生的干扰。另外,笔者通过紫外检测器与蒸发光检测器联用,可以同时检测复方丹参滴丸中的6种成分,操作简单,检测效率高,可为复方丹参滴丸的质量标准的建立和完善提供科学依据。
[1] 官波,牛秀明.复方丹参滴丸作用机制研究进展[J].山东医药,2008,48(40):115-116.
[2] 向柏,潘振华,曹德英,等.复方丹参滴丸质量控制和药理学研究进展[J].中国药房,2007,18(9):708-710.
[3] 袁琦,赵辉.HPLC法测定复方丹参滴丸中丹参素的含量[J].河南大学学报:医学版,2008,27(2):31-33.
[4] 许勇,诸艳蓉,王柯,等.HPLC测定复方丹参胶囊中三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1的含量[J].中国实验方剂学杂志,2013,19(6):148-151.
[5] 汪红,王强.HPLC法测定复方丹参制剂中丹参有效成分的含量[J].中国药科大学学报,2002,33(3):219-221.
[6] 游燕,徐国良,张启云,等.RP-HPLC同时测定复方丹参片中多种有效成分的含量[J].中国实验方剂学杂志,2010, 16(18):50-53.
[7] 陆继伟,于建,王柯,等.复方丹参片中三七皂苷R1和人参皂苷Rg1、Re、Rb1的HPLC法测定[J].中国医药工业杂志,2012,43(12):1027-1030.
DOI 10.3870/yydb.2014.10.033
R286;R927.2
B
1004-0781(2014)10-1375-05
2013-08-28
2013-10-22
张振军(1964-),男,河北承德人,副主任药师,学士,研究方向:中药临床合理用药。电话:(0)13831446898, E-mail:cxqdzhangzhenjun@163.com。

