离子强度对甲氨蝶呤-树枝状大分子纳米粒稳定性的影响*
赵燕娜,杨力,郝春影,2,李艳红,2,王向涛,郭一飞
(1.中国医学科学院、北京协和医学院药用植物研究所,北京 100193;2.黑龙江中医药大学,哈尔滨 150040)
离子强度对甲氨蝶呤-树枝状大分子纳米粒稳定性的影响*
赵燕娜1,杨力1,郝春影1,2,李艳红1,2,王向涛1,郭一飞1
(1.中国医学科学院、北京协和医学院药用植物研究所,北京 100193;2.黑龙江中医药大学,哈尔滨 150040)
目的 研究离子强度对甲氨蝶呤-树枝状大分子纳米粒稳定性的影响。方法以粒径及载药量变化为主要指标,分别考察不同离子(Na+、Cl-)及不同浓度氯化钠溶液对载药纳米粒稳定性的影响。结果确定Cl-起到稳定载药纳米粒的作用,且溶液中氯化钠质量分数<1.80%时,对纳米粒稳定作用明显。结论质量分数<1.80%的氯化钠溶液使得载药纳米粒稳定性明显增加,有助于长期储存。
甲氨蝶呤;离子强度;粒径;纳米粒;稳定性

本课题组先前制备以四代的聚酰胺-胺(polyamidoamine,PAMAM)树形分子为内核,以50%耦联效率接枝的二代三乙二醇树枝化基元寡聚乙二醇[oligo(ethylene glycol),OEG]为外壳的树枝状大分子(PAMAM-co-0.5OEG,0.5PAG,见图1),成功装载MTX,形成具有较高载药量和包封率的纳米粒。由于0.5PAG的PAMAM表面有暴露的弱碱性的-NH2基团,而MTX本身带有两个酸性的-COOH基团,因而静电相互作用是PAMAM装载MTX形成纳米粒的主要驱动力[15-17]。这也在其他实验结果中也得以验证。在对纳米粒稳定性的考察过程中,发现特定种类的盐溶液能显著影响其稳定性。因此,笔者在本研究探讨在药物装载及储存过程中,不同离子(Na+、Cl-)的溶液对纳米粒稳定性的影响,以期提高纳米粒长期储存稳定性。

图1 0.5PAG结构图Fig.1 Structure of 0.5PAG
1 仪器与试药
1.1 仪器 KQ3200DB型数控超声波清洗器(昆山市超声仪器有限公司);DGG-9030AD型电热恒温鼓风干燥箱(上海森信实验仪器有限公司);MEPPLER TOLEDO AL204电子天平[梅特勒-托利多仪器(上海)有限公司];RJ-TGL-16C型高速台式离心机(无锡市瑞江分析仪器有限公司);PURELAB Classic综合纯水仪(英国ELGA公司);LGL-10B冷冻干燥机(军事医学科学院实验仪器厂研制,北京四环科学仪器厂有限公司制造);Zetasizer Nano ZS 90(马尔文仪器有限公司);Ultimate 3000 Series高效液相色谱仪(Dionex); Hypersil GLOD C18色谱柱(4.6 mm×250 mm,5 μm, Thermo Scientific,美国);离心过滤器(Millipore Amicon Ultra-0.5 mL,Ultracel-3K Membrane,美国)。
1.2 试药 0.5PAG(相对分子质量1.34×105,本实验室合成);MTX(相对分子质量454.44,上海恒远生物技术有限公司);乙腈(批号:A3889,Fisher,色谱纯);其他试剂均为分析纯。
2 方法与结果
2.1 MTX含量测定方法的建立
2.1.1 HPLC Hypersil GLOD C18色谱柱(4.6 mm× 250 mm,5 μm);流动相为乙腈-磷酸盐缓冲液(phosphate buffer saline,PBS,pH=7.4)=(10∶90);流速0.8 mL·min-1;检测波长306 nm;温度30℃;进样量20 μL[4]。
2.1.2 标准曲线的制备 采用PBS溶液配制75,30, 10,5,1,0.4 μg·mL-1MTX溶液,在“2.1.1”项色谱条件下测定峰面积(A)。以A对浓度(C,μg·mL-1)进行线性回归,得MTX标准曲线,A=0.209 6+1.351 3×C,r=0.999 9,MTX浓度在0.4~75.0 μg·mL-1范围内线性关系良好。
2.2 MTX-0.5PAG纳米粒的制备及表征
2.2.1 不同介质MTX-0.5PAG纳米粒的制备及表征
室温下,将聚合物0.5PAG 16 mg与MTX 8 mg共同溶解于N,N-二甲基甲酰胺(N,N-dimethylformamide, DMF)1 mL中,搅拌3 h。随后,在4℃条件下,加入去离子水(5 mL),室温下继续搅拌12 h,再于4℃条件下对去离子水透析4 h,1 L·h-1,即得以水为介质MTX-0.5PAG纳米粒。将上述步骤中的去离子水换成0.9%氯化钠溶液,即得以0.9%氯化钠溶液为介质的MTX-0.5PAG纳米粒。
以动态光散射测定不同介质载药纳米粒粒径及电位,测定结果以平均粒径(D,nm)及Zeta电位(mV)记录。同时,以HPLC测定其包封率(encapsulation efficiency,EE)及载药量(drug loading capacity,DL)。方法如下:取纳米粒1 mL,冷冻干燥后用PBS溶解并定容到5 mL,按照“2.1.1”项色谱条件HPLC进样20 μL测定MTX浓度,计算得出纳米粒中MTX总量,记为W1。由于0.5PAG相对分子质量较大,在纳米粒对水透析过程中不会被透出,因而可以根据以下公式计算EE和DL:EE(%)=(W1/W2)×100%;DL(%)= [W1/(W1+W3)]×100%。其中,W1为纳米粒中的MTX总量,W2为MTX投药量,W3为0.5PAG投药量。将水和0.9%氯化钠溶液为介质制备的MTX-0.5PAG纳米粒进行对比,结果见表1。结果显示,二者包封率和载药量无明显差别;但介质为水时,纳米粒的粒径约为300 nm,0.9%氯化钠溶液纳米粒粒径明显减小,且其粒径分布变窄(图2)。
2.2.2 不同介质MTX-0.5PAG纳米粒的放置稳定性 不同介质制备的MTX-0.5PAG纳米粒于4℃冰箱放置10 d,每天取样,用动态光散射测定放置过程中的粒径变化。结果见图3。0.9%氯化钠溶液为介质的MTX-0.5PAG纳米粒溶液放置10 d内粒径均稳定在80~120 nm,放置2周没有肉眼可见的变化,显现出较好的稳定性。而同样条件下测定的,以水为介质的纳米粒在放置过程中随着时间的延长,粒径波动较大,且无特定规律,放置2周即出现明显的黄色药物沉淀,这种现象在其他实验过程中同样可以观察到。分析其原因,可能是由于纳米粒本身为不稳定体系,粒径测定结果也不稳定。
表1 不同介质制备的MTX-0.5PAG纳米粒的表征Tab.1 Characterization of the MTX-0.5PAG nanoparticles prepared by different medium n=3,±s

表1 不同介质制备的MTX-0.5PAG纳米粒的表征Tab.1 Characterization of the MTX-0.5PAG nanoparticles prepared by different medium n=3,±s
Zeta电位/包封率载药量112.05±0.68 0.9%氯化钠溶液67.54±6.0525.23±1.69128.63±5.870.18±0.0 mV水70.20±3.9725.97±1.09301.27±4.860.48±0.0制备介质%粒径/ nm多分散指数1-0.81±0.20
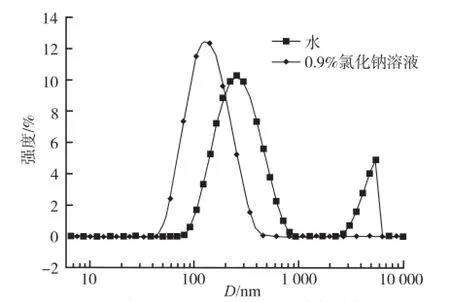
图2 不同介质MTX-0.5PAG纳米粒的粒径Fig.2 ParticlediameteroftheMTX-0.5PAG nanoparticles in different medium
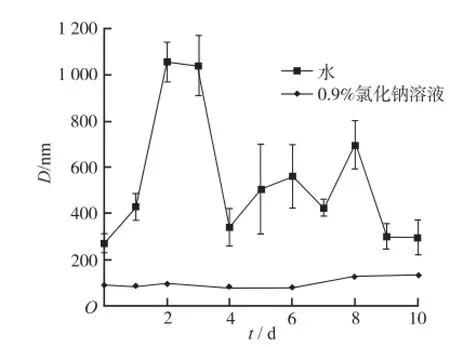
图3 不同介质MTX-0.5PAG纳米粒放置过程中的粒径变化(n=3)Fig.3 Changes of particle diameter of the MTX-0.5PAG nanoparticlesreconstitutedbydifferentmediumduring placement(n=3)
2.3 MTX-0.5PAG纳米粒的冻干复溶稳定性
2.3.1 MTX-0.5PAG纳米粒冻干复溶后的粒径变化MTX-0.5PAG纳米粒(未特殊说明均指介质为水的纳米粒)1 mL,-80℃预冻1 h,迅速放入冷冻干燥机,冻干12 h,取出后加入一定体积去离子水或5%葡萄糖溶液或0.9%氯化钠溶液,超声溶解30 s,用动态光散射测定粒径,并监测其4℃放置过程中的粒径变化。见图4。可见,用去离子水和5%葡萄糖溶液复溶的纳米粒,在4℃条件下放置9 d,其粒径均会随时间发生较大程度的波动,且每个时间点的粒径数据精密度较差。至第9天出现雾状悬浮颗粒(振摇即消失),再放置2周,底部即出现大量不可逆的药物粉末沉淀。而用0.9%氯化钠溶液复溶的纳米粒,其粒径则在3 d内趋于稳定,3周内均无明显变化。以上进一步证实0.9%氯化钠溶液可能会对纳米粒起到一定的稳定作用。
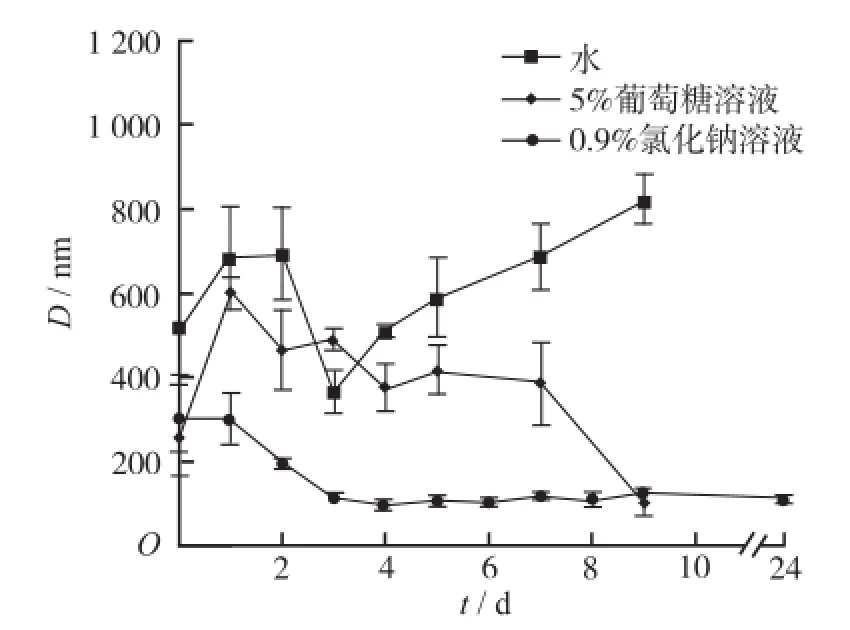
图4 MTX-0.5PAG纳米粒不同溶剂复溶后放置过程中的粒径变化(n=3)Fig.4 Changes of particle diameter of the MTX-0.5PAG nanoparticlesreconstitutedbydifferentmediumduring placement(n=3)
2.3.2 MTX-0.5PAG纳米粒0.9%氯化钠溶液复溶后放置过程中载药量的变化 以0.9%氯化钠溶液复溶的MTX-0.5PAG纳米粒,按照下述方法测定复溶后4 d内放置过程中载药量的变化,与未经冻干的纳米粒相同放置条件下载药量的变化进行对比,以进一步考察其冻干复溶稳定性。MTX-0.5PAG纳米粒溶液0.5 mL置于离心过滤器的内衬管内(底部有Ultracel超滤膜, MWCO 3000),56 000×g离心20 min,取滤液,HPLC进样测定。由于0.5PAG相对分子质量远大于3 000,无法通过Ultracel超滤膜,因而,可认为滤液中的MTX为纳米粒溶液泄漏出来的游离药物。通过测定滤液中的MTX浓度,计算得0.5 mL纳米粒滤液中的MTX总量W2,已知0.5 mL纳米粒溶液中MTX的总量W1(由包封率测定结果计算得出),及0.5 mL纳米粒溶液中0.5PAG的量W3(由0.5PAG的投药量计算得出),得出放置不同时间后纳米粒的载药量(DL)。DL(%)= (W1-W2)/(W1-W2+W3)×100%。结果见图5。从图5可以看出,用去离子水制备的纳米粒,放置4 d载药量下降近40%,说明纳米粒并不稳定,在放置过程中很快泄漏出大量游离药物。冻干后用0.9%氯化钠溶液复溶,放置4 d内纳米粒载药量并无下降趋势,且随放置时间的延长,能显著降低载药量测定过程中,高速离心对纳米粒的破坏。进一步证实0.9%氯化钠溶液对MTX-0.5PAG纳米粒的稳定作用。

图5 MTX-0.5PAG纳米粒放置及0.9%氯化钠溶液复溶后放置过程中载药量的变化(n=3)Fig.5 Changes of drug-loading rate of the MTX-0.5PAG nanoparticles or the ones reconstituted by saline during placement(n=3)
2.4 离子类型对MTX-0.5PAG纳米粒的稳定性影响为进一步探究影响MTX-0.5PAG纳米粒稳定性的原因,考查不同离子(Na+和Cl-)环境中纳米粒的稳定性:将冻干后的MTX-0.5PAG纳米粒分别分散于0.9%氯化钠溶液、150 mmol·L-1的KCl(与0.9%氯化钠溶液中Cl-摩尔浓度相等)及75 mmol·L-1Na2SO4(与0.9%氯化钠溶液中Na+摩尔浓度相等)溶液中,超声混匀,稳定后进行粒径测定。然后于4℃冰箱放置,隔一定时间测粒径,与未经冻干的纳米粒相同条件下放置的粒径变化进行对比。结果见图6,可见,Cl-等摩尔量的NaCl和KCl,二者加入后纳米粒粒径变小,放置7 d,纳米粒粒径波动也并不大,证实二者均具有增加纳米粒稳定性的作用。而对比Na+等摩尔量的NaCl和Na2SO4,同样条件下,加入NaCl后纳米粒粒径均变小,但加入Na2SO4纳米粒粒径变化却并不大。这一结果表明,纳米粒稳定性的增加可能是由于体系中的Cl-的作用。
2.5 不同浓度NaCl对MTX-0.5PAG纳米粒的稳定性影响 为确定增加纳米粒的稳定性应加入的NaCl的量,考察不同浓度NaCl对MTX-0.5PAG纳米粒的稳定性影响。向MTX-0.5PAG纳米粒溶液中分别添加NaCl,使NaCl终浓度分别为0.01%、0.02%、0.10%、0.30%、0.90%、1.80%、3.60%,稳定后进行粒径及电位测定。然后于4℃冰箱放置,10 d后再次进行粒径及电位测量。结果见表2。表2的粒径测量结果显示,在NaCl浓度≤1.80%时,纳米粒粒径稳定在纳米级别且粒径分布呈现单峰分布,纳米粒状态良好。而NaCl浓度增大到3.60%时,纳米粒粒径突然增大到微米级别,粒径分布峰变得较为杂乱,放置10 d后再次测量,其粒径变化不大,但再放置约2周,加入NaCl浓度为3.60%的纳米粒溶液能明显看到有分层现象。
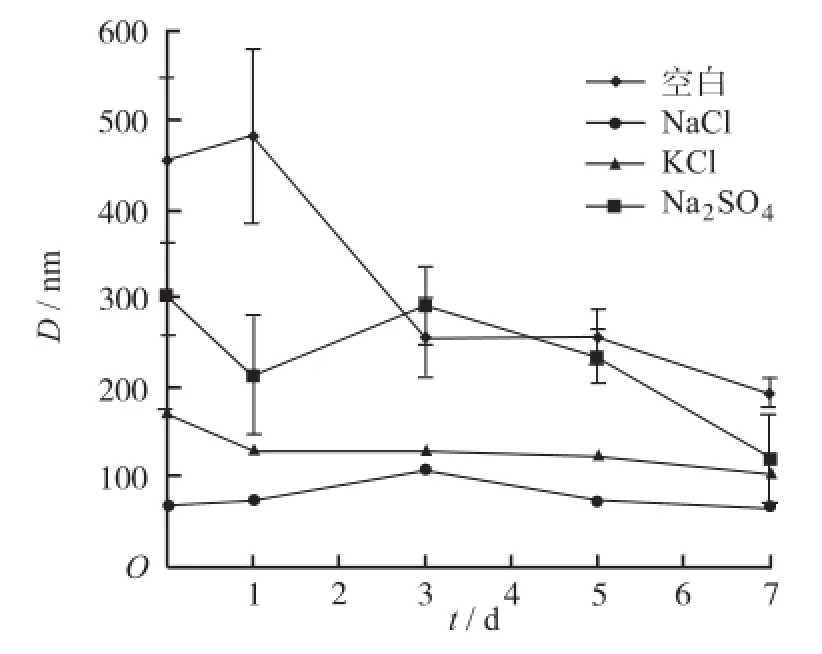
图6 离子类型对MTX-0.5PAG纳米粒粒径的影响(n=3)Fig.6 Effect of different ions on particle diameter of the MTX-0.5PAG nanoparticles(n=3)
3 讨论
由于纳米粒的稳定性与粒径大小关系密切,随着粒径的降低,纳米粒的稳定性增加。因此在纳米粒的制备过程中,将介质水换成0.9%氯化钠溶液,纳米粒粒径明显减小,说明0.9%氯化钠溶液可能会对纳米粒起到一定的稳定作用,这在纳米粒的冻干复溶稳定性实验中也得到了进一步的验证。
表2 不同浓度NaCl对MTX-0.5PAG纳米粒粒径与电位的影响(n=3)Tab.2 Effect of different concentration of saline on particle diameter and electric potential of the MTX-0.5PAG nanoparticles(n=3) ±s

表2 不同浓度NaCl对MTX-0.5PAG纳米粒粒径与电位的影响(n=3)Tab.2 Effect of different concentration of saline on particle diameter and electric potential of the MTX-0.5PAG nanoparticles(n=3) ±s
NaCl浓度/%粒径/nm Zeta电位/mV 0 d10 d 0 d10 d 0.01215.4±4.7190.4±1.56.0±0.26.3±0.3 0.02227.6±2.5204.5±1.24.1±0.44.3±0.4 0.10255.8±1.7221.6±0.32.5±0.72.4±0.6 0.30301.9±9.5259.0±3.4-0.2±0.3-0.1±0.1 0.90424.4±4.8315.5±6.8-2.1±0.2-1.6±0.2 1.80447.9±5.2360.9±6.9-2.7±0.4-2.2±0.6 3.602 585.0±221.3412.0±46.8-3.6±0.7-1.5±0.1
不同离子(Na+和Cl-)环境中纳米粒的稳定性实验,证实纳米粒稳定性的增加可能是由于体系中的Cl-的作用。且通过不同浓度NaCl对MTX-0.5PAG纳米粒的稳定性影响实验发现,浓度<1.80%的NaCl溶液,纳米粒相对稳定,NaCl浓度增高到一定程度,纳米粒稳定性反而降低。在NaCl浓度从低到高的变化过程中,纳米粒的Zeta电位出现从正值到负值的转变,但其电位值均未达到传统纳米粒电位的稳定临界值30 mV。推测这可能是由于实验中所使用的0.5PAG本身亲水性及电离性质不同于传统两亲性表面活性剂,载药机制较为复杂,因而其为载体材料制备的纳米粒无法根据电位值的变化进行稳定性的判断。
本研究结果表明,质量分数<1.80%的NaCl使MTX-0.5PAG纳米粒溶液稳定性明显增加,这为MTX-0.5PAG纳米粒的长期储存提供可能,有利于对纳米粒进行进一步的体内和生物利用度研究。
[1] 马一平.抗肿瘤药物的研究进展[J].天津药学,2001,13 (5):17-19.
[2] 郑明彬,龚萍,杨雪梅,等.包载甲氨蝶呤的聚乙交酯丙交酯纳米颗粒的制备与体外释药机制研究[J].时珍国医国药,2009,20(11):2812-2813.
[3] 吴建锋,於得红,方超,等.甲氨蝶呤-聚乳酸-羟基乙酸共聚物纳米囊的制备及其体外释药的研究[J].中国药学杂志,2010,45(2):119-123.
[4] 何花,盛小茜,张海龙,等.甲氨蝶呤柔性纳米脂质体的构建及表征[J].中国医药工业杂志,2012,43(10):827-831.
[5] 王璐璐,朱林,倪坤仪,等.HPLC研究甲氨喋呤磁靶向脂质体在小鼠体内的组织分布[J].中国药学杂志,2006, 41(20):1572-1575.
[6] 尹耀庭,何花,盛小茜,等.甲氨蝶呤柔性纳米脂质体凝胶的构建及体外经皮渗透性研究[J].中南药学,2012, 10(8):590-594.
[7] 郎轶咏,姜同英,郑力,等.甲氨蝶呤/聚天冬氨酸衍生物-接枝-聚乙二醇共聚物胶束制备及其体内外释药考察[J].中国医院药学杂志,2010,30(5):396-399.
[8] 支晓慧,金莉莉,杨长青.甲氨蝶呤微乳的制备与质量评价[J].中国药房,2011,22(5):433-436.
[9] 孙宇,钮萌萌,王佳苗,等.喷雾干燥法制备鼻用甲氨蝶呤壳聚糖微球及其特性的考察[J].沈阳药科大学学报, 2009,26(4):260-264.
[10] 孔淑仪,唐国涛,裴元英,等.聚乙二醇修饰的聚酰胺-胺-甲氨蝶呤分子复合物的制备及体外释药研究[J].中国药学杂志,2008,43(14):1085-1091.
[11] 林苏娜,林华庆.纳米粒作为抗肿瘤药物载体的研究进展[J].中国肿瘤临床,2013,40(6):363-366.
[12] 章怡彬,梁文权,高建青.纳米粒作为抗肿瘤药物载体的研究进展[J].医药导报,2006,25(6):551-553.
[13] 陈莉,汤忞,陆伟根.纳米混悬剂粒径稳定性及其控制策略[J].世界临床药物,2010,31(4):245-249.
[14] OWEN H,GRAHAM S,WERLING J O,et al.Anion effects on electrostaticchargingofstericallystabilized,water insoluble drug particles[J].Int J Pharm,2009,368(1-2): 154-159.
[15] TWYMAN L J,BEEZER A E,ESFAND R,et al.The synthesis of water soluble dendrimers,and their application as possible drug delivery systems[J].Tetrahedron Lett, 1999,40(9):1743-1746.
[16] KOLHE P,MISRA E,KANNAN R M,et al.Drug complexation,in vitrorelease and cellular entry of dendrimers and hyperbranched polymers[J].Int J Pharm,2003,259(1-2):143-160.
[17] KOJIMA C,KONO K,MARUYAMA K,et al.Synthesis of polyamidoamine dendrimers having poly(ethylene glycol) grafts and their ability to encapsulate anticancer drugs[J]. Bioconjug Chem,2000,11(6):910-917.
DOI 10.3870/yydb.2014.10.030
Effect of Ionic Strength on Stability of Methotrexate-loaded Dendrimer Nanoparticles
ZHAO Yan-na1,YANG Li1,HAO Chun-ying1,2,LI Yan-hong1,2,WANG Xiang-tao1,GUO Yi-fei1
(1.The Institute of Medicinal Plant Development,Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing 100193,China;2.Heilongjiang University of Chinese Medicine,Harbin 150040,China)
ObjectiveTo investigate the influence of ionic strength on the stability of the methotrexate-loaded dendrimer nanoparticles.MethodsThe influences of different ions(Na+,Cl-)and different concentrations of sodium chloride on the stability of the nanoparticles were studied.The particle size was measured by dynamic light scattering(DLS)and drugloading content was determined by high-performance liquid chromatography(HPLC)in order to evaluate the stability.ResultsThe Cl-was finally verified to play an important role in stabilizing the nanoparticles and the effective concentration of the sodium chloride was recommended to be below 1.80%.ConclusionThe recommended concentration(less than 1.80%)of the sodium chloride significantly improves the stability of the nanoparticles and benefits for long term storage.
Methotrexate;Ionic strength;Size;Nanoparticles;Stability
R979.1;R927.11
A
1004-0781(2014)10-1365-05
2013-11-12
2014-02-24
*国家自然科学基金资助项目(21004079)
赵燕娜(1990-),女,山东聊城人,硕士,主要从事药物新型载体材料研究。电话:(0)18618328872,E-mail:zhaoyanna20102010@163.com。
郭一飞(1982-),女,河南郑州人,助理研究员,博士,主要从事药用高分子材料研究。电话:010-57833264,E-mail:ffguo@163.com。
杨力(1979-),男,河南信阳人,助理研究员,博士,主要从事纳米材料制备及应用研究。电话:010-62108290,E-mail:yangli6162@126.com。

