SOD1和PI3K/AKT信号转导通路在丙泊酚防治兔脊髓缺血-再灌注损伤中的作用*
余奇劲,陶红,杨云朝
(1.武汉大学人民医院麻醉科,武汉 430060;2.武汉市第一医院麻醉科,武汉 430022)
SOD1和PI3K/AKT信号转导通路在丙泊酚防治兔脊髓缺血-再灌注损伤中的作用*
余奇劲1,陶红1,杨云朝2
(1.武汉大学人民医院麻醉科,武汉 430060;2.武汉市第一医院麻醉科,武汉 430022)
目的 探讨超氧化物歧化酶-1(SOD1)和磷脂酰肌醇3激酶(PI3K)/丝氨酸(苏氨酸)蛋白激酶B(AKT)的信号转导通路在缺血前后丙泊酚联合运用防治兔脊髓缺血-再灌注损伤(SCIRI)中的作用。方法将60只日本大耳白兔(雄性)随机均分为3组(n=20):假手术组(S组)、缺血-再灌注组(I/R组)和丙泊酚保护组(P组)。I/R组和P组阻断腹主动脉40 min,再恢复其血流。P组于主动脉阻断前10 min和再灌注即刻分别静脉泵注丙泊酚30 mg·kg-1,其余两组则在相同时间点给予相同容积0.9%氯化钠溶液。3组动物分别于术后1,2,3,5,7 d均被随机处死4只动物,取其脊髓组织的L3-L4段,分别采用酶联免疫吸附测定(ELISA)法检测SOD1活性,采用实时聚合酶链反应(RT-PCR)法检测SOD1、PI3K、AKT的mRNA的表达水平。结果3组动物脊髓组织SOD1活性变化:术后第1天,与S组比较,I/R组、P组SOD1活性均显著增强(均P<0.05);术后第2天,与S组比较,P组SOD1活性升高(P<0.05),而I/R组则无明显变化(P>0.05);术后第3~7天,与S组比较,I/R组SOD1活性均显著降低(均P<0.05),而P组则无明显变化(均P>0.05)。利用线性回归分析发现,脊髓组织SOD1、PI3K、AKT的mRNA表达变化与SOD1活性的变化呈正相关。结论缺血前和缺血后丙泊酚联合运用可有效防治兔SCIRI,其作用机制可能与丙泊酚通过激活PI3K/AKT信号转导通路,进而增强脊髓组织中SOD1的表达有关。
丙泊酚;脊髓;缺血-再灌注;超氧化物歧化酶
本课题组前期实验研究表明[1-2],缺血前和缺血后联合应用丙泊酚可显著增强兔脊髓中超氧化物歧化酶-1(superoxide dismutase-1,SOD1)的活性,进而有效防治脊髓缺血-再灌注损伤(spinal cord ischemic reperfusion injury,SCIRI),但具体作用机制尚未完全清楚[3]。WANG等[4]研究大鼠脑缺血-再灌注发现,腹腔注射大剂量丙泊酚,可激活磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase,PI3K)/丝氨酸(苏氨酸)蛋白激酶B(serine/threonine protein kinase B,AKT)信号转导通路,从而起到脑保护作用。此外,在心脏缺血-再灌注损伤中应用丙泊酚也可有效激活PI3K/AKT信号转导通路,减轻心肌细胞内质网途径凋亡,防治心脏缺血-再灌注损伤[5-6]。基于以上研究,本课题拟用兔脊髓缺血-再灌注模型,采用丙泊酚缺血前和缺血后联合运用干预实验,探讨SOD1和PI3K/AKT信号转导通路与丙泊酚防治脊髓缺血-再灌注损伤的关系。
1 材料与方法
1.1 动物 日本大耳白兔60只,普通级,体质量2.0~2.5 kg,雄性;质量合格证:NO.4200400243;动物使用许可证号:SCXK(鄂)2008-003,由武汉大学实验动物研究所提供。全价营养颗粒饲料,定时喂料,每天2次,供应足够清洁饮水。兔舍温度维持16~29℃,相对湿度40%~70%,噪音<60 dB。
1.2 仪器与试剂 DH140B型动物呼吸机(浙江医疗仪器厂),LIFESCOPE9型生理仪(日本光学有限公司),微量泵(英国Graseby公司),丙泊酚(商品名:得普利麻,英国阿斯利康公司,批号:JC843,规格: 20 mL∶200 mg],SOD1试剂盒(武汉华美生物工程有限公司,批号:CSB-EL022397RB)。
1.3 实验动物分组 本实验由武汉大学人民医院动物研究机构审查委员会批准,按实验室动物维护、使用的指导建议和要求处理动物。由实验人员采取随机数字表均分为3组:假手术组(S组),每组各20只。缺血-再灌注组(I/R组)和丙泊酚保护组(P组)。每组动物分别于术后1,2,3,5,7 d被处死,每个时间点均随机处死4只。所有动物处死前均被安置在单独的笼子里饲养,保证充足饮水、食物和良好的采光环境。
1.4 SCIRI模型的建立 静脉留置针行耳缘静脉穿刺,注入3%戊巴比妥钠(戊巴比妥钠300 mg溶于0.9%氯化钠溶液10 mL)2 mL,经口气管插管接呼吸机控制呼吸,频率控制30次·min-1,呼吸比1.5∶1,二氧化碳分压(PaCO2)维持在4.67~6.00 kPa。经耳缘静脉输注林格液10 mL·kg-1·h-1,间断静脉注射3%戊巴比妥钠0.5mL·kg-1和维库溴铵0.5 mg·kg-1维持麻醉。3 mg·kg-1肝素化后经右侧股动脉插管,接生理仪连续监测股动脉压和心电图,保持血流动力学稳定。加热垫维持直肠体温在38℃。I/R组和P组通过阻断主动脉创建SCIRI模型[4]:沿左肋边缘下的竖脊肌旁纵行切开皮肤,分离裸露腹主动脉,于左肾动脉下1 cm水平以小直径弹性硅胶管阻断腹主动脉血流,使其动脉搏动消失,远端平均动脉压为0 mmHg(1 mmHg=0.133 kPa),阻断40 min后分别于再灌注后第1,2,3,5,7天处死动物,成功建立SCIRI模型。S组行腹主动脉分离,放置弹性硅胶管,不阻断其血流。
1.5 丙泊酚干预 P组于主动脉阻断前10 min和再灌注即刻分别以微量泵持续静脉输注丙泊酚30 mg·kg-1溶于0.9%氯化钠溶液30 mL,输注速度3 mL·min-1;而S组和I/R组在相应时间点则用微量泵以相同速度输注0.9%氯化钠溶液30 mL。所有动物在手术操作完毕缝合包扎并肌内注射青霉素40万U,待动物清醒后拔出气管导管,再归笼饲养观察。
1.6 标本的采集与保存 所有日本大耳白兔分别于术后第1,2,3,5,7天采取股动脉放血处死,迅速剥去背部皮毛,并用剪刀取L2~L6水平段脊椎,于冰器皿上取出脊髓组织,用刀片切去两端损伤段脊髓,保留L3~L4水平段脊髓组织,用三蒸水清洗去污、迅速置入5 mL冻存管,液氮下快速冷冻,再转-80℃冰箱冻存。
1.7 检测指标
1.7.1 脊髓组织标本SOD1活性检测方法 所有兔L3-4段脊髓新鲜组织,取100 mg用1×PBS洗去血污。剪成小块放入组织研磨器(匀浆管)中,加入1×磷酸盐缓冲液(phosphate buffered solution,PBS)1 mL制成匀浆,然后置于-20℃过夜;经过反复冻融2次处理破坏细胞膜后,将组织匀浆于2~8℃、5 000×g离心5 min;取适量上清液立即进行实验,酶联免疫吸附测定(enzyme-linked immuno-sorbent assay,ELISA)SOD1试剂盒进行检测。
1.7.2 脊髓组织SOD1、PI3K、AKT的mRNA表达水平的测定 所有日本大耳白兔脊髓组织采用实时荧光定量法(real time polymerase chain reaction,RT-PCR)测定SOD1、PI3K、AKT的mRNA的表达水平。4种蛋白的引物核苷酸均由Invitrogen Biotechnology Co.,LTD中国公司合成(表1)。
RT-PCR操作步骤:①提取样本总RNA,制成RNA溶液。取脊髓组织100 mg置入渗有Trizol Reagent 1 mL的匀浆器中充分研磨,加入三氯甲烷溶液250 μL充分混匀,静置3 min;4℃于1 300×g离心8 min,取上清液于新的离心管中并加入0.8倍体积异丙醇混匀,-20℃放置15 min,4℃于1 300×g离心10 min,管底白色沉淀即为RNA;再通过洗涤、离心,加无RNA酶的水溶解RNA。②反转录。取RNA溶液2 μg置于PCR管中,加入1 μL的oligo(dT)15,再加入无核糖核酸酶的去离子水至12 μL,放入PCR仪上70℃保温5 min,再迅速于冰上冷却;依次加入5×PBS 4 μL,10 mmol·L-1dNTPs 2 μL,RNA抑制剂1 μL和反转录酶1 μL,用枪抽吸混匀;然后再放入PCR仪上42℃保温30 min,后于80℃保温5 min灭活反转录酶。③定量PCR。先取0.2 mL PCR管,配制反应体系,每个反转录产物配制3管;依次加2×qPCR Mix 12.5 μL、2.5 μmol·L-1基因引物2.0 μL(或2.5 μmol·L-1内标引物2.0 μL)、反转录产物2.0 μL、ddH2O 8.5 μL;再行PCR扩增,预变性95℃,1 min后,95℃,15 s;58℃,20 s;72℃,20 s;循环40次;末段延伸72℃,5 min,溶解曲线每20 s升温1℃,由72℃升至95℃。④计算基因的表达量。根据ΔCt=CT目的基因-Ctβ-actin,△△Ct=△CT实验-△CT对照,扩增倍数=2-△△CT计算目的基因与GAPDH相对表达量。
1.8 统计学方法 采用SPSS17.0版统计学软件进行数据分析;所有计量资料以均数±标准差(±s)表示,组间同一时间点采用单因素方差分析;两变量间采用线性回归分析。P<0.05表示差异有统计学意义。
2 结果
2.1 脊髓组织SOD1活性检测结果 3组动物同一时间点脊髓组织SOD1活性比较,术后第1天,与S组比较,I/R组、P组SOD1活性均明显增强(P<0.05);术后第2天,与S组比较,P组SOD1活性均升高(P<0.05),而I/R组则无明显变化(P>0.05);术后第3天至第7天,与S组比较,I/R组SOD1活性显著降低(P<0.05),而P组则无明显变化(P>0.05)。见图1。
2.2 实时荧光定量RT-PCR检测结果
2.2.1 脊髓组织SOD1 mRNA的表达情况 3组动物同一时间点脊髓组织SOD1 mRNA的表达水平比较,术后第1天,与S组比较,I/R组、P组SOD1 mRNA的表达水平均增高(P<0.05);与I/R组比较,P组SOD1 mRNA的表达水平显著降低(P<0.05);术后第2天,与S组比较,P组SOD1 mRNA的表达水平显著升高(P<0.05),I/R组则无明显变化(P>0.05);术后第3天至第7天,与S组比较,I/R组SOD1 mRNA的表达水平显著降低(P<0.05),而P组则无明显变化(P>0.05)。见图2。
2.2.2 脊髓组织PI3K mRNA的表达情况 3组动物同一时间点脊髓组织PI3K mRNA的表达水平比较:①术后第1天,与S组比较,I/R组、P组PI3K mRNA的表达水平均增高(P<0.05);②术后第2天,与S组、I/ R组比较,P组PI3K mRNA的表达水平明显升高;③术后第3,5,7天,与S组比较,I/R组PI3K mRNA的表达水平显著减低(P<0.05),P组则无明显变化(P>0.05)(图3)。

表1 测定SOD1、AKT、PI3K各mRNA表达水平所用核苷酸引物Tab.1 Nucleotide primers of SOD1mRNA、AKTmRNA、PI3KmRNA genes

与S组比较,*1P<0.05;与I/R组比较,*2P<0.05图1 3组在不同时间的SOD1活性Compared with S group,*1P<0.05;Compared with I/R group,*2P<0.05Fig.1 SOD1 activity of three groups at different time points
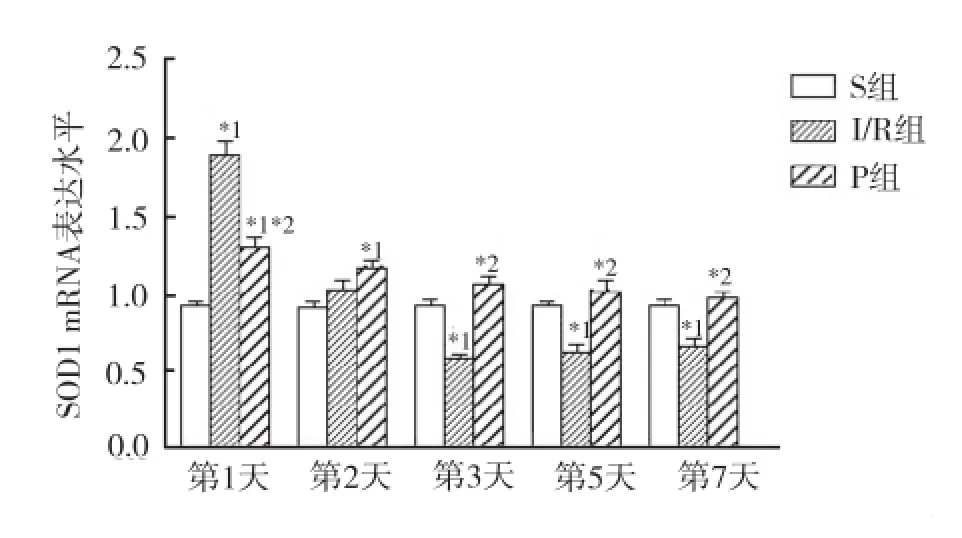
与S组比较,*1P<0.05;与I/R组比较,*2P<0.05图2 3组不同时间SOD1 mRNA的表达水平Compared with S group,*1P<0.05;Compared with I/R group,*2P<0.05Fig.2 SOD1 mRNA expression of three groups at different time points
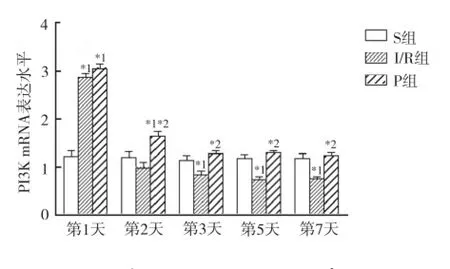
与S组比较,*1P<0.05;与I/R组比较,*2P<0.05图3 3组不同时间PI3K mRNA的表达水平Compared with S group,*1P<0.05;Compared with I/R group,*2P<0.05Fig.3 PI3K mRNA expression of three groups at different time points
2.2.3 脊髓组织AKT mRNA的表达情况 3组动物同一时间点脊髓组织AKT mRNA的表达水平比较,术后第1天,与S组比较,I/R组、P组AKT mRNA的表达水平均增高(P<0.05);术后第2天,与S组、I/R组比较,P组AKT mRNA的表达水平明显升高;术后第3至第7天,与S组比较,I/R组AKT mRNA的表达水平显著减低(P<0.05),P组则无明显变化(P>0.05)。见图4。
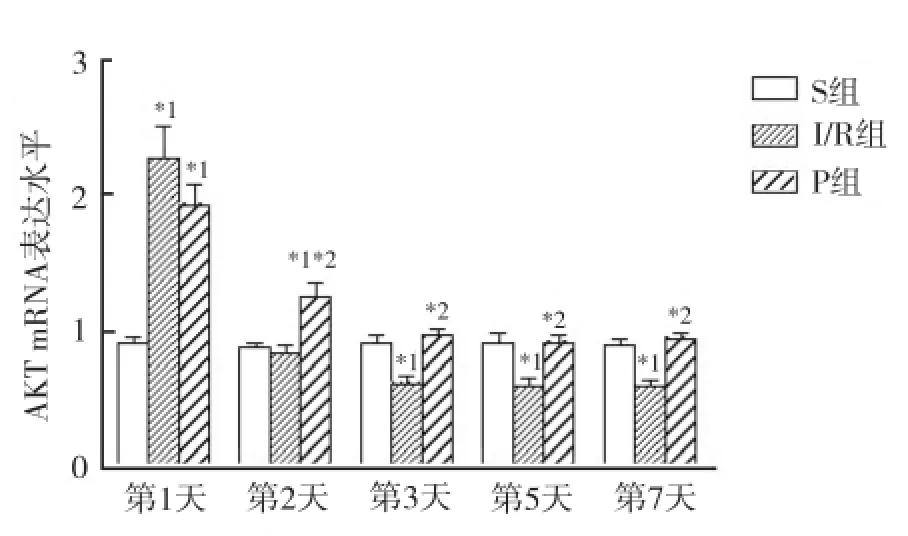
与S组比较,*1P<0.05;与I/R组比较,*2P<0.05图4 3组不同时间AKT mRNA的表达水平Compared with S group,*1P<0.05;Compared with I/R group,*2P<0.05Fig.4 AKT mRNA expression of three groups at different time points
2.3 相关分析 所有数据相对变化量为同一时间点某检测指标均数减去该时间点S组的均数(如:术后第1天I/R组SOD1活性相对变化量=术后第1天I/R组SOD1活性的均数-术后第1天S组SOD1活性的均数)。利用术后不同时间点SOD1活性、SOD1 mRNA、AKT mRNA、PI3K mRNA相对变化量进行线性回归分析,结果发现在I/R组、P组中,SOD1 mRNA、AKT mRNA、PI3K mRNA相对变化量与SOD1活性相对变化量均成正相关。I/R组中SOD1 mRNA相对变化量与SOD1活性相对变化量线性分析,r=0.98,P<0.01; AKT mRNA相对变化量与SOD1活性相对变化量线性分析r=0.93,P=0.02;PI3K mRNA相对变化量与SOD1活性相对变化量线性分析r=0.90,P=0.03。P组中SOD1 mRNA相对变化量与SOD1活性相对变化量线性分析r=0.99,P<0.01;AKT mRNA相对变化量与SOD1活性相对变化量线性分析r=0.99,P<0.01; PI3K mRNA相对变化量与SOD1活性相对变化量线性分析r=0.96,P<0.01。说明SOD1、AKT、PI3K的mRNA表达水平变化与SOD1活性的变化是一致的。
3 讨论
PI3K/AKT信号转导通路广泛存在于生物体细胞内,具有细胞分化调节和抗细胞凋亡的作用,是许多细胞生命活动的关键信号转导通路[7]。PI3K是由一个催化亚基p110和一个调节亚基p85共同组成,被激活后, PI3K的磷脂酰肌醇环上的3位羟基磷酸化,产生磷酸化的磷脂酰肌醇;磷酸化的磷脂酰肌醇再通过活化的磷酸肌醇依赖性激酶-1激活AKT,使之活化,进而激活或抑制下游靶蛋白,产生信号转导通路的级联反应[8-9]。
目前已有研究报道显示,在脑、心脏等重要组织或器官缺血-再灌注损伤中,大剂量应用丙泊酚可激活组织细胞中PI3K/AKT信号转导通路,起到有效的保护作用。本实验采用实时荧光定量RT-PCR从基因水平上进行检测,对其mRNA的相对变化量利用线性回归分析,结果发现:3组动物脊髓组织中SOD1、AKT、PI3K的mRNA表达水平的变化趋势与SOD1活性变化趋势具有一致性,表明在兔SCIRI中PI3K/AKT信号转导通路与SOD1活性变化紧密相关。同一时间点(术后第1,2天),与S组比较,P组PI3K、AKT的mRNA表达水平均显著提高,说明缺血前和缺血后丙泊酚联合运用可激活PI3K/AKT信号转导通路。但在丙泊酚防治兔SCIRI的实验中,究竟是由增强的SOD1活性激活了PI3K/AKT信号转导通路,还是由激活的PI3K/AKT信号转导通路增强了SOD1活性呢?
目前,已有大量细胞体外实验表明,抗氧化药物是通过激活PI3K/AKT信号转导通路,进而上调SOD1或SOD2活性,起到抗氧化应激的作用,有效防治细胞DNA氧化损伤、线粒体功能障碍、神经细胞凋亡等作用[10-11]。因而,笔者推测缺血前和缺血后丙泊酚联合运用也是通过先激活PI3K/AKT信号转导通路,进而引起SOD1活性上调,有效清除脊髓组织中过多的活性氧自由基,从而有效保护脊髓神经元抗氧化损伤。
[1] YU Q J,HU J,YANG J,et al.Protective effect of coapplicationofpropofolpreconditioningand postconditioning on ischemic spinal cord injury in a rabbit model[J].Neural Regeneration Res,2011,6(12):951-955.
[2] 杨云朝,余奇劲,陈娟,等.超氧化物歧化酶在缺血前和缺血后丙泊酚联合运用防治脊髓缺血-再灌注损伤中的相对作用研究[J].中华临床医师杂志:电子版,2013,7 (2):130-134.
[3] 方建国.超氧化物歧化酶不同亚型与中枢神经功能损伤的关系研究[J].中华临床医师杂志:电子版,2013,7 (5):170-172.
[4] WANG H Y,WANG G L,YU Y H,et al.The role of phosphoinositide-3-kinase/Akt pathway in propofol-induced postconditioning against focal cerebral ischemia-reperfusion injury in rats[J].Brain Res,2009,1297:177-184.
[5] WANG B H,SHRAVAH J,LUO H,et al.Propofol protects against hydrogen peroxide-induced injury in cardiac H9c2 cells via Akt activation and Bcl-2 up-regulation[J]. Biochem Biophys Res Commun,2009,389(1):105-111.
[6] 刘柳,庞勇,何东伟,等,丙泊酚对离体大鼠缺血-再灌注心脏PI3K/Akt信号通路及内质网应激凋亡途径的影响[J].中华医学杂志,2012,92(37):2611-2614.
[7] VOIGT P,BROCK C,NURNBERG B,et al.Assigning functional domainswithinthep101regulatorysubunitof phosphoinositide 3-kinase gamma[J].Biol Chem,2005,280 (6):5121-5127.
[8] MCMUUEN J R,JENNINGS G L.Diferences between pathological andphysiologicalcardiachypertrophy:novel therapeutic strategies to treat heart failure[J].Clin Exp Pharmacol Physio1,2007,34(4):255-262.
[9] SHIOJIMA I,WALSH K.Regulation of cardiac growth and coronary angiogenesis by the Akt/PKB signaling pathway [J].Genes Dev,2006,20(24):3347-3365.
[10] ROJO A I,SALINAS M,MARTIN D,et al.Regulation of Cu/Zn-superoxidedismutaseexpressionviathe phosphatidylinositol 3 kinase/Akt pathway and nuclear factor-kappaB[J].J Neurosci,2004,24(33):7324-7334.
[11] ZHANG R,CHAE S,LEE J H,et al.The cytoprotective effect of butin against oxidative stress is mediated by the up-regulationofmanganesesuperoxidedismutase expression through a PI3K/Akt/Nrf2-dependent pathway [J].J Cell Biochem,2012,113(6):1987-1997.
DOI 10.3870/yydb.2014.10.005
Role of SOD1,PI3K/AKT Signaling Pathway in Protection of Propofol on Spinal Cord Ischemic Reperfusion Injury in Rabbit Model
YU Qi-jing1,TAO Hong1,YANG Yun-zhao2
(1.Department of Anesthesiology,Renmin Hospital of Wuhan University,Wuhan 430060,China;2.Department of Anesthesiology,the First Hospital of Wuhan City,Wuhan 430022,China)
ObjectiveTo investigate roles of superoxide dismutase-1(SOD1),phosphatidylinositol 3-kinase(PI3K)/ serine/threonine protein kinase(AKT)signal transduction pathway in protection of propofol on spinal cord ischemic reperfusion injury(SCIRI)in rabbit model before and after ischemia.MethodsSixty Japanese male rabbits were randomly divided into 3 groups(n=20),namely sham-operation group(Group S),ischemia-reperfusion group(Group I/R)and ischemia-reperfusion group with propofol treatment(Group P).Abdominal aorta of the rabbits in group I/R and group P were blocked by clamp for 40 min and then the clamp was removed.Propofol(30 mg·kg-1)was intravenously infused 10 min before blocking the aorta and at the time of reperfusion.Normal saline was intravenously infused at the same time points in the other two groups.Four rabbits of each group were randomly executed 1,2,3,5,7 days after surgery.Spinal cord tissues at L3-L4levles were harvested.Bioactivity of SOD1 was detected by ELISA and mRNA expression levels of SOD1,PI3K and AKT were detected by RT-PCR.ResultsOn the 1st day after the surgery,the bioactivity of SOD1 increased significantly in Group I/R and Group P as compared with that in Group S(P<0.05).On the 2nd day,compared with Group S,the bioactivity of SOD1 increased significantly in Group P(P<0.05),but there was no change in Group I/R(P>0.05).On the 3rd,the 5th and the 7th day,compared with Group S,the bioactivity of SOD1 decreased significantly in Group I/R(P<0.05),but there was no change in Group P(P>0.05).Linear regression analysis indicated that there was a positive correlation between the changes of SOD1 activity and the mRNA expression of SOD1,PI3K and AKT respectively in spinal cord tissues.ConclusionPre-and post-ischemic conditioning with propofolshows potent protective effects against SCIRI in the rabbit model.The mechanisms may be related to increased expression of SOD1 in the spinal cord tissues by activating PI3K/AKT signal transduction pathway.
Propofol;Spinal cord;Ischemia-reperfusion;Superoxide dismutase
R971.2;R965
A
1004-0781(2014)10-1273-05
2013-09-17
2014-02-07
*湖北省卫生厅青年人才基金项目(QJX2010-14)
余奇劲(1972-),男,湖北咸宁人,副主任医师,硕士生导师,博士,研究方向:围术期中枢神经功能调控与麻醉安危。电话:(0)13476053817,E-mail:yqj2566@sina.com。

