汉黄芩素对高脂血症小鼠的保护作用
杨波,周承志,张道亮,胡有志,肖金凤
(湖北中医药大学附属医院、湖北省中医院心内科,武汉 430061)
汉黄芩素对高脂血症小鼠的保护作用
杨波,周承志,张道亮,胡有志,肖金凤
(湖北中医药大学附属医院、湖北省中医院心内科,武汉 430061)
目的 研究汉黄芩素对饮食诱导下高脂血症小鼠模型的防治作用。方法将30只C57小鼠随机分为正常对照组、模型对照组和药物干预组,每组10只。正常对照组给予普通饮食,模型对照组给予高脂饲料,药物干预组在高脂饲料基础上添加汉黄芩素500 mg·kg-1。观察汉黄芩素对模型小鼠血脂、脂代谢关键酶的影响,探讨其降脂机制。结果经过12周的高脂饮食,模型小鼠形成了明显的高脂血症,体质量增加,内脏脂肪增多,脂肪指数增加(P<0.05)。药物干预组较模型对照组体质量减轻(P>0.05),内脏脂肪明显减少(P<0.01),脂肪指数显著下降(P<0.05)。汉黄芩素明显降低总胆固醇(TC)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL),但对三酰甘油(TG)影响不大。药物干预组较模型对照组肝脂酶(HL)与脂蛋白脂酶(LPL)活性恢复(P<0.05),羟甲基戊二酸单酰辅酶A还原酶活性被抑制(P<0.01);分子生物学研究显示其降脂效果可能与脂合成基因(SREBP-1c,FAS,PPARγ)与脂质代谢基因(PPARα,CPT-1)的转录调控相关。结论汉黄芩素能够很好地治疗高脂血症,这一作用可能与调节脂酶活性和影响脂质合成与氧化基因相关。
汉黄芩素;高脂血症;氧化代谢;酶活性
高脂血症是心血管疾病的高危因素。高脂血症的危害是隐匿、进行性和全身性的,防治高脂血症具有非常重要的临床意义[1-2]。汉黄芩素属黄酮类化合物,化学名2-羟基-4-甲氧基苯乙酮[3],相比黄芩中其他黄酮化合物,稳定性更高,且具有广谱的抗炎、抗氧化、增强免疫等作用[3]。此外,研究还证实其具有抗变态反应、降血糖、抗脂质过氧化作用[4-5]。因此,结合其药理特性,笔者认为汉黄芩素对高脂血症可能有较好的防治作用。笔者在本研究利用目前公认的高脂血症小鼠模型探索汉黄芩素对高脂血症的保护机制。
1 材料与方法
1.1 动物 SPF级雄性7周龄C57小鼠30只,体质量22~24 g,动物合格证号:SCXK(鄂)2011-0007,购于武汉大学动物实验中心。实验动物在SPF级动物房寄养[温度(23±2)℃,湿度(60±5)%],自由饮水、摄食,明暗周期12 h(7∶00~19∶00)。动物使用许可证号为:SYXK(鄂)2004-0019。
1.2 试药 汉黄芩素(南京泽朗医药科技有限责任公司,批号:CAS-NO:632-85-9,纯度:98%)。总胆固醇(total cholesterol,TC)试剂盒(批号:F002-2)、三酰甘油(triglycerides,TG)试剂盒(批号:F001-2)、高密度脂蛋白(high density lipoprotein,HDL)试剂盒(批号: F003-1),低密度脂蛋白(low density lipoprotein,LDL)试剂盒(批号:F004-2),均由南京建成生物工程研究所提供。羟甲基戊二酸单酰辅酶A(hydroxy methylglutaryl coenzyme A,HMG-CoA)还原酶试剂盒(批号:SBJ-M0611)、肝脂酶(hepatic lipase,HL)试剂盒(批号:SBJ-M0206)、脂蛋白脂酶(lipoprotein lipase, LPL)试剂盒(批号:SBJ-M0448),由南京森贝伽生物科技有限公司提供。反转录试剂盒购于北京天恩泽有限公司(批号:60906-50)。SYBRGreen购于罗氏有限责任公司。引物由生工生物工程(上海)股份有限公司合成。其余试剂均购自国药集团,为分析纯。饲料来源于北京协和医科大学实验动物学部。
1.3 实验方法
1.3.1 动物模型的建立 动物模型的建立参考文献[6]。所有小鼠先适应性喂养1周。而后随机分为正常对照组、模型对照组、药物干预组,每组10只。正常对照组给予普通饮食(脂肪12.4%,碳水化合物68.8%,蛋白质18.8%);模型对照组给予高脂饲料(脂肪37.1%,碳水化合物42.4%,蛋白质20.5%);药物干预组在高脂饲料基础上添加0.5%汉黄芩素(折合剂量为500 mg·kg-1),灌服,共干预12周。实验期间小鼠自由进食饮水。实验结束时,收集血液,离心,取上清液,冻存;剥离肝脏,保存于-80℃冰箱中,用于分子生化检测。
1.3.2 血脂检测 取血清500 μL,根据试剂盒操作步骤检测TC、TG、HDL、LDL。
1.3.3 检测脂代谢的关键酶 血清脂代谢关键酶的检测,包括:HL、LPL与HMG-CoA还原酶,按照试剂盒说明书操作。
1.3.4 Real-time PCR检测肝脏从头合成途径基因用Trizol Reagent试剂盒提取肝脏总RNA,逆转录获得cDNA。引物序列为:PPAR-α,F:TGGGGATGAAGAGGGCTGAG,R:GGGGACTGCCGTTGTCTGT;PPARγ,F:CAGGCTTGCTGAACGTGAAG,R:GGAGCACCTTGGCGAACA;SREBP-1c,F:CACTTCTGGAGACATCGCAAAC,R:ATGGTAGACAACAGCCGCATC; FAS,F:CTGCGGAAACTTCAGGAAATG,R:GGTTCGGAATGCTATCCAGG;CPT-1,F:AGGACCCTGAGGCATCTATT,R:ATGACCTCCTGGCATTCTCC;GAPDH,F:T-CACCACCATGGAGAAGGC,R:GCTAAGCAGTTGGTGGTGCA。荧光定量PCR进行扩增,按照两步法SYBR Real Time-PCR Kit(Roche)试剂盒说明书配制反应体系;温度循环参数:预变性95℃,10 min; 95℃,5 s;59℃,30 s;72℃,1 min。40个循环进行聚合酶链反应(polymerase chain reaction,PCR)扩增反应。每组取3个样本,每个样本点3个复孔,即每组9个数据进行统计分析。
1.3 统计学方法 所有数据用SPSS13.0版统计软件进行分析。计量资料以均数±标准误(±s)表示,多组间比较采用方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 经过12周的高脂饮食诱导,模型对照组小鼠出现明显的肥胖,表现为:体质量增加,内脏脂肪增多,脂肪指数增加(t分别为3.799 6,5.718 1, 4.895 1,P<0.01)。而药物干预后,小鼠体质量减轻,但差异无统计学意义(t=1.694 5,P>0.05),内脏脂肪明显减少(t=3.2937,P<0.01),且相应脂肪指数显著下降(t=2.2948,P<0.05),见表1。
表1 3组小鼠一般情况比较Tab.1 Comparison of general condition among three groups of mice ±s
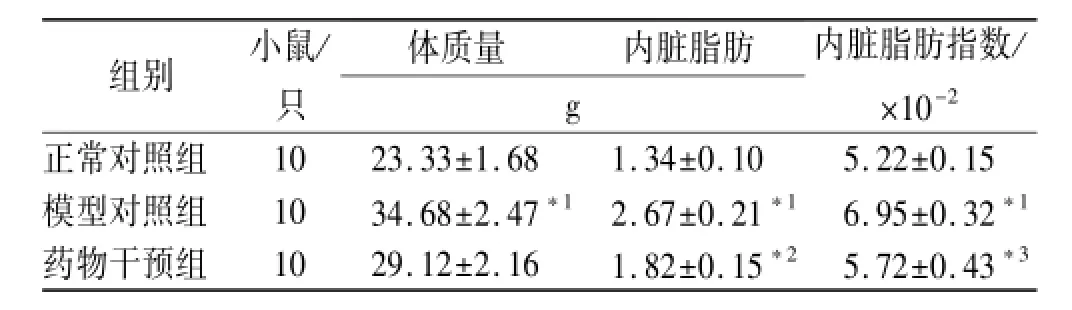
表1 3组小鼠一般情况比较Tab.1 Comparison of general condition among three groups of mice ±s
与正常对照组比较,*1P<0.01;与模型对照组比较,*2P<0.01,*3P<0.05Compare with normal control group,*1P<0.01;Compare with model control group,*2P<0.01,*3P<0.05
组别小鼠/只体质量内脏脂肪g内脏脂肪指数/ ×10-2正常对照组1023.33±1.681.34±0.105.22±0.15模型对照组1034.68±2.47*12.67±0.21*16.95±0.32*1药物干预组1029.12±2.161.82±0.15*25.72±0.43*3
2.2 汉黄芩素改善高脂诱导的高脂血症 高脂饮食诱导模型对照组小鼠出现明显的高脂血症,4项血脂指标均显著升高(t=2.356 7,2.802 5,2.195 0,3.568 9,P<0.05)。汉黄芩素干预可以明显降低TC、LDL、HDL(t= 2.149 7,2.161 9,2.294 3,P<0.05),但对血清TG影响不大(t=0.814 3,P>0.05),说明汉黄芩素的降脂效果是通过降低TC而非TG实现的(表2)。
2.3 汉黄芩素对脂代谢关键酶的影响 结果见表3。高脂饮食诱导后模型对照组HL与LPL活性明显降低(t=2.114 3,2.327 6,P<0.05),而HMG-CoA还原酶活性增强(t=2.861 7,P<0.05),汉黄芩素干预后HL与LPL活性得到恢复(t=3.087 6,2.468 9,P<0.05), HMG-CoA还原酶活性被抑制(t=2.9150,P<0.01)。
2.4 汉黄芩素降脂作用的机制 采用Real-time PCR验证汉黄芩素对脂代谢相关靶基因的影响。由图1可知,高脂饮食诱导从头合成通路的关键靶基因SREBP-1c、FAS mRNA分别上调446%(t=5.085 9,P<0.01), 339%(t=4.547 6,P<0.01),而介导脂质合成的另一通路的开关基因PPARγmRNA亦显著上升约为287%(t=3.285 0,P<0.01)。有关脂质氧化代谢的基因PPARα及CPT-1则分别下调56%(t=3.585 0,P<0.01),39%(t=2.623 4,P<0.05)。汉黄芩素干预后相应靶基因均有所恢复。
表2 3组小鼠血清TG、TC、LDL和HDL检测值Tab.2 Determination on blood TG,TC,LDL and HDL of three groups of mice mmol·L-1,±s

表2 3组小鼠血清TG、TC、LDL和HDL检测值Tab.2 Determination on blood TG,TC,LDL and HDL of three groups of mice mmol·L-1,±s
与正常对照组比较,*1P<0.05;与模型对照组比较,*2P<0.05Compare with normal control group,*1P<0.05;Compare with model control group,*2P<0.05
TGTCLDLHDL正常对照组组别小鼠/只100.75±0.122.18±0.420.52±0.101.34±0.15模型对照组101.32±0.21*14.01±0.50*10.88±0.13*12.32±0.23*1药物干预组101.10±0.172.62±0.41*20.55±0.08*21.69±0.15*2
表3 3组小鼠脂代谢关键酶测定值Tab.3 Determination on key enzymes of lipid metabolism in three groups of mice ±s
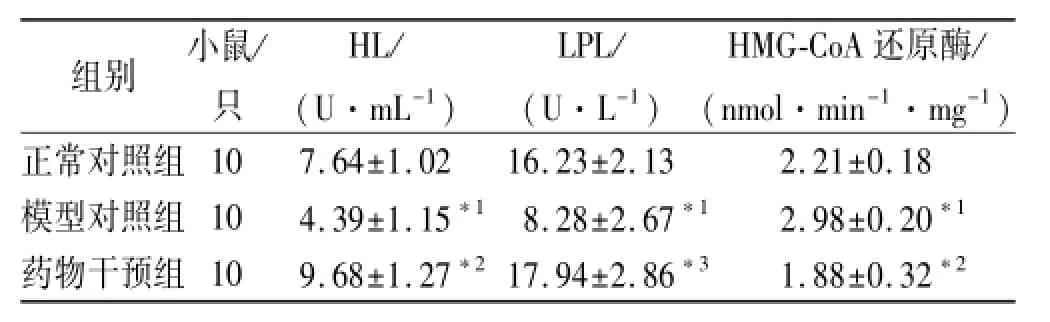
表3 3组小鼠脂代谢关键酶测定值Tab.3 Determination on key enzymes of lipid metabolism in three groups of mice ±s
与正常对照组比较,*1P<0.05;与模型对照组比较,*2P<0.05,*3P<0.01Compare with normal control group,*1P<0.05;Compare with model control group,*2P<0.05,*3P<0.01
组别小鼠/只HL/ (U·mL-1) LPL/ (U·L-1) HMG-CoA还原酶/ (nmol·min-1·mg-1)正常对照组107.64±1.0216.23±2.132.21±0.18模型对照组104.39±1.15*18.28±2.67*12.98±0.20*1药物干预组109.68±1.27*217.94±2.86*31.88±0.32*2
3 讨论
高脂血症是机体脂质代谢紊乱的重要临床表现,也是冠心病、糖尿病、代谢综合征等的发病基础。降血脂药物开发成为该领域的研究热点。目前越来越多的研究表明,黄酮类化合物有较好的降血脂作用,可改善脂质代谢,阻止脂质过氧化的链式扩增反应,从而延缓动脉粥样硬化的发生和发展[7-8]。
汉黄芩素来源于黄芩的根,也可见于半枝莲的根茎,其成分单一、药理作用明确、毒副反应小,安全性高[3]。从实验可以看出,汉黄芩素对小鼠高脂血症具有明显的防治作用,主要是通过降低TC而实现,对TG影响不大。研究结果证实汉黄芩素可显著增加HL与LPL的活性,同时降低HMG-CoA的活性。HL具有TG脂肪酶、甘油一酯脂肪酶、磷脂酶等多个活性[9]。LPL则广泛分布于毛细血管内皮细胞表面,它能与肝素结合成复合物,脱离后催化乳糜微粒与VLDL中的TG水解为甘油和脂肪酸[10]。HMG-CoA还原酶则是由NADPH供氢催化乙酰CoA生成甲羟戊酸,是合成胆固醇的限速酶。抑制HMG-CoA还原酶活性可减少胆固醇合成,进而消耗储存的胆固醇,还可促使肝脏细胞增加LDL-C受体的数量与活性,最终降低血中总胆固醇及LDL[11]。而高脂饮食诱导小鼠HDL升高,是因为小鼠的血脂谱与人类不同,小鼠的HDL相当于人类的LDL,因此汉黄芩素可降低相应的HDL血清水平。

A.脂质从头合成通路上靶基因的改变;B.PPARα与CPT-1mRNA的变化。与正常对照组比较,*1P<0.01,*4P<0.05;与模型对照组比较,*2P<0.05,*3P<0.01图1 汉黄芩素对高脂血症的作用机制(n=9)A.Changes of target genes in lipid synthesis pathway;B.The changes of PPAR α and CPT-1mRNA.Compare with normal control group,*1P<0.01,*4P<0.05;Compare with model control group,*2P<0.05,*3P<0.01Fig.1 Mechanism of wogonin on hyperlipidemia(n=9)
由于脂质的合成与代谢处于一个动态平衡,为此检测脂质合成的关键基因(SREBP-1c、FAS、PPARγ)及脂质氧化代谢的关键基因(PPARα、CPT-1)。SREBP-1c及其靶基因FAS介导了脂质的从头合成途径:从乙酰辅酶A合成至长链脂肪酸[12];而PPARγ则介导了脂质的其他合成路径,许多与脂代谢合成、转运、分解的基因均与它有密切关系,并参与到脂肪细胞的分化[13]。高表达的PPARγ能加强CD36、AP2及磷酸烯醇式丙酮酸羧激酶(PEPCK)等靶基因的上调[13]。本研究结果显示汉黄芩素降低了高脂饲料诱导下两靶基因的上调,说明其脂质合成抑制作用至少是双靶点调控,而对PPARγ的抑制也解释了减肥效应的缘由。而PPARα及其靶基因CPT-1则与脂质的氧化代谢密切相关[14],在汉黄芩素干预后PPARα显著上调。因此,笔者推测汉黄芩素的降脂作用是依赖于减少脂质合成和增加脂质氧化而实现的。
综上所述,本研究显示汉黄芩素对高脂血症有很好的防治效果,这一作用可能与其调控脂代谢关键酶活性、抑制脂质合成与增加脂质氧化代谢相关。
[1] JAIN K S,KATHIRAVAN M K,SOMANI R S,et al.The biology and chemistry of hyperlipidemia[J].Bioorg Med Chem,2007,15(14):4674-4699.
[2] BERTOLOTTI M,MAURANTONIO M,GABBI C,et al. Review article:hyperlipidaemia and cardiovascular risk [J].Aliment Pharmacol Ther,2005,22(Suppl 2):28-30.
[3] TAI M C,TSANG S Y,CHANG L Y,et al.Therapeutic potential of wogonin:a naturally occurring flavonoid[J]. CNS Drug Rev,2005,11(2):141-150.
[4] LI-WEBER M.New therapeutic aspects of flavones:the anticancer properties of Scutellaria and its main active constituents Wogonin,Baicalein and Baicalin[J].Cancer Treat Rev,2009,35(1):57-68.
[5] LIM B O,CHOUE R W,LEE H Y,et al.Effect of the flavonoid components obtained from Scutellaria radix on the histamine,immunoglobulin E and lipid peroxidation of spleen lymphocytes of Sprague-Dawley rats[J].Biosci Biotechnol Biochem,2003,67(5):1126-1129.
[6] PU P,GAO D M,MOHAMED S,et al.Naringin ameliorates metabolic syndrome by activating AMP-activated protein kinase in mice fed a high-fat diet[J].Arch Biochem Biophys,2012,518(1):61-70.
[7] PROCHAZKOVA D,BOUSOVA I,WILHELMOVA N. Antioxidant and prooxidant properties of flavonoids[J]. Fitoterapia,2011,82(4):513-523.
[8] PRASAIN J K,CARLSON S H,WYSS J M.Flavonoids and age-related disease:risk,benefits and critical windows[J]. Maturitas,2010,66(2):163-171.
[9] PERRET B,MABILE L,MARTINEZ L,et al.Hepatic lipase:structure/functionrelationship,synthesis,and regulation[J].J Lipid Res,2002,43(8):1163-1169.
[10] MERKEL M,ECKEL R H,GOLDBERG I J.Lipoprotein lipase:genetics,lipid uptake,and regulation[J].J Lipid Res,2002,43(12):1997-2006.
[11] SINGH N,TAMARIZ J,CHAMORRO G,et al.Inhibitors of HMG-CoA reductase:current and future prospects[J].Mini Rev Med Chem,2009,9(11):1272-1283.
[12] KOTZKAJ,MULLER-WIELANDD.Sterolregulatory element-binding protein(SREBP)-1:gene regulatory target for insulin resistance?[J].Exp Opin Ther Targets,2004,8 (2):141-149.
[13] MATSUZAWA-NAGATA N,TAKAMURA T,ANDO H,et al.Increased oxidative stress precedes the onset of high-fat diet-inducedinsulinresistanceandobesity[J]. Metabolism,2008,57(8):1071-1077.
[14] KIDANI Y,BENSINGER S J.Liver X receptor and peroxisome proliferator-activated receptor as integrators of lipid homeostasis and immunity[J].Immunol Rev,2012, 249(1):72-83.
DOI 10.3870/yydb.2014.10.014
Protection Effect of Wogonin on Mice with Hyperlipidemia
YANG Bo,ZHOU Cheng-zhi,ZHANG Dao-liang,HU You-zhi,XIAO Jin-feng
(Department of Cardiology, Hospital Affiliated to Hubei University of Chinese Medicine,Hubei Provincial Hospital of Traditional Chinese Medicine,Wuhan 430061,China)
ObjectiveTo explore the effects of wogonin on hyperlipidemia in mice and clarify the molecule mechanism.MethodsThirty mice were evenly divided into three groups:normal control group,model control group and treatment group.The normal control group was given normal diet,the model control group received high-fat diet,the treatment group received high-fat diet with wogonin(500 mg·kg-1).ResultsThe mice developed hyperlipidemia 12 weeks after starting the high-fat diet.The body weight,visceral fat and fat index were increased(P<0.05).After treatment,these indices were reduced(P<0.01).Wogonin significantly reduced the total cholesterol(TC),low density lipoprotein(LDL),high density lipoprotein(HDL),except the triglyceride(TG).Compared to the model control group,the hepatic lipase(HL)and lipoprotein lipase(LPL)activity in the treatment group were recovered(P<0.05),but HMG-CoA reductase activity was inhibited(P<0.01).Mechanistic study suggested that the lipid-lowering effect might be related to the lipid synthesis genes(SREBP-1c,FAS, PPARγ)and the lipid metabolism genes(PPARα,CPT-1).ConclusionWogonin can prevent hyperlipidemia,which might be related to the regulation of enzyme activity and the changes of lipid synthesis and oxidative metabolism.
Wogonin;Dyslipidemia;Oxidative metabolism;Enzyme activity
R965
A
1004-0781(2014)10-1310-04
2013-07-29
2013-10-29
杨波(1978-),男,安徽桐城人,讲师,主治医师,硕士,研究方向:心血管疾病的中西医结合治疗。电话:(0) 13307182140,E-mail:yangbotougao@163.com。
周承志(1974-),男,湖北武汉人,副教授,副主任医师,博士,研究方向:中西医结合治疗心脑血管疾病。电话:(0)18971328697,E-mail:acheng8341@163.com。

