双黄连粉针及其活性成分对大鼠细胞色素P450酶的体外抑制作用*
代晶,王丽聪,吴丹,涂碎萍,仇丽颖
(1.成都医学院药学院,成都 610083;2.西南民族大学化学与环境保护工程学院,成都 610041)
双黄连粉针及其活性成分对大鼠细胞色素P450酶的体外抑制作用*
代晶1,王丽聪1,吴丹1,涂碎萍1,仇丽颖2
(1.成都医学院药学院,成都 610083;2.西南民族大学化学与环境保护工程学院,成都 610041)
目的 考察双黄连粉针及其7种主要活性成分对大鼠肝微粒中细胞色素P450酶(CYP)1A、CYP2D和CYP3A酶的体外抑制作用。方法将CYP1A、CYP2D和CYP3A的探针底物(非那西丁、右美沙芬、咪达唑仑)分别与双黄连粉针及其7种活性成分(黄芩苷、连翘苷、连翘酯苷A、芦丁、绿原酸、咖啡酸、木樨草苷)在大鼠肝微粒中进行孵育反应,采用高效液相色谱(HPLC)法同时测定3种探针底物的含量,评价底物的代谢率是否被抑制。结果与空白对照组比较,双黄连粉针和黄芩苷对CYP2D和CYP3A有抑制作用,对CYP1A无影响;其他活性成分对三种酶无影响。结论双黄连粉针在与CYP2D和CYP3A底物合用时可能产生相互作用,黄芩苷可能是这种作用的主要效应物质。
双黄连粉针;黄芩苷;细胞色素P450;抑制作用
细胞色素P450酶(cytochrome P450,CYP)是生物体内重要的混合功能氧化酶,参与80%以上的药物代谢[1-2],并在药物相互作用中扮演重要角色,通过对药物-CYP的分析研究,可以指导临床安全有效地使用药物。双黄连是治疗细菌和病毒感染的较好制剂[3],在临床治疗中,常与其他药物联合使用。在与某些药物合用或按不同配方使用时,双黄连中有效成分的药动学发生改变[4-6],这提示双黄连与这些物质存在相互作用。鉴于CYP在药物研究中的重要地位,为提高双黄连粉针的用药安全,有必要研究双黄连粉针及其活性成分对CYP的影响。笔者在本实验以非那西丁、右美沙芬、咪达唑仑为探针底物,通过高效液相色谱(HPLC)法,研究双黄连粉针及其7种主要活性成分(黄芩苷、连翘苷、连翘酯苷A、芦丁、绿原酸、咖啡酸、木樨草苷)对大鼠体外肝微粒体中CYP1A、CYP2D、CYP3A酶的影响,以期为双黄连粉针药物相互作用的早期预测、避免不良反应和毒副作用提供科学参考。
1 材料与方法
1.1 动物 SPF级斯泼累格·多雷(Sprague Dawley, SD)大鼠10只,♂,8周龄,体质量(250±20)g,由成都达硕生物科技有限公司提供,合格证号:SCXK(川) 2013-24。饲养于成都医学院科研中心SPF级屏障系统动物实验室,使用许可证号:SYXK(川)2009-125,温度20~40℃,相对湿度(40~60)%,噪度<60 dB。
1.2 试药 非那西丁、阿普唑仑、氢溴酸右美沙芬、咪达唑仑、绿原酸对照品均购自中国食品药品检定研究院,批号依次为100095-198904,171218-200603, 100201-201003,171250-200401,110753-200413,纯度>98%。连翘苷、芦丁、黄芩苷、木樨草苷、咖啡酸对照品均购自成都曼思特生物科技有限公司,批号依次为11080301,11040302,11101403,12041703,10112201,纯度>98%。连翘酯苷A购自四川省维克奇生物科技有限公司,批号:120328,纯度>98%。双黄连粉针购自哈药集团中药二厂,批号:1104210,规格:每瓶600 mg。还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)购自美国Los Angeles公司,纯度>97%,批号:091467。甲醇和乙腈为色谱纯试剂,其他试剂均为分析纯。
1.3 仪器 Ultimate3000型高效液相色谱仪(美国Dionex公司),Biofuge stratos台式高速离心机(美国Thermo公司)。
1.4 溶液配制 分别取非那西丁、氢溴酸右美沙芬、咪达唑仑对照品适量,用甲醇稀释配制系列标准溶液,其中非那西丁溶液的浓度分别为1 000,500,200,100, 50,20,10,5 μmol·L-1;氢溴酸右美沙芬溶液的浓度为100,50,20,10,5,2,1,0.5 μmol·L-1;咪达唑仑的浓度为200,100,50,20,10,5,2,1 μmol·L-1。另取阿普唑仑(内标)对照品适量,用甲醇稀释配制浓度为50 mg·L-1。取双黄连粉针、黄芩苷、连翘苷、连翘酯苷A、芦丁、绿原酸、咖啡酸适量加甲醇配制成100 mg·L-1的溶液。取木樨草苷适量加甲醇配制成40 mg·L-1的溶液。取Tris和氯化镁(MgCl2)适量,加水配成浓度分别为0.1 mol·L-1和0.04 mol·L-1的溶液,用盐酸调pH为7.4,制备成Tris缓冲液。上述溶液置4℃冰箱备用。
1.5 肝微粒体的制备与测定 参照文献[7]方法,制备大鼠肝微粒体,测定其蛋白浓度。
1.6 孵育条件及样品处理 取非那西丁、氢溴酸右美沙芬和咪达唑仑对照品溶液适量,再分别取双黄连粉针及其7种活性成分溶液适量,上述溶液混合后挥干溶剂,加入肝微粒体溶液和Tris缓冲液,于37℃加入NADPH启动反应。此时,反应体系终体积为0.5 mL,肝微粒体蛋白终浓度为1 g·L-1,NADPH终浓度为1 mmol·L-1;非那西丁、氢溴酸右美沙芬和咪达唑仑的终浓度分别为50.0,5.0,10.0 μmol·L-1;双黄连粉针及其7种活性成分的终浓度为100或10 mg·L-1。 30 min后,将反应样品迅速置于冰浴中,并立即加入乙腈2.0 mL和内标溶液50 μL终止反应,涡旋混匀3 min,13 362×g离心10 min,取出上清液于45℃挥干溶剂。残留物用流动相200 μL溶解,涡旋1 min后,16 911×g离心10 min,取出上清液40 μL进样分析。按下式计算各探针底物的代谢消除率[8]。
探针底物代谢消除率(%)=(加入探针底物的量-测得探针底物的量)/加入探针底物的量×100%。
1.7 色谱条件 色谱柱为Chromsil C18(250 mm× 4.6 mm,5 μm),流动相为乙腈-0.01 moL·L-1磷酸氢二钾(含0.5%三乙胺,盐酸调节pH至7.50±0.02)= 40∶60,体积流量为1 mL·min-1,柱温为30℃。非那西丁、氢溴酸右美沙芬、咪达唑仑和阿普唑仑的检测波长分别为254,202,220,220 nm。进样体积为40 μL。
1.8 统计学方法 数据经SPSS13.0版统计软件进行单因素方差分析,数值以均数±标准差±s)表示。P<0.05为差异有统计学意义。
2 结果
2.1 专属性实验 取大鼠的空白肝微粒体溶液、空白肝微粒体加各探针底物和内标溶液,探针底物肝微粒体孵育30 min后的样品溶液,按“1.6”和“1.7”项方法进行处理和测定。测定结果见图1,在此条件下,各探针药物达基线分离,内源性物质不干扰测定。
2.2 线性关系及定量限 精密量取探针底物系列对照品溶液各50 μL,挥干溶剂加入肝微粒体溶液和Tris缓冲液制备系列浓度的质控样品,其终体积是0.5 mL,蛋白终浓度是1 g·L-1,非那西丁、氢溴酸右美沙芬、咪达唑仑的终浓度分别为0.50~100.00 μmol·L-1,0.05~10.00 μmol·L-1,0.10~0.20 μmol·L-1。按“1.6”和“1.7”项方法进行处理和测定(n=3)。以底物浓度为横坐标,底物与内标物的峰面积比值为纵坐标进行线性回归,同时以信噪比≥10计算定量下限。结果显示:非那西丁、氢溴酸右美沙芬、咪达唑仑分别在0.50~100.00 μmol·L-1,0.05~10.00 μmol·L-1,0.10~20 μmol·L-1线性关系良好,对应的回归方程分别为Y= 0.024 4X+0.010 9(r=0.999 3),Y=0.071 4X-0.007 2 (r=0.999 5),Y=0.091 0X-0.008 0(r=0.999 8)。定量下限依次为0.05,0.05,0.10 μmol·L-1。
2.3 精密度实验和回收率实验 精密量取探针底物对照品溶液适量,制备低、中、高3个浓度的质控样品溶液,每个浓度一式6份。按“1.6”和“1.7”项方法在1 d内进样分析,计算日内精密度,连续测定3 d,计算日间精密度。将测得的底物与内标峰面积之比代入回归方程,计算方法回收率。取同等浓度的各底物和内标的对照品溶液,直接挥干溶剂,流动相溶解后进样分析,将样品中各底物的峰面积与对照品峰面积进行比较,计算提取回收率,结果见表1。
2.4 稳定性实验 参照“2.3”项方法,制备低、中、高浓度质控样品溶液,分别置于室温和-20℃冰箱中。置于室温的样品分别于24和48 h后进行测定,结果RSD<6.2%。置于-20℃冰箱中的样品分别于3和7 d后测定,结果RSD<10.5%。表明各探针底物在室温48 h内稳定,在-20℃冰箱7 d内稳定。
2.5 双黄连粉针及其7种活性成分对CYP1A、2D、3A影响 按照建立的方法,测定CYP1A、CYP2D、CYP3A底物在各给药组中的代谢消除率,并与空白对照组比较。结果(表2)显示,与空白对照组相比,双黄连粉针和黄芩苷对CYP2D有抑制作用,在高浓度时对CYP3A有抑制作用,对CYP1A无影响;而连翘苷、连翘酯苷A、芦丁、绿原酸、咖啡酸和木樨草苷对这3种酶均无影响。
3 讨论
3.1 底物的选择 有学者以奥美拉唑为底物,考察双黄连注射液对CYP的影响,但该底物具有交叉性,由多个CYP亚型酶共同代谢,故未能明确指出双黄连注射液对哪种酶有影响[9]。非那西丁、氢溴酸右美沙芬和咪达唑仑分别是CYP1A、CYP2D和CYP3A的专属性底物,常作为探针测定上述酶的活性。本实验选择这3种底物考察双黄连粉针对CYP的影响,实验所得的结果更有针对性。
3.2 双黄连粉针的影响 本实验结果显示双黄连粉针对非那西丁的代谢无影响,对氢溴酸右美沙芬有抑制作用,在高浓度时对咪达唑仑有抑制作用。这提示双黄连粉针在与CYP1A底物联合用药时不会产生药物相互作用,而与CYP2D和CYP3A底物可能产生相互作用。研究显示,CYP3A和CYP2D底物众多,约有50%和30%临床药物是CYP3A和CYP2D的底物[2],这意味着双黄连粉针可能与很多药物都有相互作用。鉴于双黄连粉针对CYP2D和CYP3A的影响与其浓度相关的特点,建议双黄连粉针在与上述酶底物在联合用药时,应该考虑适当调整给药剂量或给药间隔时间,避免产生不良反应。
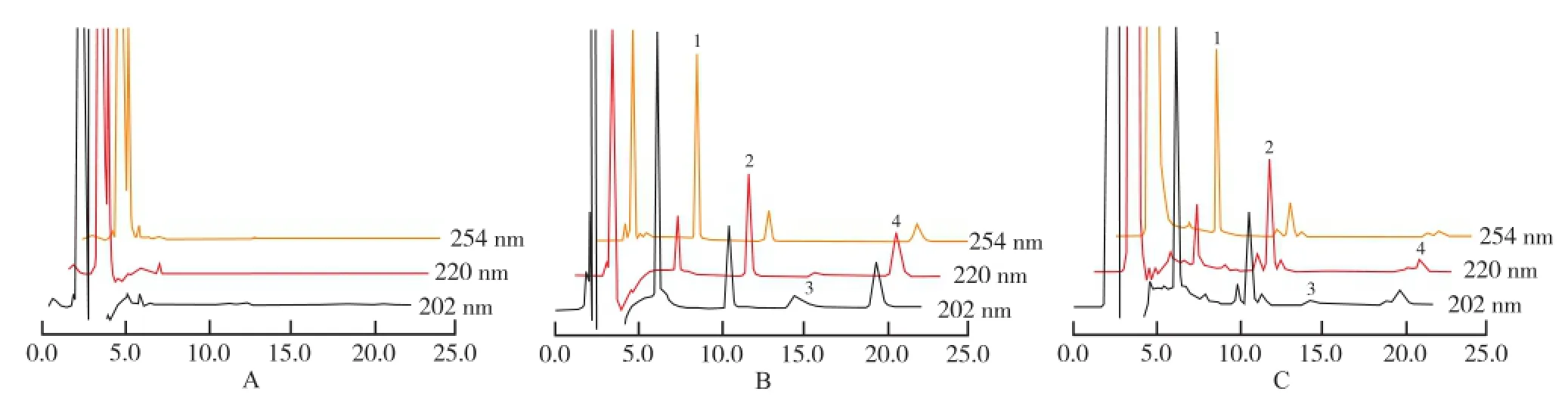
A.空白肝微粒体;B.含对照品的肝微粒体;C.孵育30 min后的肝微粒体;1.非那西丁;2.阿普唑仑;3.氢溴酸右美沙芬;4.咪达唑仑图1 3种肝微粒HPLC图A.blank liver micrsome;B.liver microsome spiked with reference substances;C.substrates incubated in liver microsome after 30min;1. phenacetin;2.alprazolam;3.dextromethorphan;4.midazolamFig.1 HPLC chromatographs of three types of liver micrsome
表1 探针底物精密度和回收率实验结果Tab.1 Precision and recovery of the probe substrates ±s
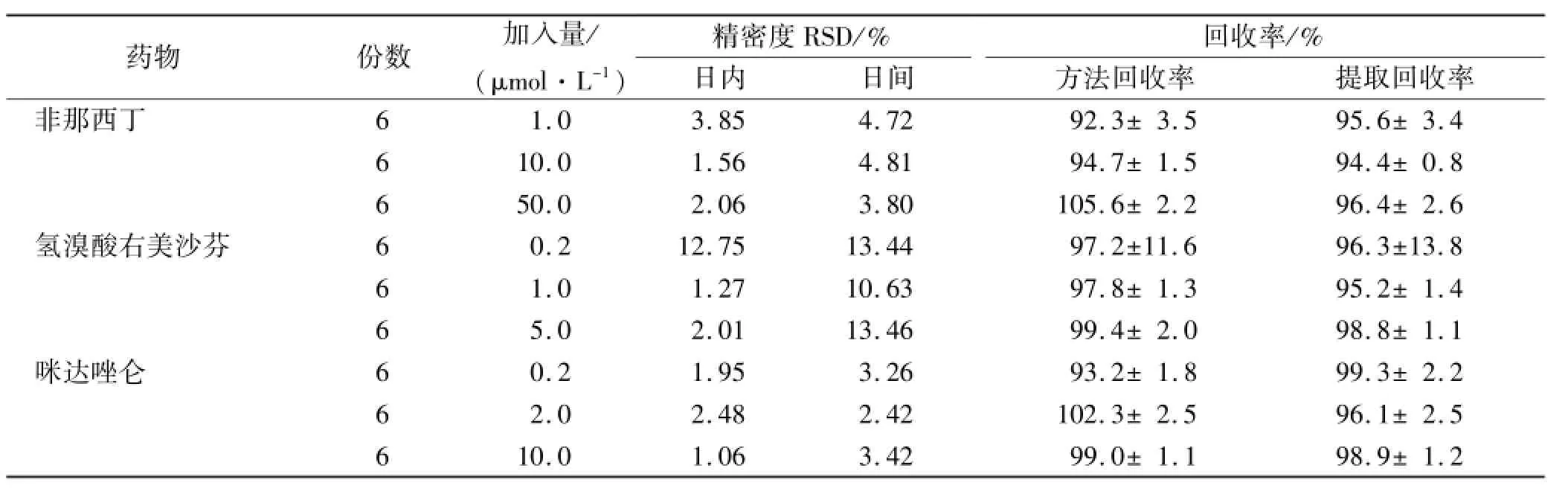
表1 探针底物精密度和回收率实验结果Tab.1 Precision and recovery of the probe substrates ±s
药物份数加入量/ (μmol·L-1)精密度RSD/%回收率/%方法回收率提取回收率非那西丁日内日间1.03.854.72 92.3±3.5 95.6±3.4 610.01.564.81 94.7±1.5 94.4±0.8 650.02.063.80 105.6±2.2 96.4±2.6氢溴酸右美沙芬60.212.7513.44 97.2±11.6 96.3±13.8 6 1.01.2710.63 97.8±1.3 95.2±1.4 6 5.02.0113.46 99.4±2.0 98.8±1.1咪达唑仑60.21.953.26 93.2±1.8 99.3±2.2 6 2.02.482.42 102.3±2.5 96.1±2.5 6 6 10.01.063.42 99.0±1.1 98.9±1.2
表2 各种成分对肝微粒体CYP1A、2D、3A底物代谢消除率的影响Tab.2 Effect of each constituent on metabolic rate of CYP1A、2D、3A substrates in liver microsome %,±s,n=3
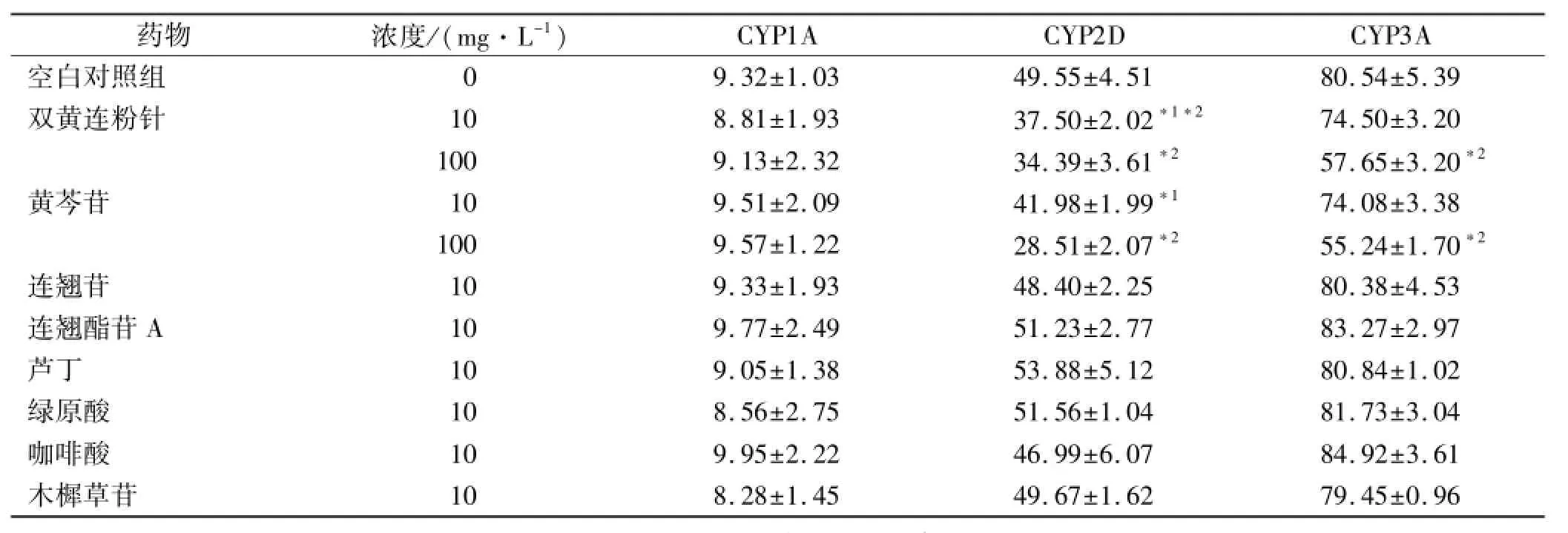
表2 各种成分对肝微粒体CYP1A、2D、3A底物代谢消除率的影响Tab.2 Effect of each constituent on metabolic rate of CYP1A、2D、3A substrates in liver microsome %,±s,n=3
与空白对照组比较,CYP2D,F=17.905;CYP3A,F=25.167;*1P<0.05;*2P<0.01Compared with control group CYP2D,F=17.905;CYP3A,F=25.167;*1P<0.05;*2P<0.01
CYP1ACYP2DCYP3A空白对照组药物浓度/(mg·L-1) 9.32±1.0349.55±4.5180.54±5.39双黄连粉针108.81±1.9337.50±2.02*1*274.50±3.20 1009.13±2.3234.39±3.61*257.65±3.20*2黄芩苷109.51±2.0941.98±1.99*174.08±3.38 1009.57±1.2228.51±2.07*255.24±1.70*2连翘苷109.33±1.9348.40±2.2580.38±4.53连翘酯苷A109.77±2.4951.23±2.7783.27±2.97芦丁109.05±1.3853.88±5.1280.84±1.02绿原酸108.56±2.7551.56±1.0481.73±3.04咖啡酸109.95±2.2246.99±6.0784.92±3.61木樨草苷0 108.28±1.4549.67±1.6279.45±0.96
3.3 活性成分的影响 黄芩苷在双黄连粉针中的含量最高,其次为绿原酸、连翘酯苷A、连翘苷,而咖啡酸、木樨草苷的含量则较少[10-13]。双黄连粉针静脉注射后,在体内迅速消除,各成分中只有黄芩苷的血药浓度能够达到100 mg·L-1,其他成分很难达到10 mg·L-1[14-16]。本实验根据各成分在双黄连粉针中相对含量和体内实验结果,将黄芩苷的孵育终浓度设定100和10 mg·L-1,其他成分为10 mg·L-1,以此考察在一般给药剂量下各成分的影响。实验结果显示,在上述浓度下,只有高浓度黄芩苷对CYP2D和CYP3A有影响,该结果与双黄连粉针一致。这表明在正常使用剂量下,黄芩苷可能是双黄连粉针与CYP相互作用的主要效应物质。然而双黄连粉针作为复方中药,其发挥作用的基础是活性物质群经多途径的整合而发挥其效应,虽然实验结果显示其他6种成分作为单体未能对CYP有影响,但其在体内是否对双黄连粉针和黄芩苷的效应有协同作用,尚需进一步深入研究。
[1] CUPP M J,TRACY T S.Cytochrome P450:new nomenclature and clinical implications[J].Am Fam Physician,1998,57 (1):107-116.
[2] MARCELLA M,GENY G M M,RUBEN DE K.Species differences between mouse,rat,dog,monkey and human CYP-mediated drug metabolism,inhibition and induction [J].Exp Opin Drug Metab Toxicol,2006,2(6):875-894.
[3] 谢子任.双黄连粉针剂的组分及药用价值[J].中国医药导报,2009,6(32):146-147.
[4] 曾凡林,崔红花,沈志滨,等.地塞米松对注射用双黄连中绿原酸在大鼠体内的药动学影响[J].现代药物与临床,2010,25(1):45-48.
[5] DI B,FENG N P,LIU W Y.Pharmacokinetic comparisons ofshuang-huang-lianwith the different combinations of its constitutional herbs[J].J Ethnopharmacol,2006,107(3): 401-405.
[6] 李朝霞,倪健,方冠南,等.黄芩苷对绿原酸在家兔体内药动学的影响[J].中国中药杂志,2010,35(24):3291-3293.
[7] 代晶,杨万清,廖林川.氯胺酮多次给药对大鼠肝微粒体内细胞色素P450-2B酶的诱导作用[J].成都医学院学报,2012,7(3):383-385.
[8] 韦灵玉,张玉杰,魏宝红,等.黄连黄芩及配伍诱导对大鼠肝微粒体5种CYP亚酶活性的影响[J].中国中药杂志,2013,38(9):1426-1429.
[9] 于伟凡.双黄连注射液对大鼠CYP的影响[D].郑州:郑州大学,2009:1-22.
[10] 国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010:846-848.
[11] 卞婷婷,安益强,汤道权,等.HPLC法同时测定双黄连冻干粉中11种成分的含量[J].药物分析杂志,2012,32 (1):52-56.
[12] 孙永慧,李文春.HPLC同时测定双黄连粉针剂中5种成分的含量[J].中成药,2010,32(1):65-69.
[13] 黄蓓蓓,贺帅.微乳液相色谱法同时测定注射用双黄连冻干粉中三组分的含量[J].医药导报,2013,32(1): 92-95.
[14] YE J,SONG X W,LIU Z H,et al.Development of an LC-MS method for determination of three active constituents ofshuang-huang-lianinjectioninratplasmaandits application to the drug interaction study of Shuang-huanglianfreeze-driedpowdercombinedwithlevofloxacin injection[J].J Chromatogr B,2012,898(12):130-135.
[15] 周雪玲,孔雪姣,袁颖琳,等.注射用双黄连粉针在大鼠体内的药动学分析[J].中国实验方剂学杂志,2013,19 (24):168-171.
[16] 李秋红,刘佩莉,冯宇飞.双黄连粉针不同剂量给药后黄芩苷的药动学及唾液中的分布[J].中国现代应用药学,2009,26(1):3-5.
DOI 10.3870/yydb.2014.10.004
In Vitro Inhibition of Cytochrome P450in Rats Liver Microsomes by Shuanghuanglian Injection Powder and Its Active Components
DAI Jing1,WANG Li-cong1,WU Dan1,TU Sui-ping1,QIU Li-ying2
(1.School of Pharmacy,Chengdu Medical College,Chengdu 610083,China;2.College of Chemistry and Environment Protection Engineering,Southwest University of Nationality,Chengdu 610041,China)
ObjectiveTo evaluate the inhibition effects ofshuanghuanglianinjection powder and its active components on the activities of CYP1A,CYP 2D and CYP 3A in rats liver microsomes.MethodsThree probe substrates including phenacetin for CYP1A,dextromethorphan for CYP2D and midazolam for CYP3A were incubated withshuanghuanglianinjection powder and the active components(baicalin,phillyrin,forsythiaside A,lutin,chlorogenic acid,coffeic acid and lutiolin)in rat liver microsomes.Contents of three probe substrates were simultaneously determined by HPLC to evaluate the metabolic rates.ResultsShuanghuanglianinjection powder and baicalin inhibited the activities of CYP2D and CYP 3A,but didn't affect CYP1A.The other active components showed no effect on CYP1A,CYP2D and CYP3A.ConclusionDrug-drug interactions may occur when combiningshuanghuanglianpowder injection with CYP2D and CYP 3A substrates and baicalin may be the effector substance responsible for the interactions.
Shuanghuanglianinjection powder;Baicalin;Cytochrome P450;Inhibition
R286;R965
A
1004-0781(2014)10-1269-05
2014-02-19
2014-03-31
*国家级大学生创新创业训练计划项目(20133705006);四川省教育厅理科重点项目(12ZA026)
代晶(1979-),女,吉林吉林人,讲师,博士,研究方向:药物代谢与药动学。电话:028-62308639,E-mail:daijing320@126.com。
仇丽颖(1980-),女,辽宁锦州人,讲师,博士,研究方向:生物药物分析与药品质量控制。电话:028-85522315,E-mail:qiu7992@sina.com。

